浅谈高三《化学平衡》的复习
2016-01-29曲永晴赵扬
曲永晴 赵扬
【摘要】 回顾这几年的高考题,有关化学平衡方面的考题出现率非常高,如何有效的复习化学平衡等相关知识点,使学生达到《考试大纲》的要求,是摆在所有高三教师面前的课题。下面笔者对高三如何对化学平衡进行有效复习,谈谈个人的几点看法。
【关键词】 高三 化学复习
【中图分类号】 G633.8 【文献标识码】 A 【文章编号】 1992-7711(2015)12-098-010
一、 研究大纲,明确要点
《考试大纲》是纲领,是命题专家写出来指导性的材料,对高考出题有指导作用。教师和学生认真阅读和研究,就会加深对高考的理解,就会在高考复习中事半功倍。了解、有效的使用《考试大纲》,减少复习过程中的盲目性,从而提高复习的效率和实效,在高考中发挥最佳的水平。
二、研究高考,确定方向
在高考指挥棒作用下,为了减轻学生高三学习的复习压力,提高复习的效率,就需要对近两年的高考题进行分析总结,通过对高考考题的分析总结,把握教学的方向,提高高三复习教学的针对性、有效性.
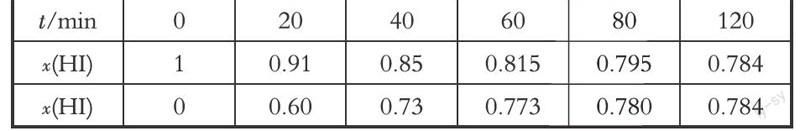
【2015新课标Ⅰ卷理综化学】(4)Bodensteins研究了下列反应:2HI(g) H2(g) + I2(g)在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
① 根据上述实验结果,该反应的平衡常数K的计算式为: 。
② 上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为 (以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正= min-1
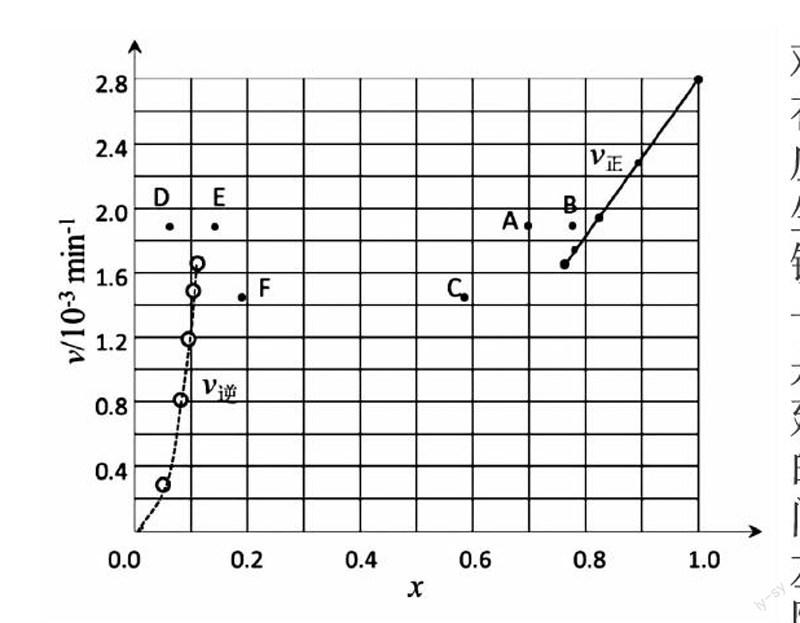
③ 由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为 (填字母)
高考题分析:试题难度为很难等级特别是在平衡常数知识的迁移应用,给出的题设情境考生不容易进入。(4)②关键是要记得平衡标志之一 v正= v逆,是图像题很好的知识构建。找到k正、k逆和K的联系就已突破。(4)③问的图像要能快速识别左边曲线是逆反应速率随x(H2)的变化,右边曲线是正反应速率随x(HI)的变化(仔细看了下图,好像已标明v正、v逆,不标也可按解析的方法分析)。虽然横坐标的坐标是共用的,但在左、右两边横坐标的含义是不同的。分析平衡移动导致横坐标变化时一定要注意这一点。
经过这几年高考题分析,对平衡常数和转化率的考察,速率和平衡的影响因素以及平衡图像的考察一直作为考查的重点。特别是图像的考查已经从常规的某一量时间曲线,或者是某一量条件曲线转变为纵轴不确定量,不限定物质。平很常数从表达式到列示,到数值和单位全方位的考查,也出现了基本定义的迁移题,考查学生的应用迁移能力。综合看2016年高考结合热化学、电化学、甚至结合有机反应,结合的角度和宽度更广更深。
三、研究学情,确定重点
学生对化学平衡普遍存在这如下问题:
1. 对化学平衡状态与化学反应限度的理解存在误区。
2.对平衡移动规律理解困难。
3.平衡图像的分析存在困难。
4.计算能力差,三行式的应用,平衡常数和转化率的计算。
研究学情,通过问卷和小测等方式了解学生出现的问题,及时准确的解决问题。
四、合理安排,深化知识
1.化学反应速率的知识点:
(1)高中阶段研究的是对于密闭容器的气体和溶液中的粒子的浓度问题。
(2)净速率是宏观感受到的反应速率,是正逆反应速率的差。
(3)压强对反应的影响是通过浓度实现的。
2.化学平衡的知识点:
(1)平衡的判断:正逆反应速率相等即平衡;单一组分,量不变即平衡;总体的量,m(总)在全是气体时不能用来判断是否达到平衡,n(总)在前后气体系数相等不能用来判断是否达到平衡,М(平)在m(总)和n(总)都不能用来判断时也不行,ρ在恒容下且全是气体时不能用来判断是否达到平衡,P(总)在恒容且前后气体系数相等不能用来判断是否达到平衡。总而言之,未平衡时“一直在变化的量”,平衡时一定“不变”,就可以作为判断是否达到平衡的标志。
(2)平衡影响因素及平衡的移动:升高温度平衡向吸热方向移动;增加某一浓度平衡向减少它的方向移动;增加压强平衡向着系数小的方向移动;催化剂不能改变平衡的方向;总之“改变一种改变平衡向着减弱这种改变的方向移动,却无法扭转这种改变”。
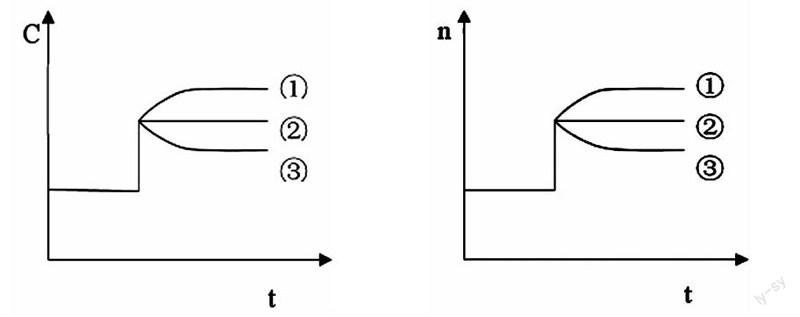
(3)平衡的图像:最容易错的是以下两个图像。
这两条曲线中的①②③是在加压条件下,前后系数不同情况下浓度的改变,③也可以看成是普通的增加浓度后变化曲线。压强的增加可以看做是物质的量不变缩小容器体积或者是体积不变增加物质的量。温度和催化剂是不可能形成这样的图像的。
3.平衡常数:
(1)是温度的常数,由温度引起的平衡正移K值增加。
(2)平衡常数的单位随着表达式的不同而有所变化。
4.反应进行的方向和程度
(1)任意条件下的生成物浓度的幂乘积比上反应物物浓度的幂乘积是浓度商,与平衡常数的比较来判断反应进行的方向。
(2)熵增指的混乱度增加的过程,主要表现为微粒活动范围越大和数量越多熵增越多,比如固体变为气体活动范围增加。熵增是自发的条件,放热也是自发的条件,同时满足正向自发,否则有条件自发,同时不满足正向一定不自发。
(注明:曲永晴是辽宁省大连市一○八中学学生)
