神经外科术后患者静脉输注替考拉宁脑脊液药物浓度研究
2016-01-26康建磊武元星于书卿
康建磊,武元星,于书卿,王 强
(1 郑州大学附属肿瘤医院,河南 郑州 450008; 2 首都医科大学附属北京天坛医院,北京 100050)
神经外科术后患者静脉输注替考拉宁脑脊液药物浓度研究
康建磊1,武元星2,于书卿2,王强2
(1 郑州大学附属肿瘤医院,河南 郑州450008; 2 首都医科大学附属北京天坛医院,北京100050)
[摘要]目的了解神经外科术后患者静脉输注替考拉宁时脑脊液药物浓度,探讨神经外科手术破坏血脑屏障后是否可增加脑脊液药物浓度,以及药物持续泵入对脑脊液药物浓度的影响。方法选择神经外科术后留置术区/脑室引流管的患者,分为常规给药组(替考拉宁400 mg,30 min泵入,1次/12 h重复给药)和持续给药组(替考拉宁400 mg,30 min泵入,再以200 mg,1次/6 h持续泵入),于给药后相应时间点采集脑脊液标本检测替考拉宁浓度。结果常规给药组脑脊液替考拉宁浓度泵入后即刻浓度为(0.004±0.0123)mg/L,泵入后1 h达峰值(0.712±1.028)mg/L,后逐渐下降,泵入后12、18、24 h分别为(0.254±0.222)、(0.173±0.152)、(0.355±0.207)mg/L。持续给药组脑脊液替考拉宁泵入后即刻浓度为(0.017±0.020)mg/L,4 h后达峰值(0.587±0.255)mg/L,泵入后6、12、18、24 h分别为(0.429±0.416)、(0.325±0.254)、(0.476±0.686)、(0.318±0.464)mg/L,6 h后药物浓度相对稳定,介于(0.318±0.464)~(0.476±0.686)mg/L。常规给药组、持续给药组的AUC0—24 h分别为5.590 mg/L·h、9.082 mg/L·h。两组患者仅峰值附近区域替考拉宁浓度达到凝固酶阴性葡萄球菌(CNS)MIC50,但其浓度高于CNS MIC50的时间占整个给药时间的比例远小于50%;两组患者脑脊液替考拉宁浓度均未能达到金黄色葡萄球菌MIC50。结论持续输注替考拉宁后,患者脑脊液药物浓度较常规给药组有所增加,但仍未能达所要求的MIC;结合血药浓度的实验,血液浓度增高有利于脑脊液药物浓度增加,可考虑适当增加剂量以达到临床治疗目的。
[关键词]替考拉宁; 持续输注; 药代动力学; 药效动力学; 脑脊液药物浓度
[Chin Infect Control,2015,14(12):798-802]
首都医科大学北京天坛医院感染流行病学调查资料[1-2]显示,神经外科术后颅内感染革兰阳性细菌主要是凝固酶阴性葡萄球菌(coagulase negative staphylococcus,CNS)和金黄色葡萄球菌(Staphylococcusaureus,S.aureus)。替考拉宁对这两种细菌具有良好的抗菌活性,但是由于替考拉宁血脑屏障的透过率较低[3-4],虽有个案[5-6]报道,替考拉宁用于颅内感染的治疗,但其仍不被广泛应用于颅内感染的治疗。考虑到神经外科颅内病变及手术对血脑屏障的破坏[7],可能会导致替考拉宁在术后患者脑脊液中浓度增加。为验证神经外科手术后药物穿透率是否增加,是否能达到有效抗菌浓度,以及延长药物输注时间对药物浓度的影响,开展了本项研究。
1对象与方法
1.1病例选择选择年龄为18~65岁的开颅手术术后保留术区/脑室引流,且医嘱给予替考拉宁预防颅内感染的患者。患者既往无心、肺、肝、肾等功能不全。研究的知情同意书由患者家属签署。
1.2替考拉宁给药和标本采集方案替考拉宁(商品名:他格适),法国赛诺菲-安万特公司(Gruppo Lepetit S.p.A.)生产,规格200 mg/瓶。常规给药组:400 mg,1次/12 h,每次使用50 mL生理盐水溶解替考拉宁,30 min精确泵入;持续给药组:50 mL生理盐水溶解400 mg,30 min精确泵入,再以200 mg,1次/6 h持续泵入。在泵入后0、0.5、1、2、3、6、12、18、24 h,抽取患者脑脊液2~2.5 mL,4 000 r/min迅速离心3~5 min,取上清液置于-20℃冰箱保存,并尽快转运至北京天坛医院药理实验室,-70℃冰箱保存;再根据实验设备及标本采集情况,送往中国医学科学院北京协和医院医药生物技术研究所分析测试中心,最终同期检测,标本最长保存时间8个月。
1.3替考拉宁浓度测定采用液相色谱质谱仪(LC-MS/MS)测定脑脊液标本中替考拉宁浓度。
1.3.1仪器设备采用Thermo U-3000双三元液相色谱仪(双三元低压梯度泵、自动在线脱气机、自动进样器、柱温箱、二极管阵列检测器),变色龙7.1工作站,Thermo LTQ XL 质谱仪,OHAUS CP214电子天平,Mettler Toledo Seven Easy pH计,KH-500超声清洗器(昆山禾创超声仪器公司)。
1.3.2标准曲线的绘制精密称取Toronto Research Chemicals Inc提供的替考拉宁对照品10.02 mg(纯度:90%),置10 mL容量瓶中,加水溶解并定容至刻度、摇匀,即得对照储备液(1 002 mg/L)。分别取替考拉宁对照储备液适量,用水稀释至浓度分别为0.025、0.05、0.1、0.5、1.0、2.0、5.0、10.0 mg/L的对照品溶液。分别精密量取上述对照品溶液100 μL,置于1.5 mL离心管中,加入空白血浆300 μL,漩涡混匀,配成标准含药脑脊液,加入内标氢溴酸东莨菪碱溶液(500 mg/L)20 μL,加入600 μL 乙腈/三氯甲烷(2∶1)漩涡振荡5 min,于4℃静置10 min后,16 000 g离心10 min,取上清液用0.22 μm滤膜过滤,进行LC-MS/MS分析。计算替考拉宁峰面积AS和内标峰面积Ai的比值(Y)与脑脊液替考拉宁浓度(X)进行加权(1/x2)回归计算,得目标物的工作标准曲线。
1.3.3样品处理和测定样本解冻后,放置室温,涡旋混合,按“标准曲线”项下操作,取上清液进行LC-MS/MS分析,记录峰面积。将样品溶液主成分峰面积代入工作标准曲线,结合替考拉宁标准品纯度值(90%),计算各样品中替考拉宁的实际含量。

2结果
2.1患者基本情况2012年2—6月,常规给药组共收集患者15例,其中男性9例、女性6例,年龄30~65岁,平均年龄(49±11)岁,体重53~95 kg,平均体重(71.3±13.6)kg;其中胶质瘤7例,脑膜瘤4例,中枢神经细胞瘤、鞍区血管外皮细胞瘤、血肿清除术和垂体瘤术后血肿清除术各1例。2012年7—9月,持续给药组共收集患者11例,其中男性5例、女性6例,年龄18~65岁,平均年龄(51±15)岁,体重49~73 kg,平均体重(63.2±7.2)kg;其中胶质瘤5例,脑膜瘤2例,动静脉畸形、桥小脑角区(CPA)神经鞘瘤、颈静脉孔神经鞘瘤和CPA表皮样囊肿各1例。所有患者均于术后12 h内开始用药。患者基本情况见表1。
2.2标准曲线脑脊液替考拉宁浓度工作标准曲线: Y=-9.75776e-005+0.00761238X,相关系数R=0.9990。依据标准曲线计算患者各时间点脑脊液中替考拉宁浓度,结果见表2。常规给药组脑脊液替考拉宁浓度泵入后即刻浓度为(0.004±0.0123)mg/L,泵入后1 h达峰值(0.712±1.028)mg/L,后逐渐下降,泵入后12、18、24 h分别为(0.254±0.222)、(0.173±0.152)、(0.355±0.207)mg/L。持续给药组脑脊液替考拉宁泵入后即刻浓度为(0.017±0.020)mg/L,4 h后达峰值(0.587±0.255)mg/L,泵入后6、12、18、24 h分别为(0.429±0.416)、(0.325±0.254)、(0.476±0.686)、(0.318±0.464)mg/L,6 h后药物浓度相对稳定,介于(0.318±0.464)~(0.476±0.686)mg/L。
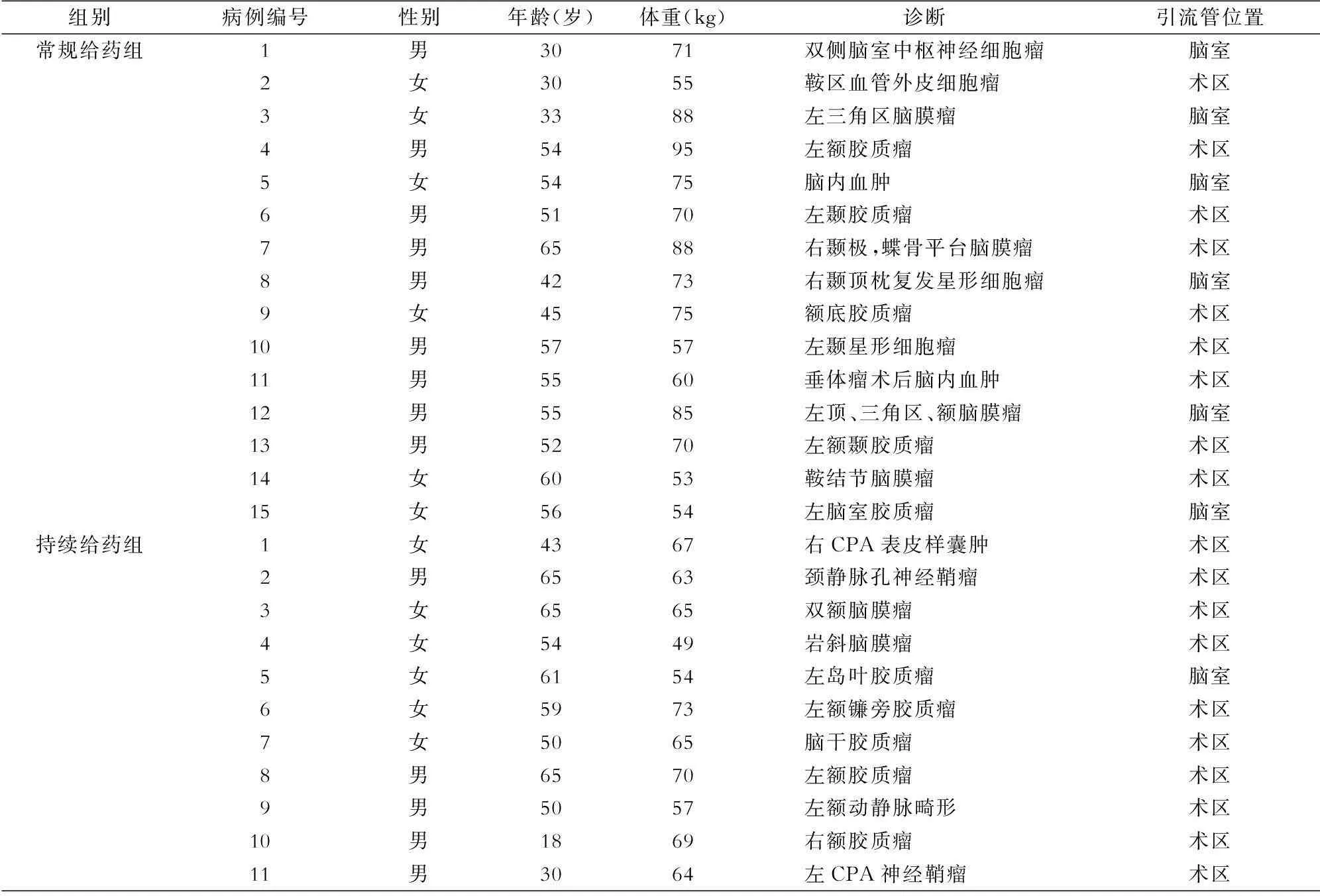
表1 两组患者基本情况
2.3患者脑脊液替考拉宁浓度-时间曲线常规给药组、持续给药组的AUC0—24 h分别为5.590、9.082 mg/L·h。两组患者仅峰值附近区域替考拉宁浓度达到CNS MIC50,但其浓度高于CNS MIC50的时间占整个给药时间的比例远小于50%。见图1。两组患者脑脊液替考拉宁浓度均未能达到金黄色葡萄球菌MIC50。

表2 两组患者各时间点脑脊液替考拉宁浓度(mg/L)
Range:表示最小至最大的测量值
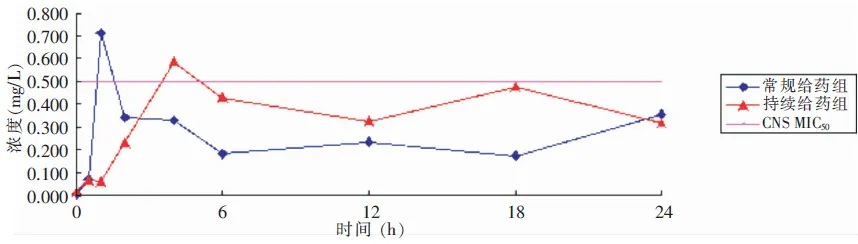
图1 脑脊液中替考拉宁浓度-时间曲线
3讨论
由于脑脊液标本储存时间不能过长,且较难收集,检测标本例数较少。因此未能发现药物浓度数值波动与患者年龄、体重、病灶和手术特点、脑脊液引流方式、入组开始用药时间等因素的明确关系。同时,由于治疗需要,给药后引流管并未关闭,入组患者的引流量各不相同,影响脑脊液中的药物浓度。加上标本采集时间误差,标本储存时间不同等,导致本组数据标准差较大。参考既往研究数据[11],显示此类研究数据标准差均较大。由于影响因素众多,加上脑脊液内药物浓度受血-脑屏障的破坏程度不同,数据变异大是普遍现象。
检测结果显示,神经外科术后患者脑脊液中的替考拉宁浓度符合文献报道的<1 mg/L[12-14],未能提示颅内病变及神经外科手术后,患者脑脊液替考拉宁浓度升高;个别患者脑脊液替考拉宁浓度较高(常规组5号最高浓度达3.080 mg/L),个别患者未检出,考虑与个体差异、肿瘤的大小、位置、脑脊液引流量等有关,也可能与术后激素、甘露醇等的使用有关,上述差异也可能真实地反映了脑脊液中替考拉宁浓度,所以研究结果中未剔除变异较大的极值。
对比两组患者脑脊液药物浓度,发现24 h内持续给药组患者药物浓度基本高于常规给药组,同时计算两组AUC0—24 h发现,持续给药组AUC0—24 h为9.082 mg/L·h,高于常规给药组(5.590 mg/L·h)近1倍,提示持续给药会增加脑脊液药物浓度。结合既往实验[11]结果,考虑浓度的升高与血药浓度的升高有关。目前,替考拉宁透过血脑屏障的机制还不清楚,可以推测脑内外药物浓度差的提高,有利于脑内药物浓度的增加。为达到有效的脑脊液药物浓度,可考虑增加替考拉宁的给药剂量。文献[15-16]报道,日剂量可用至1 200 mg, 未见明显不良反应,其中Cruciani等[16]报道了1例分流术后感染患者,采用替考拉宁治疗1 200 mg/d,测得脑脊液替考拉宁浓度达1.5~2 mg/L,故可尝试进一步加大药物剂量,以增加脑脊液中药物浓度。增大剂量可能导致患者不良反应增加,以及经济负担加重,可考虑通过特殊给药途径,如脑室给药、鞘内注射等提高脑脊液内药物浓度,改善疗效[16-17],但其利弊有待进一步研究证实。
本组研究结果提示, 持续输注替考拉宁后,患者脑脊液药物浓度较常规给药组有所增加,但仍未能达所要求的MIC,结合既往文献[16]结果,提高替考拉宁使用剂量有利于脑内药物浓度的增加,因而可考虑适当增加剂量或者直接采用局部给药的方式,以达到临床治疗目的。
[参 考 文 献]
[1]荆楠,唐明忠,刘志忠,等.神经外科术后颅内感染脑脊液病原菌分布和耐药性分析[J].中国实验诊断学,2012,16(7):1272-1274.
[2]徐明,石广志,唐明忠,等.1997~2010年某院神经外科患者脑脊液分离菌及其耐药性研究[J].中华实验和临床感染病杂志,2012,6(3):202-208.
[3]Kim KS, Hang JH, Bayer AS. Efficacy of teicoplanin in experimental group B streptococcal bacteremia and meningitis[J].Chemotherapy,1987,33(3):177-182.
[4]Rowland M. Clinical pharmacokinetics of teicoplanin[J].Clin Pharmacokinet, 1990,18(3):184-209.
[5]Krcméry V Jr.Teicoplanin plus ceftazidime in the treatment of bacterial meningitis-a case report[J].Infection,1991,19(4):255.
[6]Arda B, Yamazhan T, Sipahi OR,et al.Meningitis due to methicillin-resistantStaphylococcusaureus(MRSA): review of 10 cases[J].Int J Antimicrob Agents, 2005,25(5):414-418.
[7]Wang JF, Wang Q, Zhao LH, et al. Blood-brain barrier penetration of cefepime after neurosurgery[J].Chin Med J (Engl),2007,120(13):1176-1178.
[8]Sharma V, Jindal N. In vitro activity of vancomycin and teicoplanin against coagulase negative staphylococci[J].Oman Med J,2011,26(3):186-188.
[9]Caiaffa Filho HH, Lima Mde P, Sinto SI, et al.Teicoplanin and vancomycin susceptibility inStaphylococcusaureusand coagulase-negative staphylococci[J]. Rev Assoc Med Bras, 1994, 40(2):77-80.
[10] Tascini C, Flammini S, Leonildi A,et al. Comparison of teicoplanin and vancomycin in vitro activity on clinical isolates ofStaphylococcusaureus[J].J Chemother,2012,24(4):187-190.
[11] 武元星,陈光强,王强,等.神经外科术后静脉输注万古霉素时血清和脑脊液药物浓度变化[J].中华神经外科杂志,2011, 27(1):73-76.
[12] Wilson AP.Clinical pharmacokinetics of teicoplanin[J].Clin Pharmacokinet, 2000, 39(3):167-183.
[13] Rowland M.Clinical pharmacokinetics of teicoplanin[J].Clin Pharmacokinet, 1990,18(3):184-209.
[14] Stahl JP, Croize J, Wolff M,et al. Poor penetration of teicoplanin into cerebrospinal fluid in patients with bacterial meningitis[J].J Antimicrob Chemother,1987,20(1):141-142.
[15] Seki M, Yabuno K, Miyawaki K, et al. Loading regimen required to rapidly achieve therapeutic trough plasma concentration of teicoplanin and evaluation of clinical features[J].Clin Pharmacol, 2012,4: 71-75.
[16] Cruciani M, Navarra A, Di Perri G,et al.Evaluation of intraventricular teicoplanin for the treatment of neurosurgical shunt infection[J].Clin Infect Dis, 1992,15(2):285-289.
[17] 胡述平,薛南平,晏怡.鞘内注射替考拉宁治疗革兰阳性球菌颅内感染[J].重庆医学,2009,38(19):2486-2487.
(本文编辑:左双燕)

·论著·
Teicoplanin concentration in cerebrospinal fluid during intravenous infusion in patients following neurosurgery operation
KANGJian-lei1, WU Yuan-xing2, YU Shu-qing2, WANG Qiang2(1 The Affiliated TumorHospital,ZhengzhouUniversity,Zhengzhou450008,China; 2BeijingTiantanHospital,CapitalMedicalUniversity,Beijing100050,China)
[Abstract]ObjectiveTo understand teicoplanin concentration in cerebrospinal fluid (CSF) during intravenous infusion in patients following neurosurgery operation, and evaluate whether drug concentration can be increased if blood-brain barrier was damaged, and effect of continuous pump of drug on drug concentration in CSF.MethodsThe post-neurosurgical surgery patients with surgical site/ventricular drainage were enrolled in the study, patients were divided into routine administration group(a dose of teicoplanin of 400 mg/12 h was administered for 30 min) and continuous administration group (a dose of 400 mg teicoplanin was administered for 30 min followed by a continuous infusion of 200 mg/6 h). CSF specimens were collected at respective time points of administration, teicoplanin concentration in specimens was measured.ResultsFor routine administration group, drug concentration in CSF was(0.004±0.0123)mg/L immediately after teicoplanin was bumped, the peak concentration was (0.712±1.028)mg/L after 1-hour bumping, then concentration decreased gradually, which were (0.254±0.222),(0.173±0.152), and (0.355±0.207)mg/L at 12,18, and 24 hours of bumping respectively. For continuous administration group, drug concentration in CSF was(0.017±0.020))mg/L immediately after teicoplanin was bumped, the peak concentration reached (0.587±0.255)mg/L after 4-hour bumping, then concentration were (0.429±0.416),(0.325±0.254),(0.476±0.686),and (0.318±0.464)mg/L at 6,12,18, and 24 hours of bumping respectively, teicoplanin concentration was relatively stable 6 hours later, which were (0.318±0.464)mg/L-(0.476±0.686)mg/L. The area under the curve during 24 hours (AUC0-24) in routine administration group and continuous administration group were 5.590 mg/ L·h and 9.082 mg/L·h respectively. For two groups of patients, teicoplanin concentration only at the area near peak value achieved 50% minimum inhibitory concentration(MIC50) for coagulase negative staphylococcus (CNS), but the time for achieving concentration higher than CNS MIC50was far less than 50% of total administration time; teicoplanin concentration in CSF of both groups of patients didn’t achieve MIC50for Staphylococcus aureus.ConclusionAfter continuous infusion of teicoplanin, drug concentration in CSF can be increased compared with routine administration group,but still can’t achieve the effective MIC; the increase of blood drug concentration is benefit to drug concentration in CSF, it is necessary to increase the dose appropriately to achieve clinical effectiveness.
[Key words]teicoplanin; continuous infusion; pharmacokinetics; pharmacodynamics; CSF drug concentration
DOI:10.3969/j.issn.1671-9638.2015.12.003
[通信作者]李强E-mail:liqianggz@126.com
[作者简介]郭健莲(1981-),女(汉族),福建省福安市人,主管技师,主要从事病原微生物感染研究。
[基金项目]南京军区联勤十八分部医药科技青年培养项目(18FBQN2014007)
[收稿日期]2015-05-10
[中图分类号]R969.1
[文献标识码]A
[文章编号]1671-9638(2015)12-0798-05
猜你喜欢
杂志排行
中国感染控制杂志的其它文章
- 医用小型平板电脑现场清洁消毒方法研究
- 重症监护病房耐碳青霉烯类肺炎克雷伯菌同源性分析
- HMGB1抗体对刀豆蛋白A引起小鼠肝损伤的保护作用
- 2014年株洲市食源性致病菌监测Monitoring on foodborne pathogens in Zhuzhou city in 2014
- 鲍曼不动杆菌临床分布及耐药性分析Clinical distribution and antimicrobial resistance of Acinetobacter baumannii
- 应用医院感染实时监控系统降低医院感染漏报率Application of healthcare-associated infection real-time monitoring system in reducing missing report rate of healthcare-associated infection
