梅毒螺旋体脂肽诱导THP-1细胞表达细胞因子的研究
2016-01-23刘子莲褚小玲张海萍
孙 冉,刘子莲,褚小玲,张海萍
梅毒螺旋体脂肽诱导THP-1细胞表达细胞因子的研究
孙 冉,刘子莲,褚小玲,张海萍
[摘要]目的 通过体外建立巨噬细胞模型,研究梅毒螺旋体(TP)相对分子质量15 000、17 000、47 000膜脂蛋白诱导THP-1细胞表达细胞因子的活性,评价其在梅毒感染细胞免疫中的作用,为进一步研究梅毒螺旋体的致病机制和生物学功能提供理论基础。方法 用不同剂量PMA诱导THP-1细胞,分别观察细胞的形态和检测膜表面CD14受体表达情况,确定PMA诱导THP-1细胞转化为巨噬细胞的适宜剂量与时间。在此基础上利用酶联免疫吸附试验(ELISA)检测不同浓度合成脂肽,刺激THP-1细胞分泌细胞因子的含量,并检测CD14抗体预处理THP-1细胞后对细胞因子分泌水平的影响。结果 THP-1细胞在5 ng/ml PMA浓度诱导下48 h分化较为成熟,可以作为体外实验的巨噬细胞模型。TP15、TP17和TP47均可诱导THP-1细胞分泌肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β和IL-8。以1 000 ng/ml TP47诱导分泌水平较高。CD14抗体预处理后细胞对3种脂肽的反应能力均下降,所检测的3种细胞因子(TNF-α、IL-1β、IL-8)分泌量均较对照组减少,其中IL-1β及IL-8的分泌浓度下降较为明显。结论 TP15、TP17和TP47均能诱导TPH-1产生促炎性细胞因子,但是TP15和TP17的刺激能力不如TP47。CD14分子参与了TP15、TP17和TP47活化THP-1细胞产生细胞因子的过程。本研究采用根据TP膜脂蛋白N端合成的脂肽,可能不能完全真实反映TP天然膜脂蛋白的活性,需要进一步研究和证实。
[关键词]梅毒螺旋体;脂肽;THP-1
[中图分类号]R759.1
[文献标识码]A
[文章编号]1674-1293(2015)05-0336-04
DOI:10.11786/sypfbxzz.1674-1293.20150506
基金项目:北京市自然科学基金资助项目(7102079)
作者简介:孙冉,博士研究生,研究方向:性传播疾病的免疫学研究,E-mail: srxj2004@163.com
通讯作者:张海萍,E-mail: zhanghaiping@xwh.ccmu.edu.cn
[Abstract]Objective The study was designated to establish macrophage model and investigate the production of proinflammatory cytokines from macrophages induced by Treponema pallidum lipopeptide. Methods Different doses of PMA were used to induce THP-1 cells for 24 h, 36 h and 48 h, then morphology of the cells and the expression of CD14 receptor were observed, so as to determine the appropriate doses and times of PMA intervention. Subsequently, the concentration of TNF-alpha, secreted by THP-1 cell stimulated with TP15, TP17 and TP47, was detected by ELISA, as well as the concentration of the same indicators after blocking the CD14 receptor. Results THP-1 cells induced by 5 ng/ml PMA for 48 h, can be used as a model of macrophage in vitro experiment. TP15, TP17 and TP47 can induce THP-1 cells to secrete TNF-alpha, IL-1beta and IL-8. The level of CKs secreted by THP-1 cells induced by 1000 ng/ml TP47 is higher. The level of IL-1beta and IL-8 decreased notably after blocking CD14 receptor. Conclusions TP15, TP17 and TP47 can induce macrophage to secret cytokines, compared with TP47, the level of cytokines secreted by macrophages stimulated with TP15 and TP17 was lower, which illustrated that The latter two may not be the major pathogenic component of treponema pallidum in syphilis. Three lipopeptides stimulated macrophages through cell surface CD14 receptor molecules, and then lead to the activation of downstream signaling pathways and the secretion of the cytokines.
收稿日期(2015-05-25 修回日期 2015-06-30)
作者单位:100029 北京,首都医科大学附属北京安贞医院(孙冉,褚小玲);首都医科大学宣武医院(张海萍);北京大学第三医院(刘子莲)
The research of cytokines-induced function of Treponema pallidum lipopeptides activated THP-1
SUN Ran,LIU Zi-lian,CHU Xiao-ling,et al
Department of Dermatology, Beijing Anzhen Hospital, Capital Medical University, Beijing 100029, China
[Key words]Treponema pallidum;Lipopeptide;THP-1
[J Pract Dermatol, 2015, 8(5):336-339]
梅毒是由梅毒螺旋体(Treponema pallidum,TP)感染所引起的一种慢性、全身性性传播疾病,其临床表现复杂多样,可累及全身多个器官和系统,严重危害人类健康[1]。明确TP的致病因子及进行致病机制的研究,是防治本病的关键环节。国内外研究表明,TP抗原的构成相对复杂,主要为膜脂蛋白和鞭毛蛋白。TP膜脂蛋白是促炎激动剂[2,3],能诱导机体产生
较强的免疫应答,可能是TP的主要致病因子,在梅毒的致病、感染和诊断中具有重要的作用[4,5]。Matthew等[6]发现至少有12种膜脂蛋白具有很强的抗原性,其中相对分子质量为15 000、17 000和47 000的膜脂蛋白具有代表性,已广泛用于梅毒螺旋体的特异性诊断[7],并且可以作为主要的免疫原性蛋白。但是,由于TP体外人工培养尚未成功,限制了对TP的深入研究。有报道称与天然螺旋体外膜脂蛋白N端相符合的脂肽在体外能够诱导出与天然脂蛋白相似的促炎症反应[8,9],可以作为研究TP膜脂蛋白的替代物。
1 材料和方法
1.1 试剂与仪器
THP-1细胞(人单核细胞株,购自协和医科大学基础医学研究所细胞中心),相对分子质量15 000、17 000脂蛋白合成脂肽和47 000膜抗原合成脂肽(以下简称TP15、TP17和TP47)(EMC microcollections GmbH),LPS(Sigma),RPMI1640培养基(Hyclone),DMSO(Applichem),PMA(Promega),CD14抗体(Invitrogen),肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β和IL-8 酶联免疫吸附试验(ELISA)试剂盒(武汉博士德),二氧化碳细胞培养箱(Forma scientific,美国),光学显微镜(Olympus,日本),DNM-9602型酶标分析仪(北京普朗新技术有限公司,中国)。
1.2 方法
1.2.1 PMA诱导THP-1细胞转化 用2.5、5、10 ng/ml PMA与THP-1细胞共培养后,分别于24、36、48 h观察细胞状态,并检测细胞表面标志受体CD14表达率,以确定PMA诱导THP-1细胞转化为巨噬细胞的浓度及刺激时间。
1.2.2 3种不同浓度脂肽诱导THP-1分泌TNF-α、IL-1β和IL-8的水平 实验组分别加入10、100、1 000 ng/ml不同浓度梯度的TP15、TP17、TP47和LPS,对照组加入含0.05 μl无菌DMSO的培养液孵育,空白对照组为新鲜RPMI1640培养液,刺激6 h后收集每孔细胞上清液,ELISA法测定细胞因子浓度,每孔设置3个复孔。
1.2.3 检测CD14抗体预处理后对TNF-α、IL-1β和IL-8产生的影响 用10 μg/ml CD14抗体预处理THP-1细胞1 h后,按实验分组分别加入100 ng/ml浓度的TP15、TP17、TP47及LPS,刺激6 h后收集上清液,ELISA法测定细胞因子浓度。对照组只加入RPMI1640,不加CD14抗体,每孔设置3个复孔。
1.3 统计学方法
所有实验均重复3次。本实验数据均以均数±标准差(x¯ ±s)表示,运用SPSS16.0统计软件包完成数据分析,用单因素方差分析(ANOVA)进行统计学处理,P<0.05表示组间差异有统计学意义。
2 结果
2.1 PMA诱导THP-1细胞分化的形态学变化
人单核细胞株THP-1细胞呈类圆形,表面相对光滑,在培养液中悬浮生长,部分细胞呈群聚葡萄串样生长,经PMA诱导后细胞形态逐渐不规则,相互聚集呈群落生长,胞体增大且胞质出现空泡,细胞表面伸出伪足,12 h开始细胞逐渐相互聚集贴壁,24 h后贴壁细胞数明显增加,细胞体积增大,开始呈梭形改变,48 h后胞质出现树枝状突起(图1)。
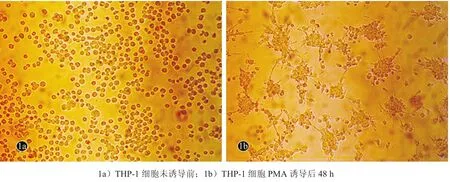
图1 PMA诱导THP-1细胞分化的形态学变化
2.2 流式细胞仪检测THP-1细胞表面CD14的表达
分别收集不同时间点不同浓度PMA诱导后的细胞,流式细胞仪检测细胞表面CD14受体的表达情况,显示5 ng/ml PMA诱导48 h时THP-1细胞表面CD14表达率较高,可以作为体外实验的巨噬细胞模型。
2.3 合成脂肽诱导THP-1细胞分泌TNF-α的水平
TP15与TP17各浓度组间诱导THP-1细胞分泌TNF-α的能力相近(P>0.05);TP47刺激其分泌TNF-α的能力随着脂肽浓度升高而升高,各浓度组间比较差异有统计学意义(P<0.01),而在浓度为1 000 ng/ml时达到398.08 pg/ml,与对照组1 000 ng/ml LPS 的分泌水平接近(图2)。
2.4 合成脂肽诱导THP-1细胞分泌IL-1β的水平
TP15诱导THP-1细胞分泌IL-1β的浓度在1 000 ng/ml时较其他各组低(P<0.05);TP17和TP47均在1 000 ng/ml时分泌水平达到高峰;TP15和TP17各浓度组IL-1β分泌量均较同浓度组LPS低,TP47 在1 000 ng/ml浓度时分泌量较同浓度组LPS高(图3)。
2.5 合成脂肽诱导THP-1细胞分泌IL-8水平
TP脂肽诱导THP-1细胞分泌IL-8的浓度均较低,其中TP17和TP47的 10 ng/ml与100 ng/ml两浓度组的分泌水平相近(P>0.05),而1 000 ng/ml刺激其分泌IL-8的水平达到高峰,且与同浓度组LPS分泌
量相近(图4)。
2.6 CD14分子参与3种脂肽诱导THP-1细胞分泌TNF-α、IL-1β及IL-8水平
通过阻断CD14受体之后,检测THP-1细胞对3种合成脂肽的反应能力,结果显示CD14受体被阻断后细胞对脂肽的反应能力均下降,所检测的3种细胞因子(TNF-α、IL-1β、IL-8)分泌量均较对照组减少,其中TNF-α两组间无明显差异(P>0.05),而IL-1β及IL-8的分泌浓度在CD14被阻断后下降较为明显(P<0.05)(图5-7)。

图2 TP脂肽诱导THP-1细胞分泌TNF-α的浓度(pg/ml)
注:*与对照组比较,P<0.05;#与10 ng/ml组比较,P<0.05;※与100 ng/ml组比较,P<0.05(ng/ml)
此次尿常规检测结果显示,93例患者使用干化学法,定量白细胞检出率为11.83%,使用沉渣镜检法定量白细胞检出率为26.88%,干化学法联合尿沉渣镜检法定量白细胞检出率为39.78%,多项数据相较于联合组都比较低,差异有统计学意义(P<0.05)。
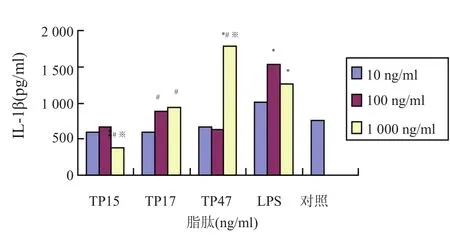
图3 TP脂肽诱导THP-1细胞分泌IL-1β的浓度(pg/ml)

图4 TP脂肽诱导THP-1细胞分泌IL-8的浓度(pg/ml)
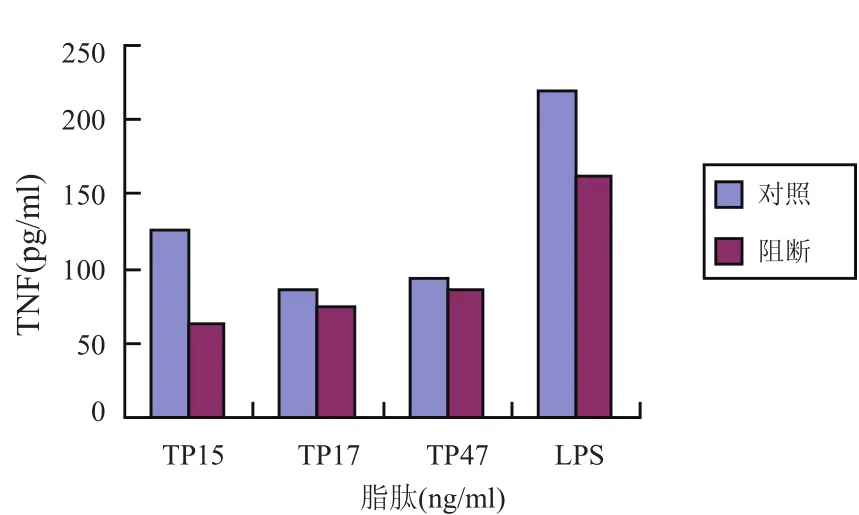
图5 THP-1细胞CD14受体阻断后分泌TNF-α的浓度
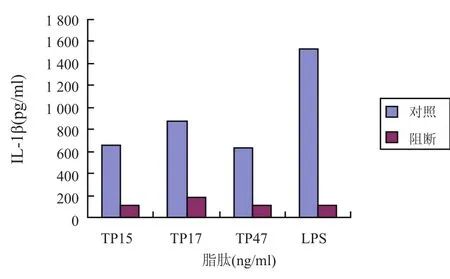
图6 THP-1细胞CD14受体阻断后分泌IL-1β的浓度

图7 THP-1细胞CD14受体阻断后分泌IL-8的浓度
3 讨论
目前普遍认为细胞免疫在TP感染后的致病中发挥重要作用[10],TP侵入皮肤黏膜后,与致病相关的蛋白成分激活局部组织的单核/巨噬细胞,诱导合成一系列炎症递质,引起宿主组织损害和细胞浸润[11]。为了阐明TP15、TP17和TP47是否具有促炎症活性及三者之间促炎症活性的差别,本研究采用THP-1细胞转化后的巨噬细胞为研究对象,主要由于其对各种刺激因素的敏感性更强,更能真实反映出对人的致病性;其次巨噬细胞在固有免疫和适应性免疫反应中起着关键性的作用,是炎性反应中主要的调节细胞。当宿主发生病原体感染后,巨噬细胞在有效清除病原体方面起了重要的作用[12]。同时为了研究可能的信号传导通路,选择了膜蛋白细胞传导有关的重要分子CD14为研究对象,用CD14抗体阻断相应的信号通路,观察其对细胞因子分泌的影响。
TNF-α、IL-1β和IL-8是重要的细胞因子(CKs)[13-15],是启动炎症反应的关键。本实验结果显示,TP15、TP17刺激THP-1细胞分泌TNF-α的能力与脂肽浓度无相关性,而TP47的刺激能力呈剂量依赖性。以1 000 ng/ml TP47刺激能力最强,表明TP感染时主要由TP47刺激巨噬细胞产生TNF-α,TP15和TP17也有一定作用,但可能不是主要的刺激因素。TP17刺激THP-1细胞分泌IL-1β的能力呈剂量依赖性,TP47的刺激能力以1 000 ng/ml浓度时刺激能力最强,
且高于同浓度梯度的LPS对此种细胞的刺激能力,也说明TP47刺激巨噬细胞分泌细胞因子的能力较其他两种脂肽强。而TP15刺激THP-1细胞分泌IL-1β 于1 000 ng/ml时反而下降,可能由于高浓度TP15会干扰THP-1细胞的生物学功能。Sellati等[16]用脂肽刺激转化后的THP-1细胞,TP47浓度为1 000 ng/ml时细胞分泌IL-8水平达到8 000 pg/ml,而本次研究结果显示,3种脂肽在不同浓度梯度时IL-8的分泌量均较低,不超过80 pg/ml,造成这种差异的原因还有待进一步研究。
这些细胞因子的生物学功能具有多效性。一方面能促进机体固有免疫系统清除病原体,另一方面影响机体炎症反应的发生发展,从而可能直接或间接引起组织损伤[17]。由于细胞因子对机体具有双重效应,其对机体炎症反应的调控无疑取决于所有免疫细胞之间的相互作用。然而本研究仅限于对单核巨噬细胞系的探讨,因此不能完全反应机体感染TP后免疫系统的实际情况,但是对于后续的研究具有一定的指导意义。
在 TP脂蛋白诱导炎症反应的信号传导过程中TLR2 发挥着关键的作用。TLR2 表达主要是在单核/巨噬细胞、中性粒细胞和树突状细胞表面。TP侵入皮肤黏膜后其脂蛋白首先被巨噬细胞膜上 TLR2 识别,并在膜上CD14 分子的协同作用下,形成 TLR2-CD14受体复合物,将识别的信号从胞外转入胞内[18,19]。为探讨CD14 在 TP 感染炎症信号传导中的作用, 本研究将CD14抗体预处理THP-1细胞后,发现其能抑制TNF-α、IL-1β和IL-8的产生,而抑制IL-1β和IL-8分泌的作用更明显,从而可初步认为这3种脂肽刺激THP-1细胞发挥前炎症活性的信号传导需要CD14 的参与。
综上所述,本研究初步证实TP15、TP17和TP47能够诱导THP-1细胞产生细胞因子,这些细胞因子是引起梅毒免疫病理损伤的基础,但是TP15和TP17对THP-1细胞的刺激能力不如TP47,初步认为两者可能不是梅毒感染时引起固有免疫反应的主要致病因子;同时研究发现,这3种脂肽是通过激活巨噬细胞膜表面CD14受体分子,活化下游信号通路,从而诱导细胞因子产生。另外,本研究采用根据TP膜脂蛋白N端合成的脂肽,不一定能完全真实反映TP天然膜脂蛋白的活性,因此需要进一步研究和证实。
【参 考 文 献】
[1]傅志宜. 梅毒的流行、检测与治疗现状(一) [J]. 实用皮肤病学杂志, 2009, 2(12):193-195.
[2]Ulevitch RJ, Tobias PS. Recognition of gram-negative bacteria and endotoxin by the innate immune system [J]. Curr Opin Immunol, 1999, 11(1):19-22.
[3]Brandt ME, Riley BS, Radolf JD, et al. Immunogenic integral membrane proteins of Borrelia burgdorferi are lipoproteins [J]. Infect Immun, 1990, 58(4):983-991.
[4]Kim LA, Khurana RN, Parikh JG, et al. Melanin-laden macrophages in the CSF to diagnose Vogt-Koyanagi-Harada simulating ocular syphilis [J]. Ocul Immunol Inflamm, 2008, 16(1):59-61.
[5]Fitzgerald TJ. Th1/Th2-like switch in syphilitic infection: is it detrimental [J]. Infect Immun, 1992, 60(9):3475-3479.
[6]McKevitt M, Patel K, Smajs D, et al. Systematic cloning of Treponema pallidum open reading frames for protein expression and antigen discovery [J]. Genome Res, 2003, 13(7):1665-1674.
[7]Castro R, Prieto ES, Santo I, et al. Evaluation of an enzyme immunoassay technique for detection of antibodies against Treponema pallidum [J]. J Clin Microbiol, 2003, 41(1):250-253.
[8]DeOgny L, Pramanik BC, Arndt LL, et al. Solid-phase synthesis of biologically active lipopeptides as analogs for spirochetal lipoproteins [J]. Pept Res, 1994, 7(2):91-97.
[9]Hauschildt S, Hoffmann P, Beuscher HU, et al. Activation of bone marrow-derived mouse macrophages by bacterial lipopeptide: cytokine production, phagocytosis and Ia expression [J]. Eur J Immunol, 1990, 20(1):63-68.
[10]Lafond RE, Lukehart SA. Biological basis for syphilis [J]. Clin Microbiol Rev, 2006, 19(1):29-49.
[11]Peeling RW, Hook EW. The pathogenesis of syphilis: the Great Mimicker revisited [J]. J Pathol, 2006, 208(2):224-232.
[12]Gordon S, Taylor PR. Monocyte and macrophage heterogeneity [J]. Nat Rev Immunol, 2005, 12(5):953-964.
[13]Crouse DT, English BK, Livingston L, et al. Genital mycoplasmas stimulate tumor necrosis factor-α and inducible nitric oxide synthase production from a murine macrophage cell line [J]. Pediatr Res, 1998, 44(5):785-790.
[14]Perni SC, Vardhana S, Korneeva I, et al. Mycoplasma hominis and Ureaplasma urealyticum in midtrimester amniotic fluid: association with amniotic fluid cytokine levels and pregnancy outcome [J]. Am J Obstet Gynecol, 2004, 191(4):1382-1386.
[15]Tominaga K, Higuchi K, Tsuno M, et al. Induction of signal transduction pathways in rat gastric epithelial cells stimulated with interleukin-1β [J]. Aliment Pharmacol Ther, 2000, 14(Suppl 1):101-108.
[16]Sellati TJ, Bouis DA, Kitchens RL, et al. Treponema pallidum and Borrelia burgdorferi lipoproteins and synthetic lipopeptides activate monocytic cells via a CD14-dependent pathway distinct from that used by lipopolysaccharide [J]. J Immunol, 1998, 160(11):5455-5464.
[17]刘双全, 赵飞骏, 张秋桂, 等. 梅毒螺旋体Tp0751黏附蛋白的表达、纯化及免疫活性研究 [J]. 中华微生物学和免疫学杂志, 2009, 29(7):612-615.
[18]Radolf JD, Arndt LL, Akins DR, et al. Treponema pallidum and Borrelia Burgdorferi lipoproteins and synthetic lipopeptides activate monocytes/macrophages [J]. J Immunol, 1995, 154(6):2866-2877.
[19]Bouis DA, Popova TG, Takashima A, et al. Dendritic cells phagocytose and are activated by treponema pallidum [J]. Infect Immun, 2001, 69(1):518-528.
(本文编辑 耿建丽)
