分离胶促凝管联合MALDI-TOF MS直接检测血培养阳性细菌
2016-01-20李媛睿皇甫昱婵陶晓勤
陈 峰, 李媛睿, 皇甫昱婵, 陶晓勤, 刘 瑛
(上海交通大学医学院附属新华医院检验科,上海 200092)
摘要:目的 建立用分离胶促凝管联合基质辅助激光解析电离飞行时间质谱(MALDI-TOF MS)直接检测血培养阳性待测菌的方法并评估其鉴定符合率。方法 共收集阳性血培养491例,利用分离胶促凝管直接从血培养瓶中富集并提纯菌体,采用MALDI-TOF MS对待测菌进行菌种鉴定,同时对报阳性血培养瓶进行转种培养,纯菌落用Vitek 2 Compact全自动微生物分析系统(简称Vitek 2 Compact)进行鉴定。若两者鉴定结果不一致,则以基因测序结果予以确证。结果 491例阳性血培养瓶鉴定出的待测菌包括30个属和64个种。在462例单菌株感染血培养瓶中,菌株的种、属鉴定符合率分别为73.6%和3.7%。其中175例革兰阴性菌的种、属鉴定率分别为84.0%(147例)和2.9%(5例);251例革兰阳性菌的种、 属鉴定率分别为75.3%(189例)和4.4%(11例);36例念珠菌的种、属鉴定率分别为19.4%(7例)和2.8%(1例)。在29例复数菌感染血瓶中,鉴定出其中一种细菌的种、属鉴定率分别为79.3%(23例)和10.3%(3例)。血流感染中常见病原菌的菌种鉴定符合率达83.3%~96.9%。结论 本研究建立了分离胶促凝管联合MALDI-TOF MS直接检测血培养阳性待测菌的方法,与传统的培养鉴定方法相比,对血流感染中主要病原菌的鉴定符合率较高,且方法快速、简便,成本低廉,适合在临床微生物实验室中推广应用。
关键词:分离胶促凝管;基质辅助激光解析电离飞行时间质谱;血培养
中图分类号:
分离胶促凝管联合MALDI-TOF MS直接检测血培养阳性细菌
陈峰,李媛睿,皇甫昱婵,陶晓勤,刘瑛
(上海交通大学医学院附属新华医院检验科,上海 200092)

摘要:目的建立用分离胶促凝管联合基质辅助激光解析电离飞行时间质谱(MALDI-TOF MS)直接检测血培养阳性待测菌的方法并评估其鉴定符合率。方法共收集阳性血培养491例,利用分离胶促凝管直接从血培养瓶中富集并提纯菌体,采用MALDI-TOF MS对待测菌进行菌种鉴定,同时对报阳性血培养瓶进行转种培养,纯菌落用Vitek 2 Compact全自动微生物分析系统(简称Vitek 2 Compact)进行鉴定。若两者鉴定结果不一致,则以基因测序结果予以确证。结果491例阳性血培养瓶鉴定出的待测菌包括30个属和64个种。在462例单菌株感染血培养瓶中,菌株的种、属鉴定符合率分别为73.6%和3.7%。其中175例革兰阴性菌的种、属鉴定率分别为84.0%(147例)和2.9%(5例);251例革兰阳性菌的种、 属鉴定率分别为75.3%(189例)和4.4%(11例);36例念珠菌的种、属鉴定率分别为19.4%(7例)和2.8%(1例)。在29例复数菌感染血瓶中,鉴定出其中一种细菌的种、属鉴定率分别为79.3%(23例)和10.3%(3例)。血流感染中常见病原菌的菌种鉴定符合率达83.3%~96.9%。结论本研究建立了分离胶促凝管联合MALDI-TOF MS直接检测血培养阳性待测菌的方法,与传统的培养鉴定方法相比,对血流感染中主要病原菌的鉴定符合率较高,且方法快速、简便,成本低廉,适合在临床微生物实验室中推广应用。
关键词:分离胶促凝管;基质辅助激光解析电离飞行时间质谱;血培养
中图分类号:
文章编号:1673-8640(2015)02-0113-09R446.5
文献标志码:码:A
DOI:10.3969/j.issn.1673-8640.2015.02.004
作者简介:陈峰,男,1981年生,学士,技师,主要从事微生物检验工作。
通讯作者:刘瑛,联系电话:021-25077102。
Abstract:ObjectiveTo evaluate the direct identification of microorganisms from blood culture by a separation gel tube-based matrix-assisted laser desorption/ionization-time of flight mass spectrometry (MALDI-TOF MS) and its identification rate. MethodsA total of 491 cases with positive blood culture were collected. The bacteria were enriched and purified directly from blood culture bottle by separation gel tube, and then the bacteria were identified by MALDI-TOF MS. Traditional culture and identification processes were performed simultaneously, and the cultured pure colonies were identified by Vitek 2 Compact automated microbial analysis system (Vitek 2 Compact). The identification of bacterial isolates by MALDI-TOF MS was compared with that of traditional biochemical testing, and discrepancies were resolved by gene sequencing. ResultsA total of 491 positive cultures were determined, representing 30 genera and 64 species or groups. The method demonstrated 73.6% and 3.7% concordance to species and genus identification rates in monomicrobial culture (462 cases). The correct species and genus identification rates were 84.0%(147 cases) and 2.9%(5 cases) in Gram-negative bacteria(175 cases), were 75.3%(189 cases) and 4.4%(11 cases) in Gram-positive bacteria(251 cases), and were 19.4%(7 cases) and 2.8% (1 case) in Candida species(36 cases). In 29 cases of complex bacterial infection, the correct species and genus identifications rates in one of the multiple bacteria were 79.3% (23 cases) and 10.3% (3 cases). Species identification rates of bloodstream infection with common pathogens were 83.3%-96.9%. ConclusionsThis separation gel tube-based MALDI-TOF MS for the direct identification of blood culture pathogens is established. The identification rate of common pathogens in bloodstream infection by MALDI-TOF MS is higher compared with that by traditional culture identification processes. In addition, it is rapid, easy and cost-effective, and it is a recommendable method for clinical microbiology laboratories.
收稿日期:(2014-10-15)
Direct identification of microorganisms from blood culture by MALDI-TOF MS combined with separation gel tubeCHENFeng,LIYuanrui,HUANGFUYuchan,TAOXiaoqin,LIUYing(DepartmentofClinicalLaboratory,XinhuaHospital,ShanghaiJiaotongUniversitySchoolofMedicine,Shanghai200092,China)
Key words: Separation gel tube;Matrix-assisted laser desorption/ionization-time of flight mass spectrometry;Blood culture
随着广谱抗菌药物的广泛应用、多种侵入性诊疗手段的普遍应用以及各种原因导致的免疫功能低下患者的日益增加,血流感染的患病率呈逐年上升的趋势。美国的统计数据显示,血流感染连续多年位于疾病死亡率排名前10位[1]。国内报道院内血流感染的总死亡率平均为30%~40%[2]。相对传统培养鉴定流程,基质辅助激光解析电离飞行时间质谱(matrix-assisted laser desorption/ionization-time of flight mass spectrometry, MALDI-TOF MS)因能直接、快速检测血培养中病原菌从而启动至关重要的病原菌针对性治疗而颇具优势,目前已成为国内外研究的一大热点[3-4]。本研究利用分离胶促凝管直接从阳性的血培养液中富集并分离病原体,采用MALDI-TOF MS直接对病原菌蛋白谱图进行鉴定分析,同时进行传统报阳血培养瓶的培养流程,培养出的纯菌落用Vitek 2 Compact全自动微生物分析系统(简称Vitek 2 Compact)进行鉴定,若两者鉴定结果不一致,则用基因测序结果予以确证。
材料和方法
一、材料
1.血培养样本来源收集2014年3至8月上海交通大学医学院附属新华医院微生物实验室血培养阳性样本共491例,其中单菌株感染血培养462例,复数菌感染血培养29例,来自同一患者不同部位的需养和厌氧培养瓶也同时纳入本研究中。
2.试剂与仪器甲酸、乙腈和三氟乙酸购自美国Sigma-Aldrich公司; BACTECTMFX 血培养系统及其配套的BACTECTM血培养树脂需氧瓶和含溶血素厌氧瓶购自美国BD公司;分离胶促凝管(真空采血管)INSEPACK○R(ST740CG型)购自日本积水医疗科技(中国)有限公司;IVD 细菌测试标准品、基质、96孔金属靶板(Part No.:280800)和Biotyper 3.0鉴定分析软件MicroflexTMMALDI-TOF MS仪购自德国 Bruker Daltonik公司;Vitek 2 Compact及其配套的鉴定卡购自法国BioMérieux公司;聚合酶链反应(polymerase chain reaction,PCR)引物和DNA回收试剂盒购自生工生物工程(上海)公司;PCR仪和加样枪购自德国Eppendorf公司;BigDye Terminator v3.1 测序试剂盒和ABI 310型全自动DNA测序仪购自美国Applied Biosystems公司。血琼脂平板购自上海伊华医学科技有限公司。
二、方法
1.菌种鉴定一旦血培养仪显示血培养阳性报警,立即取出阳性血瓶,直接染色镜检后,同时进行分离胶促凝管联合MALDI-TOF MS和传统报阳血培养瓶的培养鉴定流程,若二者结果不符,则以基因测序为准。(1)涂片染色镜检:将阳性报警的血培养瓶从培养仪中取出,从中取血样涂片后革兰染色镜检,初步确定血培养瓶中存在待测菌的种类及革兰染色分类,并排除假阳性干扰,记录镜检结果;(2)分离胶促凝管样本预处理:将上述血培养瓶混匀后,用2 mL无菌注射器抽取2 mL血培养瓶内容物转移至INSEPACK○RST740CG型真空采血管内,室温下1 209×g离心10 min。由于此型真空采血管含分离胶和促凝剂,在上述离心条件下,大部分的血细胞和有形杂质被离心至分离胶的下层,弃去上清液后在分离胶边缘可发现灰白色沉淀,经涂片染色镜检确认为菌体富集物及少量细胞碎片;(3)MALDI-TOF MS鉴定:以无菌竹签挑取上述菌体富集物,至含300 μL去离子水的离心管,加入900 μL乙醇,混匀后20 817×g离心2 min,取沉淀以70%的甲酸水溶液50 μL裂解细菌菌体,并加入乙腈50 μL用以萃取蛋白,再次以20 817×g离心2 min,得到上清液待用。点样上清液1 μL至96孔金属靶板,室温干燥;表面加入α-氰基-4-羟基肉桂酸1 μL,室温干燥;进样至MALDI-TOF MS 系统中分析。IVD 细菌测试标准品作为每一块金属靶板上样本的质谱分析前仪器参数校正而使用。参数设置:线性,正离子,蛋白峰谱m/z范围2 000~20 000,激光解析每孔至少240次。应用Biotyper 3.0鉴定分析软件显示前10位鉴定结果。单菌株血流感染记录排名第1位的鉴定结果和质谱评分。复数菌血流感染:镜检发现存在革兰阴性菌混合革兰阳性菌感染时,分别在革兰阴性菌和革兰阳性菌库中分析质谱图,记录排名首位的鉴定结果和质谱评分;镜检存在同属的复数菌时,在相应的革兰阴性菌或革兰阳性菌库中分析,记录首位和第2位的鉴定结果和质谱评分;(4)传统培养鉴定:血培养瓶报警后转种于血琼脂平板,需氧或厌氧环境中孵育18~24 h后,挑取纯菌落,选择合适的鉴定板条上Vitek 2 Compact进行鉴定,记录鉴定可信度为高的结果。
2.基因测序采用水煮法提取菌株基因组DNA。引物序列为细菌16S核糖体通用引物序列16S rDNA( F:5′-AGAGTTTGATCC-TGGCTCAG-3′;R:5′-ACGGCTACCTTGTTACG-ACT-3′)[5]和真菌通用引物序列ITS1(5′-TCC-GTAGGTGAAC-CTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATG-3′)[6],PCR体系配置按试剂盒说明书进行,DNA回收试剂盒回收琼脂糖凝胶中相应的目的条带(1 500和450~750 bp),使用ABI 310型全自动DNA测序仪和BigDye Terminator v3.1 测序试剂盒对目的基因进行测序,测序结果与NCBI基因库比对,选择测序符合率> 99%为鉴定结果。
三、统计学方法
采用IBM SPSS Statistics 20.0软件进行数据整理统计分析,不同截断点对血流感染鉴定的敏感性、特异性、阳性预测值、阴性预测值等评价指标采用四格表进行计算。
结果
一、确定质谱评分标准的截断点
有文献研究表明,对于MALDI-TOF MS直接鉴定血培养阳性样本中的待测菌评分标准不同于纯菌落,不同的预处理程序都有其最适合的鉴定评分置信区间,部分甚至降低Cut-off值至1.4或1.6分,仍然能够达到较高的种属鉴定符合率[7]。
回顾研究本实验的数据,采用四格表计算不同截断点对血流感染鉴定的评价指标:截断点为1.35时,“属”水平的Youden指数最优化为0.911 7,敏感性为92.53%,特异性为98.65%,阳性预测值为99.72%,阴性预测值为71.57%;截断点为1.4时,“种”水平的Youden指数最优化为0.755 7,敏感性为91.41%,特异性为81.46%,阳性预测值为75.38%,阴性预测值为73.28%;调整后标准:质谱评分≥1.4表示鉴定到“种”水平,质谱评分介于1.35~1.45之间则表示鉴定到“属”水平,质谱评分<1.35表示鉴定结果不可靠(未鉴定出)。因此,本研究的血培养鉴定结果质谱评分标准的截断点定为:质谱评分≥1.4表示鉴定到“种”水平,介于1.35~1.45之间则表示鉴定到“属”水平。
二、分离胶促凝管联合MALDI-TOF MS鉴定结果
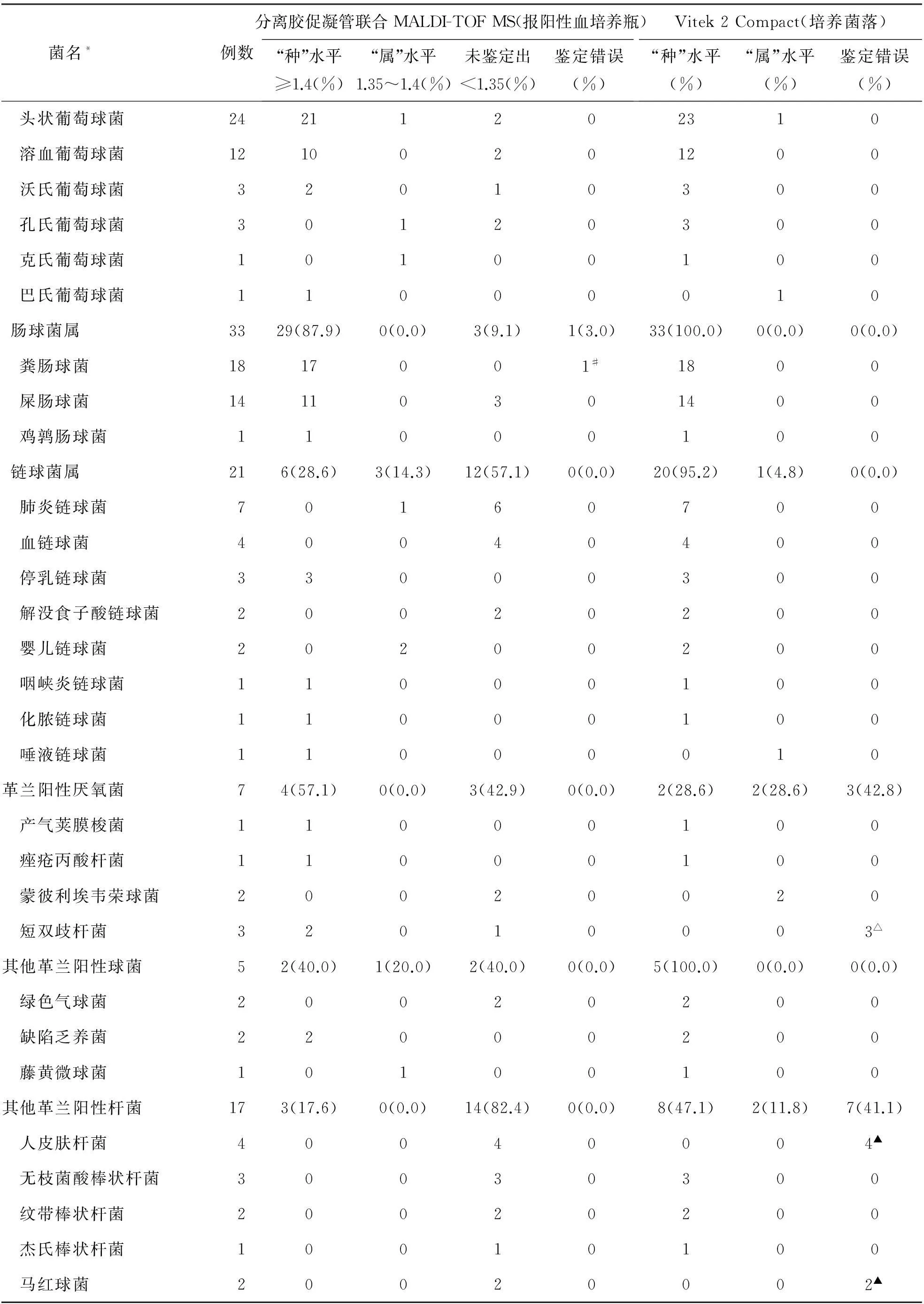
1.单菌株血流感染462例,待测菌种、属水平的鉴定率分别为73.6%(340/462)和3.7%(17/462)。革兰阴性菌175例, 种、属水平的鉴定率分别为84.0%(147/175)和2.9%(5/175)。其中肠杆菌科细菌的种、属水平的鉴定率分别为94.8%(110/116)和0.9%(1/116);非发酵菌为65.9%(29/44)和9.1%(4/44);革兰阴性厌氧菌为50.0%(6/12)和0.0%(0/12);革兰阴性苛养菌为66.7%(2/3)和0.0%(0/3)。革兰阳性菌251例,种、属水平的鉴定率分别为75.3%(189/251)和4.4%(11/251),其中葡萄球菌属细菌的种、属水平的鉴定率分为85.7%(144/168)和4.2%(7/168);链球菌属细菌为28.6%(6/21)和14.3%(3/21);肠球菌属细菌为87.9%(29/33)和0.0%(0/33);革兰阳性厌氧菌为57.1%(4/7)和0.0%(0/7);其它革兰阳性球菌为40.0%(2/5)和20.0%(1/5);其它革兰阳性杆菌为17.6%(3/17)和0.0%(0/17)。念珠菌36例,种、属水平的鉴定率分别为19.4%(7/36)和2.8%(1/36)。462例单菌株血流感染样本中,分离率较高的细菌依次为凝固酶阴性葡萄球菌(27.3%)、金黄色葡萄球菌(9.1%)、大肠埃希菌(13.9%)、肺炎克雷伯菌(6.7%)、粪肠球菌(3.9%)、鲍曼不动杆菌(1.9%)和铜绿假单胞菌(1.7%),见表1。
2.复数菌感染29例,革兰阴性杆菌和革兰阳性球菌混合感染7例(1例琼氏不动杆菌和金黄色葡萄球菌混合感染)均被鉴定到种,鉴定出复数菌其中之一至“种”水平4例、“属”水平2例,复数菌均未鉴定出1例。2种革兰阴性杆菌混合感染10例,鉴定出复数菌其中之一至“种”水平9例、“属”水平1例。2种革兰阳性球菌混合感染12例,鉴定出复数菌其中之一至“种”水平10例、2种菌均未鉴定出2例,见表2。
三、传统培养鉴定结果
1.革兰阴性杆菌成团泛菌(2例)、Acinetobacterbereziniae(7例)、生痰二氧化碳嗜纤维菌(1例)、Prevotellaamnii(3例)和脆弱拟杆菌(1例)仅鉴定到“属”水平;荧光假单胞菌(1例)错误鉴定为鲍曼不动杆菌,其余均鉴定到种。
2.革兰阳性菌头状葡萄球菌(1例)、巴氏葡萄球菌(1例)、唾液链球菌(1例)、Bacillusflexus(1例)、Bacillushorneckiae(1例)和蒙彼利埃韦荣球菌(2例)只鉴定到“属”水平;短双歧杆菌(3例)错误鉴定为内氏放线菌;人皮肤杆菌(4例)、马红球菌(2例)和乳微杆菌(1例)因未选择合适的棒状杆菌鉴定卡而造成鉴定错误,其余均鉴定到种。

表1 单菌株血流感染鉴定结果
续表1

续表1
注:*分离胶促凝管联合MALDI-TOF MS与Vitek 2 Compact两者不一致的鉴定结果,以基因测序的结果予以确证;#将1例粪肠球菌错误鉴的定为脆弱拟杆菌;△将3例短双歧杆菌错误鉴定为内氏放线菌;▲因未选择合适的棒状杆菌鉴定卡而造成鉴定错误
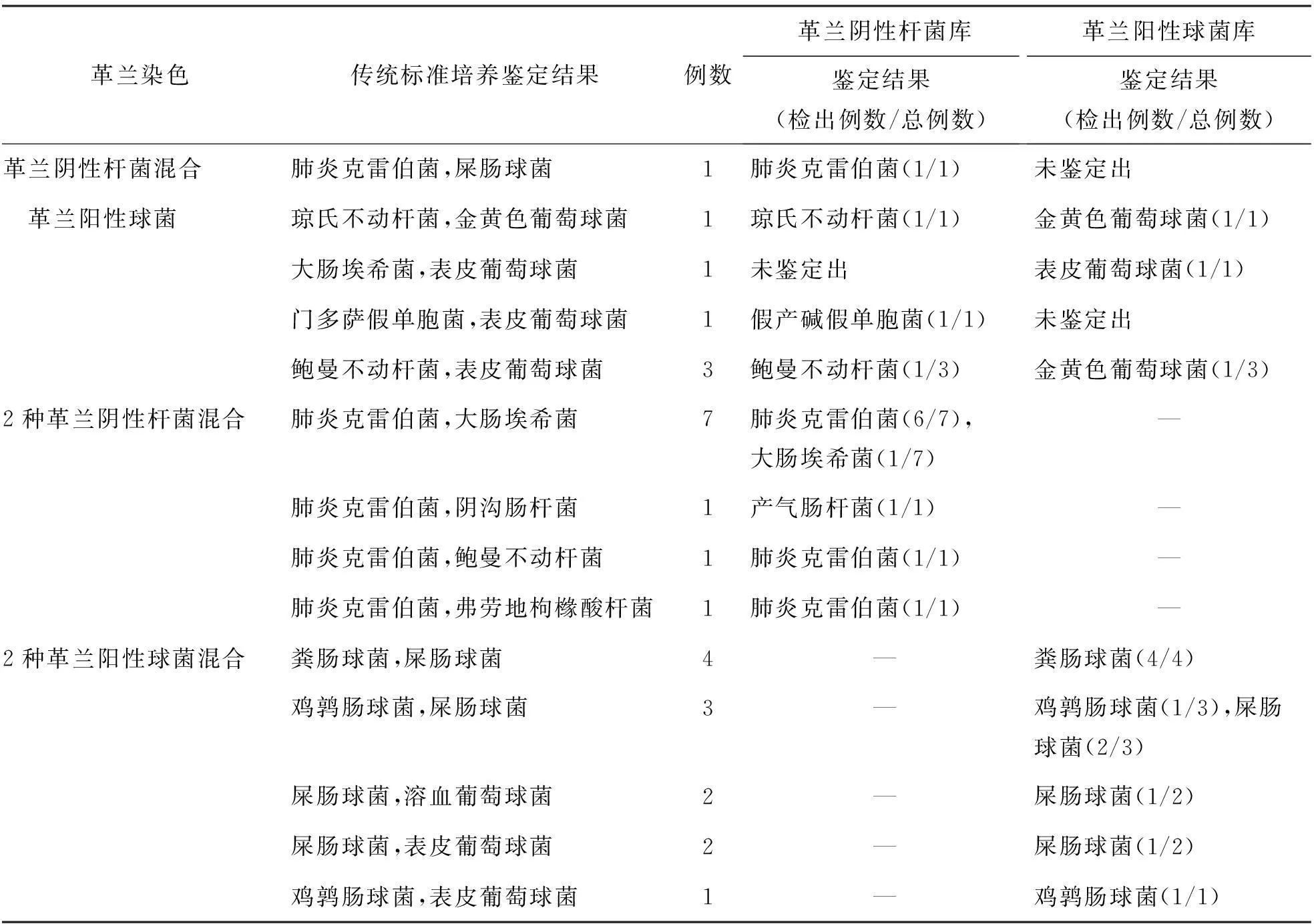
表2 分离胶促凝管联合MALDI-TOF MS鉴定29例复数菌株血流感染结果
四、分离胶促凝管联合MALDI-TOF MS和传统Vitek 2 Compact鉴定结果对比
分离胶促凝管联合MALDI-TOF MS和Vitek 2 Compact对于462例单菌株血流感染的鉴定结果对比,见表3。革兰阴性菌检出率分别为86.9%、100.0%,鉴定错误率为0.0%、0.6%。革兰阳性菌检出率分别为80.1%、100.0%,鉴定错误率为0.4%、4.0%。念珠菌检出率分别为22.2%、100.0%,鉴定错误率为0.0%、0.0%。合计检出率分别为77.5%、100.0%,鉴定错误率为0.2%、2.8%。
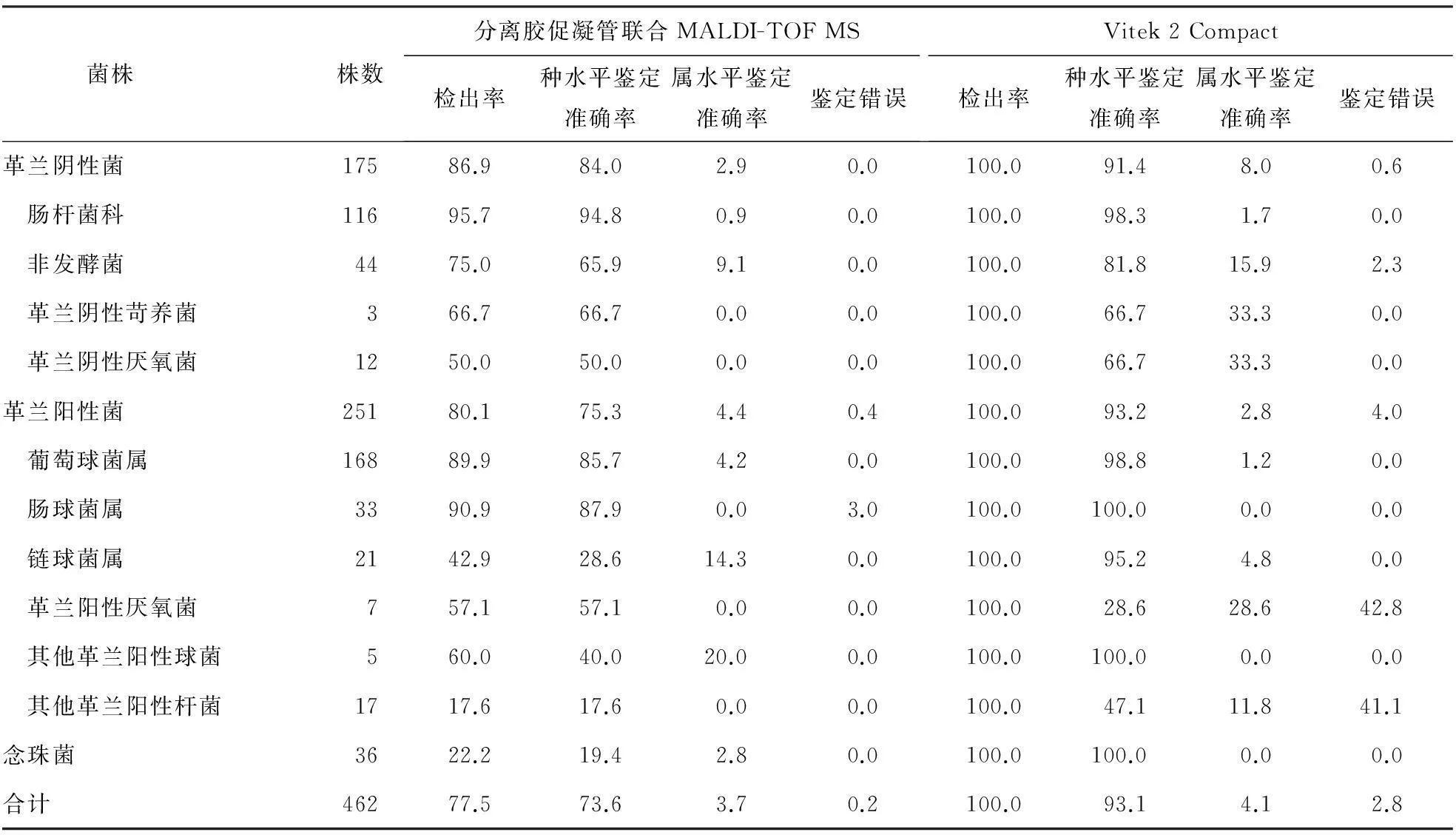
表3 分离胶促凝管联合MALDI-TOF MS和Vitek 2 Compact鉴定结果对比 (%)
讨论
血流感染作为一种严重的感染性疾病,病死率高,其高病死率使得临床对血流感染病原菌快速鉴定的需求日益迫切。因此,将MALDI-TOF MS直接用于阳性血培养瓶中病原体的鉴定已越来越受重视。
由于血培养瓶中有细菌、人体的血细胞、肉汤营养成分乃至树脂等干扰因素,多项研究均对报阳血培养瓶内的培养液进入质谱分析前的预处理流程进行了探索,从而为后续质谱鉴定提供高纯度和高含量的菌体蛋白。如厂商推荐的Sepsityper配套试剂盒[8],通过清除肉汤中的红细胞,沉淀菌体蛋白质并提取及溶解等步骤进行前处理,但成本过高。另一种方法是将阳性血培养进行短时间(1~4 h)的固相培养,成本支出较低,但鉴定时长相对延后[9]。其它还有一些如细胞溶解过滤方法[10]、实验室内部方法优化[11]以及与本研究类似的分离胶采血管处理方法等,但操作都较为繁琐。本研究采用的分离胶促凝管预处理方法,与以上几种预处理方法相比,存在以下优点和缺点。优点:(1)成本低廉、实用性强。真空采血管作为耗材在各医疗机构使用广泛,设备要求低,仅需低速室温离心机;(2)速度快。平均15 min/样本(Sepsityper kit法40 min/样本[7]),成批处理样本时不额外增加工作时间;(3)安全性好。没有过多的转移、洗涤等工序,不容易引起气溶胶等生物安全风险。缺点是纯度不佳。在整个预处理的过程中,虽然2 mL注射器的针头内径较小,成功阻止了瓶内树脂球被抽吸出来,离心后大部分的血细胞和有形杂质也被离心至分离胶的下层,但最终得到的菌体富集物始终还是含有部分细胞碎片。由于没有额外的洗涤步骤,因此,菌体的纯度方面可能稍逊色于其他方法。这也是导致本方法对部分菌种的鉴定率略低于Sepsityper kit法[8]的原因之一。在本研究中,念珠菌鉴定率偏低,分析原因可能是预处理流程中未使用0.1%十二烷基硫酸钠进行洗涤[12]而导致的。
我国主要城市三级甲等医院血流感染病原菌最常见细菌依次为大肠埃希菌(23.0%)、凝固酶阴性葡萄球菌(12.3%)、金黄色葡萄球菌(11.4%)、肺炎克雷伯菌(11.3%)、肠球菌属(10.2%)、铜绿假单胞菌(7.2%)及鲍曼不动杆菌(6.5%)[13]。而本研究所统计462例单菌株血流感染样本中,分离率较高的细菌依次为凝固酶阴性葡萄球菌(27.3%)、金黄色葡萄球菌(9.1%)、大肠埃希菌(13.9%)、肺炎克雷伯菌(6.7%)、粪肠球菌(3.9%)、鲍曼不动杆菌(1.9%)和铜绿假单胞菌(1.7%),结果与全国同类医院相符。因此,上述细菌构成了血流感染的主要病原菌种类。分离胶促凝管联合MALDI-TOF MS与传统常规的转种培养方法相比,鉴定错误率和检出率相对较低,所以在实际工作中并不能彻底排除常规的转种培养方法,而应将2种方法互相配合,取长补短。即要发挥前者检测快速、准确的特点,又要保留传统方法高检出率的优势。尽管分离胶促凝管联合MALDI-TOF MS对念珠菌的检出率很低,仅为22.2%,需要对方法进行再改进,但其对革兰阴性菌和革兰阳性菌的检出率分别为80.1%和86.9%,鉴定错误率分别仅为0.0%和0.4%,而对上述血流感染的主要病原菌的 “种”水平鉴定率可达83.3%~96.9%。有文献研究表明,有效的抗菌药物治疗每延迟1 h,感染性休克患者出现低血压后的存活率平均下降7.6%[14]。由于其相对于传统的培养鉴定流程可以提前1~2 d出结果,因此,对血流感染患者来说,性价比的优势是不言而喻的。
本研究建立的分离胶促凝管联合MALDI-TOF MS除了可以快速精确地直接检测血培养中常见病原菌以外,还可以进一步作如下探索:(1)已有成果表明,在使用MALDI-TOF MS进行血培养细菌快速鉴定的同时进行直接药物敏感性试验,当天出具鉴定和直接药物敏感性结果给临床,以加强抗菌药物有效治疗的管理,这一措施可以缩短患者平均住院天数,降低死亡率,减少住院费用[15-16]。用本方法离心后得到菌体富集物,保持了原有的活性,且菌量足够丰富,为直接药物敏感性试验的步骤提供了有利的条件,本实验室也正在进行相关的比对研究工作;(2)国外已有文献报道,可以利用运输管收集某区域的血培养阳性样本,集中至某一中心实验室进行质谱快速鉴定诊断[17],而本研究所用的分离胶促凝管就可以作为很好的样本运载容器,只需抽取2 mL血培养阳性肉汤注射到真空采血管即可,使区域化的集中检测成为可能;(3)就本研究对复数菌感染的血培养质谱鉴定结果而言,质谱大多能够鉴定出复数菌的其中一种或是未鉴定出,但未发现有鉴定错误的情况。传统的生化反应方法或是基因测序等方法在操作中就“防止污染”要求很高,MALDI-TOF MS则保持良好的“容错性”。有论点认为当复数菌感染且革兰染色难以分辨时,2种评分较高的不同“种”的质谱鉴定结果是一个宝贵的提示。这在本研究中也同样得到了应证。
总之,与传统的培养鉴定流程相比,用分离胶促凝管联合MALDI-TOF MS直接鉴定血流感染中的常见病原菌,符合率较高,且方法快速、简便,成本低廉,实用性强,适合在临床微生物实验室中推广应用。而临床医师可以根据血培养中病原菌的直接鉴定结果,结合本机构的耐药性监测数据,及时对血流感染患者给予早期的抗菌药物治疗。
参考文献
[1]KOCHANEK KD, XU J, MURPHY SL, et al. Deaths: preliminary data for 2009[R]. Natl Vital Stat Rep,2011,59(4):1-51.
[2]刘俊,陶建平. 革兰氏阳性球菌和革兰氏阴性杆菌菌血症的临床对比[J]. 医学信息(下旬刊),2010,23(10):15-16.
[3]WIESER A, SCHNEIDER L, JUNG J, et al. MALDI-TOF MS in microbiological diagnostics-identification of microorganisms and beyond (mini review)[J]. Appl Microbiol Biotechnol,2012,93(3):965-974.
[4]张航烽, 黄文芳. 利用MALDI-TOF MS对血流感染病原菌快速鉴定的研究进展[J]. 中国微生态学杂志,2013,25(2):242-246,封243.
[5]DEVEREUX R, WILKINSON SS. Amplification of ribosomal RNA sequences[M]//KOWALCHUK GA, DE BRUJIN FJ. HEAD IM, et al. Molecular Microbial Ecology Manual. 2nd ed. Dordrecht: Kluwer Academic, 2004: 509-522.
[6]LEINBERGER DM, SCHUMACHER U, AUTENRIETH IB, et al. Development of a DNA microarray for detection and identification of fungal pathogens involved in invasive mycoses[J]. Clin Microbiol, 2005, 43(10): 4943-4953.
[7]MARTINY D, DEDISTE A, VANDENBERG O. Com-parison of an in-house method and the commercial Sepsityper kit for bacterial identification directly from positive blood culture broths by matrix-assisted laser desorption-ionisation time-of-flight mass spectrometry[J]. Eur J Clin Microbiol Infect Dis, 2012, 31(9):2269-2281.
[8]KOK J, THOMAS LC, OLMA T, et al. Identification of bacteria in blood culture broths using matrix-assisted laser desorption-ionization Sepsityper and time of flight mass spectrometry[J]. PloS one, 2011, 6(8):e23285.
[9]HAIGH JD, GREEN IM, BALL D, et al. Rapid identification of bacteria from bioMerieux BacT/ALERT blood culture bottles by MALDI-TOF MS[J]. Br J Biomed Sci, 2013, 70(4):149-155.
[10]FOTHERGILL A, KASINATHAN V, HYMAN J, et al. Rapid identification of bacteria and yeasts from positive-blood-culture bottles by using a lysis-filtration method and matrix-assisted laser desorption ionization-time of flight mass spectrum analysis with the SARAMIS database[J]. Clin Microbiol,2013,51(3):805-809.
[11]UKI N, OHO M, NAGASAWA Z, et al. Direct identification method for bacteria in positive blood culture bottles using MALDI biotyper[J]. Rinsho Byori, 2013, 61(3): 224-230.
[12]MARINACH-PATRICE C, FEKKAR A, ATANASOVA R, et al. Rapid species diagnosis for invasive candidiasis using mass spectrometry[J]. PloS One, 2010, 5(1): e8862.
[13]吕媛,李耘,薛峰,等. 卫生部全国细菌耐药监测网(Mohnarin)2011-2012年度血流感染细菌耐药监测报告[J]. 中国临床药理学杂志,2014,30(3): 278-288.
[14]KUMAR A, ROBERTS D, WOOD KE, et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock[J]. Crit Care Med, 2006, 34(6): 1589-1596.
[15]MACHEN A, DRAKE T, WANG YF. Same day identification and full panel antimicrobial susceptibility testing of bacteria from positive blood culture bottles made possible by a combined lysis-filtration method with MALDI-TOF VITEK mass spectrometry and the VITEK2 system[J]. PloS One, 2014, 9(2):e87870.
[16]PEREZ KK, OLSEN RJ, MUSICK WL, et al. Inte-grating rapid pathogen identification and antimicrobial stewardship significantly decreases hospital costs[J]. Arch Pathol Lab Med, 2013, 137(9): 1247-1254.
[17]SCHIEFFER KM, TAN KE, STAMPER PD, et al. Multicenter evaluation of the Sepsityper extraction kit and MALDI-TOF MS for direct identification of positive blood culture isolates using the BD BACTEC FX and VersaTREK((R)) diagnostic blood culture systems[J]. Appl Microbiol, 2014, 116(4):934-941.
(本文编辑:姜敏)