金果榄组织培养与快速繁殖技术研究
2016-01-18李小泉薛艳霞韦绍龙
李小泉,薛艳霞,韦绍龙
(1.广西壮族自治区农业科学院生物技术研究所, 南宁530007; 2.广西大学农学院, 南宁530005)
金果榄(Tinospora capilliPes Gagnep.)别名地苦胆、山慈菇、九龙胆等,为防己科植物,分布于广西、湖南等地。其干燥块根为我国传统中草药,具有清热解毒、利咽、止痛之功效,常用于治疗咽喉肿痛、痈疽疔毒、泄泻、痢疾、脘腹热痛等症[1]。随着对金果榄研究的不断深入,发现金果榄还具有抗幽门螺杆菌[2]、抑菌[3]、降血糖[4]、抗肿瘤[5]、抗辐射[6]以及改善心脑血管疾病[7]作用,可用于治疗胃溃疡、糖尿病、癌症和老年痴呆[8]等病症。近年来,由于过度采挖,金果榄野生自然资源急剧减少,处于濒危状态。人工栽培是缓解金果榄的供需矛盾、拯救金果榄野生自然资源的有效措施,而种苗则是人工栽培所面临的首要问题。目前对金果榄的研究主要集中于化学成分、药理以及资源调查等方面,种苗繁育方面鲜有报道。植物组织培养不仅具有繁殖系数高、育苗速度快等优点,还能保持原植株的优良性状等特点。因此,开展金果榄组织培养与快速繁殖技术研究,可为金果榄人工栽培提供大量优质种苗。
1 材料与方法
1.1 材 料
金果榄茎节为外植体,茎节分为嫩茎节和老茎节,没有木质化的为嫩茎节,有木质化的为稍老茎节;材料来源于广西靖西县,引种到广西农业科学院生物技术研究所中草药园圃。
1.2 方 法
1.2.1 材料预处理
在天气晴朗的09:00~10:00时,剪取金果榄茎节,去掉叶片,留下0.5cm叶柄,将茎节剪成木质化带节间的茎段、幼嫩的带节间茎段和顶芽约2cm长的3种外植体,用洗衣粉水浸泡20min,自来水清洗10min,高锰酸钾溶液浸泡8min,用滤纸吸干表面水分,备用。
1.2.2 外植体灭菌
在超净工作台上,外植体在75%乙醇浸泡20~30 s,无菌水清洗1次,然后用0.1%升汞(HgCl2)灭菌6~15min,无菌水清洗5次,放在无菌滤纸上吸去多余水分,备用。
1.2.3 培养条件
基本培养基:初代培养、增殖培养为 MS,生根培养为1/2MS,每升培养基中加入5g琼脂、20g白糖,pH 值为5.8,在121℃、0.11kPa灭菌25min,冷却后接入外植体。
在光照强度1 500~2 000μmol/(m2·s)、光照时间12h/d、温度25℃左右的培养室中培养。
1.2.4 初代诱导培养
将灭菌好的金果榄茎节切去两端的旧伤口,接种于初代诱导培养基上。培养基附加的激素以6-BA浓度为0.5,1.0,2.0,3.0mg/L分别与 NAA 0.2mg/L 组合的4个处理,每个处理接种40个外植体,培养30d,统计各处理的芽诱导率。
1.2.5 继代增殖培养
在金果榄初代诱导实验中发现,细胞分裂素6-BA与NAA使用时,金果榄节间单芽诱导率高,丛生芽少,拟在培养基中添加TDZ(噻二唑苯基脲),以期摸索到增殖系数较高的植物生长调节剂适宜添加量的培养基。将初代诱导得到的芽接入增殖培养基培养。增殖培养基中植物生长调节剂组合为:
1)TDZ 0.5mg/L+NAA 0.2mg/L;
2)TDZ 1.0mg/L+NAA 0.2mg/L;
3)TDZ 2.0mg/L+NAA 0.2mg/L;
4)TDZ 0.5mg/L+6-BA 0.5mg/L+NAA 0.2 mg/L;
5)TDZ 0.5mg/L+6-BA 1.0mg/L+NAA 0.2 mg/L;
6)TDZ 1.0mg/L+6-BA 0.5mg/L+NAA0.2 mg/L;
7)TDZ 1.0mg/L+6-BA 1.0mg/L+NAA 0.2 mg/L。
各处理接入20个芽,每7天观察1次,并做好记录,40d时统计各处理芽数,并计算出各处理增殖系数,结果进行统计分析,筛选出最佳增殖系数培养基。
1.2.6 生根培养
经过多次生根培养基的筛选实验发现,金果榄的芽生根比较困难。因此,本研究采用液态植物生长调节剂处理和固态培养基结合的方法,诱导金果榄芽的生根。将生长至3~5cm高的增殖芽切成单芽,基部放入灭过菌的植物生长调节剂溶液中处理10,20 min,接种于1/2MS培养基中培养。植物生长调节剂溶液为IBA 50mg/L+6-BA 10mg/L、IBA 100mg/L+6-BA 10mg/L、NAA 50mg/L+6-BA 10mg/L、NAA 100mg/L+6-BA 10mg/L 4个处理,每处理接入15个芽,每7d观察1次,50d时统计各处理生根情况,计算出各处理的根诱导率和根数,对数据进行统计分析,筛选出较好的植物生长调节剂的处理浓度和时间。
1.2.7 数值计算
芽诱导率(%)=诱导出芽的外植体数/外植体总数×100%。
增殖系数=总芽数/接入芽数。根诱导率(%)=诱导出根的芽数/接入总芽数×100%。
1.2.8 数据分析
每个处理3次重复,应用SPSS 17.0对数据进行统计分析。
2 结果与分析
2.1 最佳外植体筛选和灭菌时间的确定
将金果榄茎节分为芽、嫩茎节、稍有木质化的老茎节3种外植体,3种外植体分别在0.1%升汞中灭菌6,8,10,12min,灭菌后接种于 MS培养基中,20d时统计外植体的污染率、死亡率、出芽率等指标,从而获得不同外植体的最佳灭菌时间。通过对数据进行分析,金果榄芽和嫩枝的最佳灭菌时间为8min,芽的污染率为8.7%、死亡率为12.1%、出芽率为50.3%,嫩枝的污染率为5.7%、死亡率为4.3%、出芽率为72.0%;老茎节的最佳灭菌时间为10min,污染率为25.3%、死亡率为0%、出芽率为96.2%。由此可见,老枝的出芽率最高,且芽比较壮,但污染率也比较高,而且在随后的培养中,老枝上的芽不断有细菌污染出现。为了充分利用好老茎节资源,对老茎节的灭菌方案再做调整,在超净台上,用75%乙醇灭菌30s后,用15%次氯酸钠灭菌20min,无菌水清洗3次,再用0.1%升汞灭菌10min,无菌水清洗5次,接入MS培养基中,污染率降为6.7%、死亡率为3.3%、出芽率为93.5%,得到的芽在随后的培养中成活率高,且污染率大大降低。因此,金果榄老茎节选为最佳的外植体,灭菌处理为15%次氯酸钠灭菌20min,无菌水清洗1次,再用0.1%升汞灭菌10min,无菌水清洗5次。
2.2 6-BA与NAA对金果榄外植体诱导的影响
金果榄带节间的茎段在附加不同浓度6-BA与NAA 0.2mg/L组合培养基上培养10d,金果榄茎段的节间膨大成芽点,15d开始萌发出芽,培养30d时,芽长为1~3cm,各处理的诱导率和芽长势见表1。
从表1可看出,6-BA 浓度在0~2.0mg/L范围内,金果榄带节间的茎段诱导率随着6-BA浓度增加而提高,诱导率高达90.8%;当6-BA浓度增加到3.0 mg/L时,诱导率下降为72.5%,说明6-BA浓度太高不利于金果榄腋芽萌发。经过统计分析,各培养基间的诱导率差异显著,诱导率最高的为3号培养基,芽的长势好。因此,金果榄初代诱导较好的培养基为MS+6-BA 2.0mg/L+NAA 0.2mg/L。

表1 不同培养基对金果榄初代芽诱导的影响
2.3 不同浓度植物生长调节剂组合对金果榄芽增殖的影响
初代诱导得到的芽接种于增殖培养基中培养,7d节间诱导出芽点,15d左右在芽点处陆续长出新芽,40d时记录芽数,并计算出增殖系数(见表2)。
由表2可看出,TDZ与6-BA组合使用对金果榄的丛生芽诱导和芽的长势均有促进作用,虽然(7)号培养基的增殖系数稍高于(6)号,但经过统计分析,2种培养基的增殖系数差异不显著。因此,金果榄增殖培养较好的培养基为(6)MS+TDZ 1.0mg/L+6-BA 0.5mg/L+NAA 0.2mg/L。

表2 不同培养基对金果榄增殖培养的影响
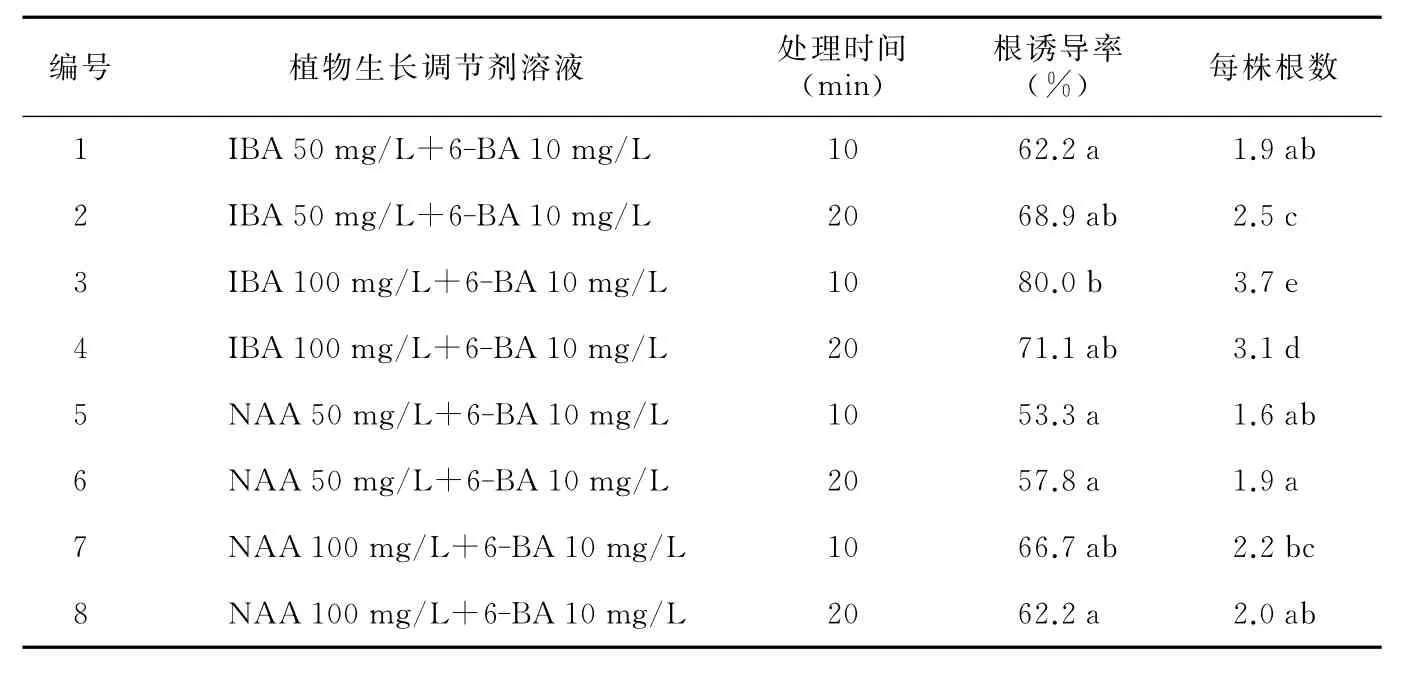
表3 植物生长调节剂溶液对金果榄生根的影响
2.4 IBA、NAA 对金果榄芽生根的影响
金果榄芽基部在灭过菌的植物生长调节剂中处理相应时间后,接种于1/2MS培养基中培养,10d左右芽的基部膨大,形成愈伤组织,20d左右从愈伤组织处长出根,50d统计根诱导率和每个芽诱导出的根条数(见表3)。
由表3可以看出,高浓度生长素处理金果榄芽的基部可以有效诱导出根。相同浓度下,IBA的根诱导率和诱导出的根条数均比NAA的要高,而且NAA处理过的芽的基部愈伤组织特别多,但能长根的不多。在对相关数据进行统计分析发现,IBA 100mg/L+6-BA 10mg/L处理的根诱导率和每株苗的根条数均与其它处理差异大显著水平。因此,植物生长调节剂溶液为IBA 100mg/L+6-BA 10mg/L处理10min时生根效果最好。根诱导率达80%,每株苗根条数为3.7条。
3 结 论
在金果榄最佳外植体筛选过程中,老茎节上诱导出来的芽壮,这可能与老茎节上积累的营养比较丰富以及腋芽的芽原基发育比较好有关。
在金果榄组织培养过程中,存在生根难的问题。而在扦插繁殖过程中,同样存在插条生根影响成活率的问题。为了使插穗尽早生根,通常会采用一些方法进行催根。植物生长调节剂可通过调节扦插苗的生理机能从植物内部起作用[9],适合的生长调节剂对生根具有显著促进作用,常用的生长调节剂为NAA和IBA[10-11]。因此,本研究应用生长素 NAA、IBA 分别与6-BA组合使用,开展金果榄芽激素处理和固态培养基上生根的研究。结果表明,利用高浓度的生长素溶液处理一定的时间对金果榄芽的生根具有促进作用,其中IBA 100mg/L与6-BA 10mg/L组合处理10 min时生根效果最好。由于在植物组织培养过程中,整个培养过程为无菌状态,从而避免了插穗因伤口感染微生物而腐烂等问题,由于在固态培养基中碳源丰富,从而提高了芽的生根率和生根数。该操作简单易行,为生根难的植物建立组培快繁技术体系提供了技术参考。
[1]黄燮才.常用中草药识别与应用(第二版)[M].北京:化学工业出版社,2003:401-401.
[2]张煜,王彦峰.广西常用中草药、壮药抗幽门螺杆菌作用的筛选研究[J].中国民族民间医药,2008(10):19-20,44.
[3]华娟,周明康,周琼珍,等.50种传统热解毒药的抑菌实验[J].中药材,1995,18(5):255-258.
[4]左风.心叶青牛胆根提取物对四氧嘧啶糖尿病大鼠的抗氧化作用[J].国外医学(中医中药分册),2002,24(2):105.
[5]Mathew S.,Kuttan G..Immunomodulatory and antitumour activities of Tinospora cordifolia[J].Fitoterapia,1999,70(1):35-43.
[6]胡建英.心叶青牛胆可改变小鼠经γ射线照射后的死亡率[J].国外医药(植物药分册),2005,20(1):31.
[7]王维亭.波叶青牛胆中cycloneucalenol与cycleucalenone对心脏收缩的影响[J].国外医药(植物药分册),2004,19(2):73-74.
[8]赵鑫.用心叶青牛胆、积雪草、南非醉茄等提取物治疗痴呆和阿尔茨海默病[J].国外医药(植物药分册),2007,22(5):223.
[9]詹亚光,杨传平,金贞福,等.白桦插穗生根的内源激素和营养物质[J].东北林业大学学报,2001,29(4):1-4.
[10]彭子模,程伟,高雁,等.萘乙酸对几种植物扦插生根的影响[J].新疆师范大学学报,2002,21(2):34-38.
[11]曾庆钱,杨红梅,黄珊珊,等.南板蓝扦插繁殖技术研究[J].亚热带植物科学,2011,40(4):1-4.
