马铃薯提取物对非小细胞肺癌细胞凋亡、增殖的影响及机制探讨
2016-01-12姚星宇,石有,贾丽秋等
马铃薯提取物对非小细胞肺癌细胞凋亡、增殖的影响及机制探讨
姚星宇1,石有2,贾丽秋3,赵鹏伟3,孙鹏3,房启林4,王桂卿4,杨丽敏3
(1呼伦贝尔市中蒙医院,内蒙古呼伦贝尔021400;2内蒙古蒙健生物科技有限公司;3内蒙古医科大学;4呼伦贝尔市人民医院)
摘要:目的探讨马铃薯提取物对非小细胞肺癌A549细胞的抑制作用及其对凋亡相关蛋白Bax、Bcl-2的影响。方法培养A549细胞,分为对照组、实验组。观察组分别加入5.0、12.5、25.0、50.0 μL的马铃薯提取物,每个浓度设3个复孔,分别培养24、48、72 h。对照组不加入马铃薯提取物。各组干预24 h后,倒置荧光显微镜下观察A549细胞凋亡情况。采用MTT法检测各组492 nm处吸光度值,计算细胞增殖抑制率。采用RT-PCR法检测各组Bax、Bcl-2 mRNA的表达。结果荧光显微镜下,对照组细胞生长旺盛,分布稠密,形态饱满呈梭形,观察组各时间点细胞均出现不同程度的凋亡现象。同时间点,马铃薯提取物浓度高者细胞增殖抑制率较高(P均<0.05);马铃薯提取物同一浓度时,干预时间长者细胞增殖抑制率较高(P均<0.05)。观察组不同浓度马铃薯提取物干预后,Bax mRNA表达均高于对照组,Bcl-2 mRNA表达均低于对照组(P均<0.05)。结论 马铃薯提取物可促进A549细胞凋亡,抑制细胞增殖,其作用机制可能与上调Bax及下调Bcl-2的表达有关。
关键词:马铃薯;非小细胞肺癌;A549细胞;细胞凋亡;Bcl-2基因;Bax基因
doi:10.3969/j.issn.1002-266X.2015.42.005
中图分类号:R979.1 文献标志码:A
基金项目:内蒙古自治区科技厅重大课题资助项目(2013150103000119)。
作者简介:第一姚星宇(1973-),女,硕士学位,主任医师,研究方向为神经系统肿瘤的治疗。E-mail:2412602429@qq.com
作者简介:通信杨丽敏(1960-),女,实验师,研究方向为中药提取、病原微生物及免疫。E-mail:2412602429@qq.com
收稿日期:(2015-03-20)
Effects of potato extracts on apoptosis and proliferation of non-small-cell
lung cancer cells and its mechanism
YAOXing-yu1, SHI You, JIA Li-qiu, ZHAO Peng-wei, SUN Peng, FANG Qi-lin,
WANGGui-qing,YANGLi-min
(1Sino-MongolianHospitaloftheHulunbuir,Hulunbuir021000,China)
Abstract:Objective To investigate the inhibitory effect of potato extracts on non-small-cell lung cancer (NSCLC) A549 cells and the influence on apoptosis-related proteins Bax and Bcl-2. MethodsThe cultured A549 cells were divided into the control group and observation group. Different concentrations of potato extracts (5.0, 12.5, 25.0 and 50.0 μL) were added into the A549 cells of the observation group, and then the A549 cells were cultured for 24, 48 and 72 h (3 holes were set in each concentration). The control group was not added with any potato extract. The apoptosis was observed after 24 h of treatment by inverted fluorescence microscope. And the inhibition rate was obtained by OD value in 492nm by MTT method. The Bax and Bcl-2 mRNA expression was detected by RT-PCR. Results Under the fluorescence microscope, the cells were growing strong, the distribution was dense and the shape of the cells was spindle. The cells in the observation group showed apoptosis at different time points. Meanwhile, the cell inhibition rate in the group with high concentration of potato extracts was higher (all P<0.05). The cell inhibition rate was also higher in the group with the same concentration but longer intervention time (all P<0.05). Bax mRNA expression in each observation groups was higher than that of the control group. However, Bcl-2 expression was lower than that of the control group (all P<0.05). ConclusionPotato extracts can promote the apoptosis of A549 cells and inhibit the cell proliferation, whose mechanism may be related to up-regulation of Bax and down-regulation of Bcl-2 expression.
Key words: potatoes; non-small-cell lung cancer; A549 cells; apoptosis; Bcl-2 gene; Bax gene
肺癌已成为导致患者死亡最常见的恶性肿瘤类型[1]。非小细胞肺癌(NSCLC)是最常见的肺癌类型。NSCLC的治疗以化疗为主[2]。但NSCLC对化疗药物的敏感度低,易产生耐药性,消化道反应及肾毒性等严重不良反应发生率高[3]。因此,寻找高效、安全的抗肿瘤药物已成为NSCLC治疗研究的热点。Bax、Bcl-2分别为最主要的促进凋亡和抑制凋亡的蛋白,在肿瘤的发生发展中具有重要作用[4]。马铃薯具有抗氧化、降低胆固醇及抗氧化等多种作用[5]。但马铃薯的抗肿瘤作用尚不明确。2013年9月~2014年10月,我们观察了马铃薯提取物对人NSCLC A549细胞体外增殖和凋亡的作用,探讨马铃薯提取物的抗肿瘤作用机制。
1材料与方法
1.1细胞及试剂NSCLC A549细胞株购于中国医学科学院上海细胞库。马铃薯提取物由内蒙古医科大学病原微生物与免疫学实验室提供,采用低温冷冻离心法提取,所得提取物中氨基酸含量为6.8 g/L。DMEM培养基、10%胎牛血清、青链霉素双抗、MTT、DMSO、胰蛋白酶均购自Sigma公司。PCR试剂盒购自大连宝生物工程有限公司。
1.2细胞培养及分组处理将A549细胞培养于含10%胎牛血清的双抗DMEM培养基中,在37 ℃、5%CO2、饱和湿度的条件下,于细胞培养箱中培养。分为观察组及对照组,培养12 h后,待细胞生长至贴壁铺满后,接种于96孔板中,每孔100 μL悬液。观察组分别加入5.0、12.5、25.0、50.0 μL的马铃薯提取物,每孔最终总体积均为200 μL,每个浓度设3个复孔,在37 ℃、饱和湿度下分别培养24、48、72 h。对照组不加入马铃薯提取物,分别培养24、48、72 h。
1.3细胞凋亡情况观察各组干预后24 h,倒置荧光显微镜下观察A549细胞凋亡形态变化。
1.4细胞增殖情况观察采用MTT法,各时间点培养结束前4 h,每孔加入MTT溶液15 μL,4 h后去掉上清,每孔加入DMSO 100 μL,震荡10 min,酶联免疫仪测492 nm处吸光度值(A492值),计算细胞增殖抑制率。细胞增殖抑制率=[1-(观察组A492-对照组A492)/对照组A492]×100%。实验重复3次,取均值。
1.5Bax、Bcl-2 mRNA表达检测采用RT-PCR法。根据MTT结果,选取12.5、25.0及50.0 μL马铃薯提取物作用于观察组细胞培养48 h。对照组不加入马铃薯提取物,培养48 h。TRIzol法提取两组总RNA,Bax、Bcl-2反应条件均为94 ℃ 3 min,94 ℃ 45 s、52 ℃ 45 s、72 ℃ 45 s共30个循环,72 ℃退火8 min。用1%琼脂糖凝胶行电泳,凝胶成像系统照相,测定目的RNA扩增产物与GAPDH的积分光密度值(IOD),计算两者的比值作为目的基因mRNA的相对表达量。

2结果
2.1马铃薯提取物对细胞凋亡的影响荧光显微镜下,对照组细胞生长旺盛,分布稠密,形态饱满呈梭形。观察组各时间点细胞均出现不同程度的凋亡,细胞分布稀疏,细胞体积明显缩小,多数细胞呈圆形,核质比例明显增大,凋亡细胞数量明显增加,此变化随马铃薯提取物浓度的升高更为明显。
2.2马铃薯提取物对A549细胞增殖的影响同时间点,马铃薯提取物浓度高者细胞增殖抑制率较高(P均<0.05);同一马铃薯提取物浓度时,干预时间长者细胞增殖抑制率较高(P均<0.05)。见表1。
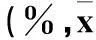
表1 观察组不同时间点细胞增殖抑制率比较 ± s)
注:与同时间点较低一级浓度时比较,*P<0.05;与同一浓度时前一时间点比较,#P<0.05。
2.3各组Bax、Bcl-2 mRNA表达比较观察组不同浓度马铃薯提取物干预后,Bax mRNA表达均高于对照组,Bcl-2 mRNA表达均低于对照组(P均<0.05)。见表2。
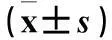
表2 两组Bax、Bcl-2 mRNA表达比较
注:与对照组比较,*P<0.05。
3讨论
近年研究发现,天然植物提取物在肿瘤治疗和预防中具有积极作用,可以抑制肿瘤增殖和转移,减轻放化疗的不良反应,可改善人体对抗肿瘤药物的耐药性。目前,喜树碱、长春新碱、紫杉醇等天然植物提取物已广泛应用于肿瘤的临床治疗,具有不良反应小、疗效好的优势,在治疗肿瘤中具有重要作用[6]。
研究发现,马铃薯富含人类所需的8种必需氨基酸,包括谷类中含量较少的的赖氨酸和色氨酸、大量的胶原和黏液多糖等物质,有助于保持人体动脉血管的弹性及关节面和浆膜腔内的润滑,防止肾脏和肝脏的结缔组织发生萎缩[5]。近年研究表明,马铃薯的多酚类成分原花青素具有强有力的抗氧化、清除自由基及改善体循环的特殊功效,并有防止心血管疾病、抗肿瘤、抗辐射、抗血小板聚集的作用[7,8]。本研究发现,荧光显微镜下观察组A549细胞均出现不同程度的凋亡,观察组马铃薯提取物浓度高者细胞增殖抑制率较高、干预时间长者细胞增殖抑制率较高,提示不同浓度的马铃薯提取物均可抑制A549细胞增殖,且随着时间延长、抑制作用增强。
细胞凋亡是由基因控制的细胞自主的程序性死亡,是受多种凋亡相关蛋白调控的复杂生化反应。凋亡相关蛋白的异常表达及功能改变与肿瘤的发生有关,是影响肿瘤治疗效果的重要因素[9]。Bcl-2家族蛋白是目前研究最多的凋亡相关蛋白[10,11]。Bax、Bcl-2是最常见的Bcl-2家族蛋白成员。Bcl-2主要存在于细胞器膜上,具有抑制细胞凋亡的作用[12,13]。Bax是Bcl-2家族中最具代表性的促凋亡蛋白,定位于细胞质中,可与自身形成同源二聚体,或与Bcl-2结合形成异源二聚体。细胞凋亡的发生主要取决于促凋亡与抑凋亡蛋白间的相对浓度[14]。当Bc1-2浓度高于Bax时,细胞趋于存活;当Bax浓度高于Bc1-2时,细胞则趋于凋亡[15~17]。此外,Bax可对Bcl-2的表达进行调节,当细胞中Bax增加时,可促进Bax同源二聚体的形成,拮抗Bcl-2的作用,促进细胞凋亡;反之,当Bcl-2增多时,Bcl-2易于与Bax形成异源二聚体,抑制细胞凋亡。本研究发现,观察组不同浓度马铃薯提取物干预后,Bax mRNA表达均高于对照组,Bcl-2 mRNA表达均低于对照组,提示马铃薯提取物抑制A549细胞增殖的作用可能与调控细胞凋亡过程、促进细胞凋亡有关。
参考文献:
[1] Jemal A, SiegeI R, Xu J, et al. Cancer statistics,2010[J]. CA Cancer J Clin, 2011,61(2):133-134.
[2] 孙彬栩,杨佩颖.非小细胞肺癌多药耐药机制及其逆转的研究进展[J]. 疑难病杂志2013,12(1):77-79.
[3] 姜彪,李积德,赵君慧,等.非小细胞肺癌治疗进展[J].社区医学杂志,2012,10(9):10-12.
[4] 秦叔逵,黄勇,隋东虎,等.不同铂类联合紫杉类或长春瑞滨对非小细胞肺癌荷瘤裸鼠抑瘤作用的实验研究[J].临床肿瘤学杂志,2011,16(3):206-210.
[5] 张秋燕,张福平.马铃薯品种的营养成分分析[J].中国食物与营养,2010,21(6):75-77.
[6] 吴唐维,宁勇,陈卫群.微RNA参与中药抗肿瘤作用的研究进展[J].重庆医学,2013,42(13): 1536-1538.
[7] Malencic D, Maksimovic Z, Popovic M, et al. Polyphonelcontents and antioxidant activity of soybean seed Extracts[J]. Bioresore Technol, 2008,99(14):6688-6691.
[8] 李敏,刘磊,郭玉蓉,等.马铃薯多酚氧化酶的特性研究[J].甘肃农业大学学报,2005,40(2):189-192.
[9] 赵彦超,顾耘.细胞凋亡通路研究进展[J].现代医学,2013,41(4):285-288.
[10] Gómez-Fernández JC. Functions of the C-terminal domains of apoptosis-related proteins of the Bcl-2 family[J]. Chem Phys Lipids, 2014,183(7):59-68.
[11] Tokar T, Ulicny J. The mathematical model of the Bcl-2 family mediated MOMP regulation can perform a non-trivial pattern recognition[J]. PLoS One, 2013,8(12):81-86.
[12] 李希波,赵健,王善政,等. Bcl-2/Bax基因在非小细胞肺癌中的表达异常及其与吸烟的关系[J].山东医药,2006,46(7):18-19.
[13] 阳诺,冼磊,陈铭伍,等.非小细胞肺癌患者Bc-l 2蛋白的表达及意义[J].广西医学,2011,33(5):543-545.
[14] Martinou JC, Youle RJ. Mitochondria in apoptosis: Bcl-2 family members and mitochondrial dynamics[J]. Dev cell, 2011,21(1):92-101.
[15] Otterson MF, Nie L, Schmidt JL, et al. EUK-207 protects human intestinal microvascular endothelial cells (HIMEC) against irradiation-induced apoptosis through the Bcl-2 pathway[J]. Life Sci, 2012,22(91):15-16.
[16] Kim J, Parrish AB, Kurokawa M, et al. Rsk-mediated phosphorylation and 14 -3 -3ε binding of Apaf -1 suppresses cytochrome c -induced apoptosis [J]. EMBO J, 2012,31(7):1279-1292.
[17] Golestani EB, Sanati MH. Expression and prognostic significance of bcl-2 and bax in the progression and clinical outcome of transitional bladder cell carcinoma[J]. Cell J, 2014,15(4):356-363.
