氧化苦参碱不同途径给药治疗重症急性胰腺炎临床观察
2016-01-12邵庆亮,张志强,柳青峰等
氧化苦参碱不同途径给药治疗重症急性胰腺炎临床观察
邵庆亮,张志强,柳青峰,臧辉,宫本松
(辽宁省人民医院,沈阳110016)
摘要:目的观察氧化苦参碱(OM)不同途径给药治疗重症急性胰腺炎(SAP)的效果。方法70例SAP患者,按随机数字表法分为四组:对照组(15例)接受基础治疗,OM灌洗组(15例)在基础治疗同时接受OM腹腔灌洗治疗,OM灌肠组(20例)在基础治疗同时接受OM灌肠治疗,OM静滴组(20例)在基础治疗同时接受OM静脉滴注治疗。观察各组患者临床症状的变化并于治疗开始前(D0)和治疗后24 h(D1)、48 h(D2)、72 h(D3)检测血清内毒素和血浆D-乳酸,于D4和D7检测血清IL-1、IL-6和TNF-α。结果OM静滴组的腹痛缓解时间、血清淀粉酶恢复时间和住院时间短于OM灌肠组和OM灌洗组(P均<0.05),OM灌肠组的首次排便时间短于OM静滴组和OM灌洗组(P均<0.05)。D1、D2、D3时,OM静滴组和OM灌肠组的血清内毒素和血浆D-乳酸水平低于OM灌洗组(P均<0.05);D4、D7时,OM静滴组的血清IL-1、IL-6、TNF-α水平低于OM灌肠组和OM灌洗组(P均<0.05)。结论 OM治疗SAP的三种给药途径相比,静滴效果最佳且患者接受度高,灌肠给药可促进排便,腹腔灌洗的效果略差。
关键词:胰腺炎;急性胰腺炎;重症急性胰腺炎;氧化苦参碱;给药途径
doi:10.3969/j.issn.1002-266X.2015.43.034
中图分类号:R576文献标志码:B
基金项目:辽宁省临床能力建设项目(青年项目)(LNCCC-D33-2015)。
收稿日期:(2015-08-24)
通信作者:张志强
重症急性胰腺炎(SAP)是一种由多因素诱发的急性危重病,进展快,常继发多器官功能障碍和器官衰竭,病死率高,目前尚无特效治疗方法。近年来,在SAP的治疗过程中,作为联合用药之一,氧化苦参碱(OM)的疗效获得认可[1,2]。OM用于SAP的治疗,其给药途径通常有三种,即腹腔灌洗、灌肠、静脉滴注,何种给药途径可获得更好的疗效,目前尚未见报道,本研究对此进行了观察。现将结果报告如下。
1资料与方法
1.1临床资料2014年1月~2015年1月辽宁省人民医院收治的SAP患者70例,男38例,女32例;年龄22~55岁;发病时间1~5 h;入院时血钙<2 mmol/L者36例,血糖>15mmol/L者30例。按随机数字表法将70例患者随机分为对照组15例、OM灌洗组15例、OM灌肠组20例、OM静滴组20例。四组患者的年龄、性别具有可比性(P均>0.05)。
1.2治疗方法 对照组给予基础治疗:①足量抗生素防治感染;②奥美拉唑、生长抑素等基础药物;③禁水,禁食,持续胃肠减压;④纠正电解质平衡和酸碱平衡;⑤营养支持治疗。OM灌洗组在基础治疗同时接受OM腹腔灌洗:全麻,脐下切口置入腹腔镜行腹腔探查,于剑突下和左、右锁骨中线肋缘下3 cm处穿刺,将套管和相关器械置入,吸净渗液,生理盐水反复冲洗,充分暴露胰腺和小网膜囊,分别将一根PTCD猪尾巴管和普通乳胶引流管放置于患者的小网膜囊部和盆腔;术后经PTCD猪尾巴管行OM腹腔灌洗,每次用OM溶液500 mL (含OM 200 mg),1次/12 h,为保持引流通畅应反复变换患者体位。OM灌肠组在基础治疗同时接受OM灌肠:500 mL温盐水灌肠,1次/12 h;排便结束后20 min,于患者肛管10~15 cm处低流速灌入39~41 ℃的OM溶液100 mL (含OM 200 mg),确保液面距肛门<30 cm,灌肠结束后保留1 h。OM静滴组在基础治疗同时接受OM静脉滴注:OM溶液100 mL(含OM 200 mg)静脉滴注,1次/12 h。
1.3观察指标及方法①临床指标:观察各组患者的腹痛缓解时间、首次排便时间、血清淀粉酶恢复时间和住院时间。②血清内毒素和血浆D-乳酸检测:分别于治疗开始前(D0)和治疗后24 h(D1)、48 h(D2)、72 h(D3)检测患者血清内毒素和血浆D-乳酸。血清内毒素检测用终点显色法;血浆D-乳酸检测用酶比色法。③血清IL-1、IL-6和TNF-α检测:分别于D4和D7晨抽取患者的空腹肘静脉血5 mL,离心(3 000 r/min),取1 mL血清,用校准稀释液稀释1 000倍以上,用酶联免疫吸附双抗体夹心法检测IL-1、IL-6和TNF-α。
1.4统计学方法采用SPSS13.0统计软件。计量资料多组间比较用方差分析。P<0.05为差异有统计学意义。
2结果
2.1四组临床指标比较治疗后四组患者临床指标比较见表1。
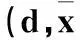
表1 治疗后四组患者的临床指标比较 ± s)
注:与对照组相比,*P<0.05,△P<0.01;与OM灌肠组和OM灌洗组相比,#P<0.05;与OM灌洗组相比,▲P<0.05。
2.2治疗前后四组血清内毒素和血浆D-乳酸水平比较治疗前后四组患者血浆IL-1、IL-6、TNF-α水平比较见表2。
2.3治疗前后四组清浆IL-1、IL-6、TNF-α水平比较治疗前后四组患者血清IL-1、IL-6、TNF-α水平比较见表3。
3讨论
SAP是一种局灶性或弥漫性的胰酶异常活化的急性炎症,发病机制尚不明确,常在继发感染状态下并发多器官衰竭。超过50%的SAP患者死于肠内常驻菌移位所致的继发感染,这可能与肠上皮细胞旁间隙的异常开放有关。生理状态下的肠上皮细胞旁间隙充满了由跨膜蛋白、胞质附着蛋白和连接黏附分子所组成的蛋白复合体,受到内毒素和TNF-α等多种细胞因子的调节。SAP患者因多项炎症因子过度表达而造成蛋白通道异常开放,肠黏膜对细菌和毒素蛋白通透性增高,引发细菌移位入血并继发感染。单一炎症因子的抑制或活化无法阻止SAP的进展,需要选取抗炎效力强、作用广泛、安全性高的药物进行调控。
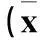
表2 治疗前后四组血清内毒素和血浆D-乳酸水平比较 ± s)
注:与对照组相比,*P<0.05,△P<0.01;与OM灌洗组相比,#P<0.05。

表3 治疗前后四组血清IL-1、IL-6、TNF-α水平比较
注:与对照组相比,*P<0.05,△P<0.01;与OM灌肠组和OM灌洗组相比,#P<0.05。
OM是一种提取自苦豆子和苦参等自然植物的苦参型生物碱,具有抗炎、抗病原体、调节免疫、利尿、护肝、延缓肝纤维化等多重功效。目前,OM已作为奥美拉唑、生长抑素的联合用药逐渐应用于SAP的治疗中,疗效显著[7,8]。OM有助于减少粒细胞凝聚,避免过度免疫,因而可促进肠黏膜屏障损伤的修复,有效避免因肠道屏障功能紊乱而造成的细菌移位。本研究发现,在常规治疗的基础上,三种途径给予OM治疗SAP,患者临床指标的改善情况均优于单纯常规治疗者。D-乳酸是细菌发酵产物,内毒素是革兰阴性菌胞壁中的脂多糖,两者均可在急性肠道损伤后经受损肠黏膜入血[11]。因而,动态观察血清内毒素和血浆D-乳酸的水平变化有助于判断肠黏膜通透性和损害程度,了解细菌移位状态和SAP病情。我们在前期的大鼠SAP模型实验中发现,分别经腹腔、肠道及静脉给予OM,SAP大鼠血浆D-乳酸和血清内毒素水平均显著下降,本次观察结果与之相吻合,提示OM治疗可有效改善SAP患者的肠道屏障功能,减少肠道细菌的移位。此外,本研究发现,分别经腹腔、肠道及静脉给予OM进行治疗,SAP患者的血清IL-1、IL-6、TNF-α水平均下降,提示OM可同时阻止活化IL-1、IL-6、TNF-α等炎症因子而发挥治疗作用。
本研究发现,OM静滴组的血浆D-乳酸、血清内毒素和三种炎症因子水平均迅速下降,腹痛缓解和血淀粉酶恢复时间最快,总体表现最佳,考虑与药物静脉滴注经血吸收快、吸收完全、起效快有关。静脉滴注具有操作简单、较少禁忌证、患者接受度高等优势,因而可考虑为首选给药途径。OM灌肠给药的综合表现也较为理想,虽实验室指标略次于静滴组,但由于灌肠给药可使药物直接作用于肠道,一定程度上促进了药物的吸收,基本确保了药物疗效;且灌肠可直接刺激直肠排便,加之OM灌肠已有一定的临床应用基础,操作技术较简单,无显著不良刺激,可作为备选的OM给药途径。OM灌洗作为腹腔镜微创操作确保了低创治疗需求,但药物经腹腔吸收有限,且患者接受度普遍较低,应严格筛适应证,对于病情重、需紧急开腹者可考虑同时应用。
综上所述,在SAP的治疗中,OM静滴和OM灌肠可降低患者血浆D-乳酸和血清内毒素水平,OM静滴见效快、患者接受度高,OM灌肠可缩短患者排便时间。OM腹腔灌洗疗效略逊于上述疗法,但仍优于常规治疗。可根据患者病情选取不同的OM给予途径。
参考文献:
[1] 彭燕,韩凌,孙静,等.氧化苦参碱及TNF-α对结肠癌LOVO细胞分泌炎性细胞因子的影响[J].山东医药,2014,54(9):36-37.
[2] 李顺,刘泉,魏学斌,等.氧化苦参碱对体外培养人膀胱癌T24细胞生长的抑制作用及其机制[J].山东医药,2013,53(5):57-59.
[3] 吴洁,荣大庆,柳青峰,等.腹腔镜下氧化苦参碱腹腔灌洗对重症急性胰腺炎肠黏膜屏障损伤的作用[J].腹腔镜外科杂志,2013,18(6):415-418.
[4] 吴洁,荣大庆,柳青峰,等.氧化苦参碱保留灌肠对重症急性胰腺炎的疗效[J].实用药物与临床,2014,17(2):131-134.
[5] 张志强,王燕庆,董明,等.氧化苦参碱诱导跨膜蛋白Claudin-1表达在重症急性胰腺炎大鼠肠黏膜损害中的作用[J].世界华人消化杂志,2011,19(5):510-514.
[6] Zhang ZQ, Wang YQ, Dong M, et al. Oxymatrine ameliorates l-arginine-induced acute pancreatitis in rats[J]. Inflammation, 2012,35(2):605-613.
[7] Wang S, Wang G, Li X, et al. Simultaneous determination of oxymatrine and its active metabolite matrine in dog plasma by liquid chromatography-mass spectrometry and its application to pharmacokinetic studies[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2005,817(2):319-325.
[8] 柴宁莉,常青,徐世平,等.氧化苦参碱脂质体对大鼠肝星状细胞作用的差异蛋白电泳分析[J].中国中西医结合杂志,2013,33(5):679- 685.
[9] Zhang B, Niu W, Xu D, et al. Oxymatrine prevents hypoxia- and monocrotaline-induced pulmonary hypertension in rats[J]. Free Radical Biol Med, 2014, 69(4):198-207.
[10] Song G, Luo Q, Qin J, et al. Effects of oxymatrine on proliferation and apoptosis in human hepatoma cells[J]. Colloids Surf B Biointerfaces, 2006,48(1):1-5.
[11] Zhang TZ, Fu Q,Chen T, et al. Anti-asthmatic effects of oxymatrine in a mouse model of allergic asthma through regulating CD40signaling[J]. Clin J Nat Med, 2015,13(5):368-374.
