缝隙连接与神经病理性痛的研究进展
2016-01-12彭力超梁尚栋
彭力超,梁尚栋
(南昌大学基础医学院生理学教研室,江西 南昌 330006)
缝隙连接与神经病理性痛的研究进展
彭力超,梁尚栋
(南昌大学基础医学院生理学教研室,江西 南昌330006)
中国图书分类号:R-05;R322.8;R329.24;R441.1;R741.02
摘要:缝隙连接是介导相邻细胞间物质转运、化学或电信号传递的专用跨膜通道,维持着细胞内环境的稳定。在神经系统中,缝隙连接不仅介导神经元和胶质细胞的胞间偶合,还参与病理条件下继发性损害。目前,研究证明缝隙连接在由神经系统损伤引起的神经病理性痛中发挥作用。对缝隙连接与神经病理性痛的关系进行研究有助于更深层次的了解神经病理性痛的发病机制,为治疗神经病理性痛提供新的研究方向。
关键词:缝隙连接;连接蛋白;神经系统;胶质细胞;神经病理性痛;缝隙连接阻断剂
梁尚栋(1957-),男,博士,教授,博士生导师,研究方向:神经生理学与神经药理学, 通迅作者,E-mail: liangsd88@163.com
缝隙连接(gap junction,GJ)最早由Karrer在1960年发现。经过许多学者的多年研究,对GJ的结构和功能已经有了较深的认识。GJ几乎存在于所有动物的细胞膜上,由每个细胞提供一个半通道(连接子)紧密结合形成相邻细胞间的通讯通道,每个半通道由6个相同或相似的跨膜连接蛋白呈环状排列构成,中央形成一个直径约1.5~2.0 nm的亲水性通道,这是细胞间进行直接交流胞质成分的唯一通讯通道。GJ的通道允许相对分子质量小于1 ku的分子通过,如细胞内的无机盐离子、糖、氨基酸、核苷酸、维生素、三磷酸腺苷(ATP)、环磷酸腺苷(cAMP)和肌醇三磷酸(IP3)等小分子物质能从一个细胞通过GJ的通道进入另一个细胞,从而实现代谢偶联或电偶联[1]。GJ既可以存在于两种相同类型的细胞间,也能连接两种不同类型的细胞。例如,在中枢神经系统中,神经元之间、胶质细胞之间(包括星型胶质细胞之间、少突胶质细胞之间和星形胶质细胞与少突触细胞之间)[2]。与中枢神经系统中的GJ相似,在外周神经系统中,神经元之间和胶质细胞之间也存在GJ。这些细胞通过GJ相互连接形成功能合胞体,在神经冲动信息传递及各种反应过程中,通过调节细胞外离子浓度,神经元与神经胶质细胞间的电活动等作用维持着细胞内环境的稳定和神经元功能的实现[3-4]。近年来对于神经胶质细胞与神经元的GJ研究发现,在神经病理性疼痛模型中上述细胞间的GJ明显增加,并且相关区域的GJ蛋白表达也增加,使用GJ阻断剂后,疼痛有所缓解。这使得许多研究工作者开始将治疗神经病理痛的注意力从神经元转移到胶质细胞之间的GJ上,这将为后续开发治疗神经病理痛的药物提供一个新靶标。
1缝隙连接的结构、分布和功能
1.1缝隙连接的结构与分布缝隙连接是相邻细胞间细胞膜上的一种特殊结构,允许细胞间直接进行物质和信息交换,实现相邻细胞间直接通讯,这种通讯也叫做缝隙连接细胞通讯(gap junctional intercellular communication,GJIC)。缝隙连接通道是由相邻的两个细胞各提供一个连接子(connexon)对接形成,两个连接子之间存在2~3 nm的间隙,因而缝隙连接也称间隙连接。每个连接子含6个跨膜蛋白质亚单位,即缝隙连接蛋白(connexin,Cx)。由相同Cx组成的连接子称为同聚体连接子,不同的连接子组成异聚体连接子,同聚体连接子参与构成同型缝隙连接,异聚体连接子参与构成异型缝隙连接[1-2]。每个Cx都具有4个保守的ɑ螺旋跨膜区(M1-M4)、2个胞外环(C1-C2)和3个胞内成分(1个胞内环、1个氨基末端和1个羧基末端)。2个胞外环是Cx最为保守的结构,每个胞外环含有3个半胱氨酸残基,保证连接子的正确对接。胞内成分中,N端相对比较保守,而C端差异性比较大,携带某些磷酸化调节位点。Cx是由多基因家族编码的一大类膜蛋白,目前已从不同动物和组织中分离出20余种Cx,它们有近50%的氨基酸序列相同。其相对分子质量26 000~60 000不等。Cx是根据它们的分子质量不同来命名的,如Cx43因其分子质量为43 ku而得名[1,3]。
研究表明,除了在精母细胞、红细胞、血小板、成人骨骼肌上和某些成年神经元群体没有连接蛋白基因分布外,其他几乎所有的哺乳动物细胞上均有其分布[1]。在不同的细胞和(或)细胞的不同发育阶段,所表达的Cx类型及表达的量都有所不同,有些Cx表达于单一的组织中,而有些组织和细胞同时表达多种类型的Cx。迄今为止,已经确定至少有11种Cx在哺乳动物的神经系统中表达,Cx26、Cx29、Cx30、Cx31、Cx32、Cx33、Cx36、Cx37、Cx40、Cx43、Cx45 均在神经系统中大量表达[3]。其中神经元上表达的主要是Cx26、Cx32 和Cx36,分布尤为广泛的是Cx32;星形胶质细胞和卫星胶质细胞中表达最多、分布最广的是Cx43;而在少突胶质细胞中主要表达Cx32[2]。近几年神经系统的研究表明,除了神经元外,胶质细胞也在神经病理痛中发挥重要的作用。本篇综述着重于神经系统中的缝隙连接,特别是神经病理性疼痛时外周初级感觉神经节和脊髓胶质细胞上的缝隙连接。
1.2神经系统中缝隙连接的功能
1.2.1神经元中缝隙连接的作用中枢和外周神经系统的神经元大部分区域存在缝隙连接,允许神经元之间进行离子交换,是神经元之间的电突触结构,具有单向或双向传递神经冲动的功能。哺乳动物中枢神经系统发育过程中 ,通常在出生后2周内,神经元之间的间隙连接偶合和Cx36的表达会瞬时增加,在神经元发育中起到重要的作用[5]。神经元损伤后,代谢型谷氨酸受体激活导致神经元间缝隙连接增加,神经元间的缝隙连接参与了神经元死亡机制,但具体机制仍不明确[6]。GJ是神经活动同步化的关键因素之一。大脑中许多功能是以GJ介导的神经活动同步化为基础的,包括认知功能,例如记忆的巩固、感知和学习,海马体中Cx36组成的缝隙连接通道参与短期记忆,并通过改变神经干细胞的分化参与神经元重构[7-8]。此外,神经元之间的GJ允许第二信使在细胞间流动,保证功能区内的细胞生物效应协调一致。
1.2.2胶质细胞中缝隙连接的作用在神经系统中,星形胶质细胞间的缝隙连接研究较多,超微结构显示这些GJ大部分包围着神经元的胞体、树突和轴突。脑类糖原主要贮存在星形胶质细胞中,由于GJ允许小分子代谢物和信号分子通过,由GJ实现细胞间的偶联,保证正常的生命活动。研究证明,神经冲动时,神经元中大量的K+外流,此时星形胶质细胞K+通道激活,K+大量流入星形胶质细胞内,并迅速通过GJ运送到相邻细胞内,达到清除细胞外K+,维持神经元外环境K+的稳态的功能,保证神经元电活动的正常进行[9]。神经损伤后,诱发脊髓中星形胶质细胞K+通道关闭,导致其缝隙连接蛋白功能中断,从而诱发神经性疼痛[10]。此外,星形胶质细胞间的GJ是胶质细胞长距离信号传播的生物基础。胶质细胞受刺激后,细胞内的Ca2+浓度发生改变,通过GJ使其它偶联的胶质细胞内的Ca2+浓度也发生改变,即形成Ca2+波(calcium wave) 。胶质细胞通过Ca2+波调节神经系统的功能[11]。对卫星胶质细胞间的缝隙连接研究发现其功能大部分与脊髓中的星形胶质细胞相似,包括调节外周神经系统的外环境,维持神经元的稳态和功能[12],由于对其研究较少,具体的功能还有待进一步的研究确定。
1.2.3神经元与胶质细胞之间缝隙连接的作用神经元与胶质细胞之间是否存在GJ一直存在争议。Rash等[13]运用免疫细胞化学、电镜等技术发现,在成年大鼠大脑内神经元只与其它神经元存在GJ,与胶质细胞不存在GJ。在体外共同培养神经元与胶质细胞的实验发现胶质细胞内刺激产生的Ca2+波能传递到神经元内,使神经元兴奋,且GJ阻断剂-辛醇可减弱这种信号的传递[14],此研究提示神经元与胶质细胞间存在GJ。在免疫电镜下观察戊四氮点燃大鼠海马组织发现,神经元与星形胶质细胞之间存在Cx43构成的半通道[15],这与刘煜等对实验性自身免疫性脑脊髓炎豚鼠的研究结果一致。但由于实验技术的局限性,这些结果未完全使人信服,神经元与胶质细胞之间是否存在缝隙连接以及其存在的意义,仍有待进一步的研究探明。
2缝隙连接与神经病理痛
2.1神经病理性痛国际疼痛研究协会(IASP)将神经病理性疼痛(neuropathic pain)定义为由躯体感觉系统的损伤或疾病而直接引起的疼痛[16],包括痛性糖尿病神经系统病变、三叉神经痛、坐骨神经痛和脊髓损伤性疼痛等。神经病理痛,简称神经痛,分为外周性和中枢性两种,属于慢性疼痛。神经痛的发病率较高,最近一项流行病学调查显示其发病率在普通人中已经超过8%。神经病理痛患者感到异常疼痛,常伴有睡眠障碍、焦虑、抑郁、精神萎靡、注意力分散、食欲减退,严重影响病人的生活质量。目前,神经病理痛发病的分子机制仍不够清楚,导致多种因素引发的神经病理痛得不到有效的治疗。近几年发现缝隙连接参与神经病理痛,关于这方面的研究仍比较少,从缝隙连接方面来研究神经病理痛的防治,将为神经病理痛的治疗带来一个新的研究方向。
2.2缝隙连接与神经病理痛周围神经损伤可能导致机械和热痛敏,并增强背角神经元的兴奋性。神经损伤后,邻近的神经胶质细胞也可能在脊髓伤害信号的传递中发挥重要作用[17]。胶质细胞间交流的基本机制是通过缝隙连接,允许第二信号(如环磷酸腺苷、三磷酸肌醇)、离子和小亲水性分子(如ATP)在细胞之间自由通过。大量的研究表明,胶质细胞间的缝隙连接可能在神经病理性疼痛中发挥重要作用[18]。缝隙连接在神经病理痛中的作用机制见Fig 1[3]。
神经损伤可以诱发感觉神经元和胶质细胞的异常活动而产生疼痛。损伤后,胶质细胞最明显的变化是胶质细胞间缝隙连接数目增加以及对ATP的敏感性增强。人们普遍认为,活化的神经胶质细胞诱导中枢敏化并释放一些化学物质,如促炎性细胞因子(IL-1β、IL-6、TNF-α)加剧疼痛。ATP作用的P2X受体如小胶质细胞上的P2X7受体的活化是促炎细胞因子释放的必不可少因素[18]。最初认为星形胶质细胞和小胶质细胞的活化是对脊髓损伤(spinal cord injury)所造成伤害的一种神经保护性反应,但激活如果一直持续,激活的神经胶质细胞就会发生继发性损害,诱发神经元和胶质细胞死亡,将神经损伤作用蔓延。在外周损伤区域,继发性损伤与ATP高水平持续释放一致。虽然ATP的来源仍然有争议,但已证明细胞外高水平的ATP能激活小胶质细胞和白细胞上的P2X嘌呤受体,尤其是激活P2X7受体后可促进宿主细胞因子和促炎分子的分泌(如ROS、IL-1β、 IL-6、TNF-α)[19]。这些细胞因子是脊髓中神经细胞的致敏源,有助于形成神经病理性疼痛[20]。此外,用药物阻断和基因缺失方法抑制P2X受体能减轻动物疼痛行为。因此,活化细胞的P2X受体是神经病理性疼痛形成过程中的一个重要环节。早期的研究显示,脊髓损伤后有大量释放的ATP[19]。然而,如Cx43的基因缺失,脊髓损伤后的脊髓星形胶质细胞外ATP的浓度明显降低。由于缝隙连接通道的结构显示它们有外排高浓度的ATP的作用,由此认为缝隙连接通道是ATP释放的重要途径。研究表明嘌呤信号在神经病理性疼痛中发挥重要作用,因此缝隙连接在神经病理性疼痛中的作用需要进一步深入研究。
2.2.1脊髓中缝隙连接与神经病理痛越来越多的研究表明,脊髓中的胶质细胞,特别是星形胶质细胞中的GJ可以在各种病理性疼痛病症(包括神经性疼痛)中发挥重要作用[17,21]。在病理条件下,一些化合物如神经递质、生长因子、肽和细胞因子的异常释放可影响连接蛋白的表达并影响缝隙连接通道的通透性。研究显示,活化的脊髓星形胶质细胞可能有助于维持背角神经元的过度兴奋,导致在组织和神经损伤后痛觉信息在脊髓中的传递加强[20]。脊髓损伤后,星形胶质细胞出现的一个显著特征是高表达Cx43。患者化疗引起的神经病变表现为星形胶质细胞活化增多和Cx43的表达增加。大鼠L5脊髓神经节结扎(spinal nerve ligation,SNL)建立的神经病理痛模型实验显示,给SNL大鼠鞘内注射Cx43蛋白的siRNA后能缓解SNL大鼠的机械性痛觉超敏反应[22]。神经损伤后,Cx43的表达迅速上调,引发通过GJ偶联的细胞内Ca2+大量内流,并释放谷氨酸,从而增强神经的敏感受性,导致神经细胞过度兴奋而死亡。发生在脊髓背角内的这些效应有助于形成神经病理痛。此外, Cx43可密集地分布在参与痛觉传导的脊髓背角胶质细胞内[23]。由于Cx43蛋白是星形胶质细胞间缝隙连接的主要连接蛋白,并能够协调胶质细胞网络的同步活动,损伤后Cx43半通道过度表达和星形胶质细胞间缝隙连接偶合增强,可能影响神经元的活动诱发疼痛。虽然已经明确在神经病理痛条件下脊髓星形胶质细胞中Cx43表达和功能会发生变化,但对于Cx43变化的机制仍不清楚。
2.2.2背根神经节中缝隙连接与神经病理痛哺乳动物的感觉神经节,特别是背根神经节(dorsal root ganglia,DRG)在传递感觉信号的过程中有重要的作用而受到研究者的关注。目前已有较多研究证明,感觉神经受损后导致DRG神经元形态和电活动等发生变化而产生神经病理痛。而DRG中卫星胶质细胞间的GJ参与神经病理痛的发生的研究到最近才受到重视。
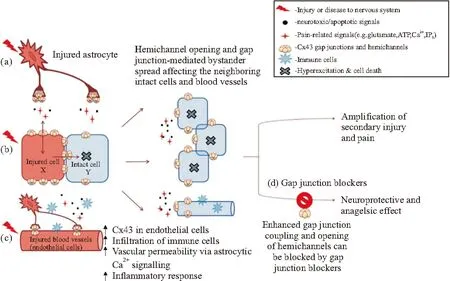
Fig 1 Role of gap junctions in chronic pain following nervous system injury. Injury to the nervous system leads
A: Upregulation of cell-to-cell coupling and of gap junction hemichannels, in particular Cx43 channels, in glial cells (e.g., astrocytes in spinal cord and satellite glial cells in dorsal root ganglion) is commonly seen following nervous system injury and inflammation and can contribute to neuronal cell death, expansion of secondary injury, and pain responses by transmission of metabolic stress and pain-related substances. b: Opening and upregulation of hemichannels following injury may facilitate rapid bidirectional transmission of neurotoxic substances in and out of the injured cells, thereby affecting healthy neighboring cells, whereas direct cell-cell coupling can pass death signals. c: Injury-induced opening and upregulation of endothelial gap junction channels increases vascular permeability and hemorrhage, subsequently facilitating infiltration of immune cells and exacerbation of inflammatory reactions. d: The enhanced gap junction coupling can be modulated via gap junction blockers, which disrupt channel permeability and prevent the spread of secondary injury and amplification of pain. (Color figure can be viewed in the online issue, which is available at wileyonlinelibrary.com.)
Hanani等[4]第一次证明神经损伤可引起外周神经节的一种特殊的胶质细胞-卫星胶质细胞(satellite glia cells,SGCs)间的GJ增多。这种外周神经胶质细胞通过缝隙连接通道高度偶合,大部分SGCs紧密的包绕着感觉神经节神经元的胞体,包绕数量与神经元胞体大小成正比。SGCs通过缝隙连接成对存在,并且表达嘌呤受体。SGCs可以释放细胞因子、ATP和其他化学信使,它与星形胶质细胞有许多共同点,包括调节外周神经元的稳态,从而保证神经元的正常活动[24]。SGCs主要是通过调控缝隙连接、钾离子通道和卫星胶质细胞摄取细胞外谷氨酸的能力来维持神经元外环境稳态的。SGCs与外周神经元的信息交流主要通过兴奋性神经递质谷氨酸和ATP信号通路与嘌呤受体进行的,神经损伤后,这些功能活动紊乱,导致疾病发生[25]。如神经损伤后SGCs上的P2X7受体激活,ATP信号通路开放,进而调节DRG神经元P2X3受体影响痛觉[24]。化疗引起的外周神经病变能引发神经病理痛,Warwick等[26]用奥沙利铂或紫杉醇等抗癌药物注射至大鼠体内建立神经病理痛模型,结果发现,SGC的标志物胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)表达增加,SGCs间的GJ比正常状态增加了2~5倍。 这与在实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)大鼠模型中观察到的结果一致[27]。
有证据表明,在神经系统受损后,GJ的增加参与了胶质细胞活化的部分过程(Fig 1)。GJ的增加实现了DRG中卫星胶质细胞和神经元之间的远距离连接通讯,并影响神经元的兴奋性和相邻的感觉神经元的自发放电。神经受损后使SCGs激活,进而释放炎性细胞因子(IL-1β、IL-6和TNF -α)、一氧化氮和前列腺素等,GFAP表达上调,这与受损后星形胶质细胞的变化类似[28]。初级感觉神经节中神经胶质细胞间传输信号的一种方式是形成细胞间钙波,SGCs和神经元之间这种信号传递是双向的。钙波的传递依赖于偶联的细胞间第二信使(如IP3、ATP)的扩散,而第二信使的扩散需要借助于缝隙连接通道来完成。神经受损后,激发神经元动作电位的改变,诱发神经元释放ATP, ATP激活神经元以及包绕着神经元的SGCs上的嘌呤受体,诱发这些细胞内的Ca2+浓度增加。Ca2+浓度增加诱发SGCs释放更多的ATP[26]。受损后间缝隙连接增加,细胞释放的ATP将能通过缝隙连接通道更多的作用于周围细胞的嘌呤受体,影响Ca2+通道的开放,从而调节细胞内外的Ca2+浓度,造成更强的钙波在神经节间传播,这将导致初级感觉神经节的神经元过度兴奋,而引发疼痛。另一方面,神经受损后,神经元兴奋性增加,导致细胞外钾离子(K+)浓度升高,SGCs间缝隙连接增加是一种神经元的保护措施,可使K+更有效的再分配,起到缓冲作用,不至于激增的K+改变细胞外环境,同时能使有害物质远离神经元[9]。
近年来,已对Cx43表达的变化和疼痛之间的关联进行过较为详细的研究。研究表明,损伤能诱导 Cx43蛋白表达的变化,Cx43介导神经元的敏化作用。研究证明,缺血后Cx43表达受抑制是一种神经保护方式,神经损伤后Cx43表达减少能镇痛。有趣的是,减少非损伤大鼠中Cx43的表达可增加大鼠的疼痛行为[28],出现这种情况可能是正常的缝隙连接功能出现紊乱,使其对细胞内K+的缓冲能力降低,导致神经元过度兴奋而自发放电。因此,沉默Cx43的表达对神经受伤的动物具有镇痛作用,而对于正常动物却能诱发早期疼痛。CX43参与疼痛的机制还需要进一步的研究。
2.3缝隙连接阻断剂与神经病理痛随着缝隙连接在神经病理痛中重要作用的发现,研究人员致力于缝隙连接阻断剂对神经病理疼痛治疗作用的研究。目前,用于此研究的胶质细胞间的GJ阻断剂主要有甘珀酸(carbenoxolone,CBX)、甲氯灭酸(meclofenamic acid,MFA)和棕榈油酸(palmitoleic acid,PA)等。在内脏痛模型中,注射上述3种药物后,能阻滞SGCs和神经元间由于损伤而诱发的病理变化,并可明显地缓解疼痛[20]。缝隙连接阻断剂中研究最多的是CBX(18-甘草次酸的衍生物),它能消除SGC和神经元之间由于损伤而引起的缝隙连接偶合,减弱由损伤引起的周围炎性疼痛行为,在持续性疼痛的各种动物模型中产生镇痛作用[20]。在SNL模型建模成功2~3周后鞘内注射CBX可减弱SNL大鼠的热痛敏反应。电生理方法研究显示,与鞘内药物相似,SNL大鼠脊髓局部注射CBX也能减弱神经元对机械刺激和反复性皮内电刺激的反应。故SNL模型大鼠鞘内注射CBX对神经病理性疼痛的抑制作用可能涉及缝隙连接通道的抑制,进而减弱背角神经元的电活动[22]。同样,眶下神经部分切断诱发疼痛和中枢敏化的疼痛模型中,鞘内注射CBX能影响神经切断引起的机械激活阈值,改变延髓背角中枢敏感参数,这些结果表明,缝隙连接可能与口面部神经性疼痛机制有关[23]。在对化疗引起神经病理痛的小鼠注射CBX后,几乎完全阻断SGCs间的缝隙连接通道,结果观察到染色的42个SGCs间的缝隙连接通道中只有一个偶合。同时,注射CBX后能提高化疗处理小鼠的疼痛阈值,与注射棕榈油酸产生同样的镇痛作用。因此,缝隙连接阻滞剂对化疗引起的神经病理性疼痛具有治疗作用[26]。
CBX是Cx43缝隙连接和半通道的有效阻断剂,它可结合缝隙连接通道,并诱导其构象发生变化以关闭通道[18]。研究表明,CBX还可以阻止其他通道,如脊髓星形胶质细胞中与P2X7受体相关的pan-1通道[29]。此外,新近的研究显示,CBX可以调节突触传递和神经元膜的通透性,并增加神经元中活性氧的形成,通过调节阴离子通道控制星形胶质细胞的体积,抑制小胶质细胞中IL-23的表达[30]。CBX影响疼痛的一种机制可能是通过抑制半通道,进而抑制神经胶质介质(如促炎性细胞因子,ATP和谷氨酸盐)的释放产生镇痛作用(Fig 1)。尽管CBX有上述的作用,但由于注射的阻断剂分布至全身,很难确定它们精确的作用位置,对此尚待进一步的研究确定。
3结语
综上所述,胶质细胞缝隙连接参与了神经损伤后引起的神经病理痛过程。越来越多的研究表明,阻断背根神经节和脊髓的缝隙连接通讯和半通道开发有助于缓解神经病理疼痛。但目前对缝隙连接在痛觉调制中的作用机制尚未完全清楚,这需要我们对缝隙连接蛋白的调控和功能做更深入的研究,损伤后缝隙连接蛋白在背根神经节和脊髓表达增加,缝隙连接阻断剂可阻断缝隙连接蛋白对持续性疼痛产生抑制作用。因此,探寻缝隙连接的新阻断剂有助于开发治疗神经病理痛的新药物。
参考文献:
[1]Eugenin E A, Basilio D, Saez J C, et al. The role of gap junction channels during physiologic and pathologic conditions of the human central nervous system[J].JNeuroimmunePharmacol, 2012, 7(3): 499-518.
[2]Cui Y, Masaki K, Yamasaki R, et al. Extensive dysregulations of oligodendrocytic and astrocytic connexins are associated with disease progression in an amyotrophic lateral sclerosis mouse model[J].JNeuroinflammation, 2014, 11: 42.
[3]Wu A, Green C R, Rupenthal I D, et al. Role of gap junctions in chronic pain[J].JNeurosciRes, 2012, 90(2): 337-45.
[4]Hanani M, Huang T Y, Cherkas P S, et al. Glial cell plasticity in sensory ganglia induced by nerve damage[J].Neuroscience, 2002, 114(2): 279-83.
[5]Park W M, Wang Y, Park S, et al. Interplay of chemical neurotransmitters regulates developmental increase in electrical synapses[J].JNeurosci, 2011, 31(16): 5909-20.
[6]Belousov A B. The regulation and role of neuronal gap junctions during neuronal injury[J].Channels(Austin), 2012, 6(5): 390-2.
[7]Allen K, Fuchs E C, Jaschonek H, et al. Gap junctions between interneurons are required for normal spatial coding in the hippocampus and short-term spatial memory[J].JNeurosci, 2011, 31(17): 6542-52.
[8]Hartfield E M, Rinaldi F, Glover C P, et al. Connexin 36 expression regulates neuronal differentiation from neural progenitor cells[J].PLoSOne, 2011, 6(3): e14746.
[9]Hibino H, Inanobe A, Furutani K, et al. Inwardly rectifying potassium channels: their structure, function, and physiological roles[J].PhysiolRev, 2010, 90(1): 291-366.
[10]Wu X F, Liu W T, Liu Y P, et al. Reopening of ATP-sensitive potassium channels reduces neuropathic pain and regulates astroglial gap junctions in the rat spinal cord[J].Pain, 2011, 152(11): 2605-15.
[11]Nedergaard M, Rodriguez J J, Verkhratsky A. Glial calcium and diseases of the nervous system[J].CellCalcium, 2010, 47(2):140-9.
[12]Jasmin L, Vit J P, Bhargava A, et al. Can satellite glial cells be therapeutic targets for pain control[J].NeuronGliaBiol, 2010, 6(1): 63-71.
[13]Rash J E, Yasumura T, Dudek F E, et al. Cell-specific expression of connexins and evidence of restricted gap junctional coupling between glial cells and between neurons[J].JNeurosci, 2001, 21(6):1983-2000.
[14]Nedergaard M. Direct signaling from astrocytes to neurons in cultures of mammalian brain cells[J].Science, 1994, 263(5154): 1768-71.
[15]兰莉, 兰怡, 段丽,等.戊四氮致(癎)大鼠海马神经元与星形胶质细胞间关系的超微结构观察[J].中华实用儿科临床杂志, 2013, 28(5): 373-6.
[15]Lan L,Lan Y,Duan L, et al. Observation of ultrastructure of morphological relationship between neurons and astrocytes in hippocampi of pentylenetetrazol-kindled epileptic rats[J].ChinJApplClinPediatr,2013, 28(5): 373-6.
[16]Jensen T S, Baron R, Haanpaa M, et al. A new definition of neuropathic pain[J].Pain, 2011, 152(10):2204-5.
[17]Ji R R, Berta T, Nedergaard M. Glia and pain: is chronic pain a gliopathy[J].Pain, 2013, 154 (Suppl 1): S10-28.
[18]Yoon S Y, Robinson C R, Zhang H, et al. Spinal astrocyte gap junctions contribute to oxaliplatin-induced mechanical hypersensitivity[J].JPain, 2013, 14(2):205-14.
[19]Peng W, Cotrina M L, Han X, et al. Systemic administration of an antagonist of the ATP-sensitive receptor P2X7improves recovery after spinal cord injury[J].ProcNatlAcadSciUSA, 2009, 106(30):12489-93.
[20]Roh D H, Yoon S Y, Seo H S, et al. Intrathecal injection of carbenoxolone, a gap junction decoupler, attenuates the induction of below-level neuropathic pain after spinal cord injury in rats[J].ExpNeurol, 2010, 224(1):123-32.
[21]Ji X T, Qian N S, Zhang T, et al. Spinal astrocytic activation contributes to mechanical allodynia in a rat chemotherapy-induced neuropathic pain model[J].PLoSOne, 2013, 8(4): e60733.
[22]Xu Q, Cheong Y K, Yang F, et al. Intrathecal carbenoxolone inhibits neuropathic pain and spinal wide-dynamic range neuronal activity in rats after an L5 spinal nerve injury[J].NeurosciLett, 2014, 563: 45-50.
[23]Wang H, Cao Y, Chiang C Y, et al. The gap junction blocker carbenoxolone attenuates nociceptive behavior and medullary dorsal horn central sensitization induced by partial infraorbital nerve transection in rats[J].Pain, 2014, 155(2): 429-35.
[24]彭海英,梁尚栋.外周神经节卫星胶质细胞的研究进展[J].神经解剖学杂志, 2012, 28(6): 631-5.
[24]Peng H Y, Liang S D. Research progress on satellite glia cells in peripheral ganglia[J].ChinJNeuroanatomy, 2012, 28(6):631-5.
[25]焦晓翠,张会然,张璇,等.卫星胶质细胞对外周神经元作用的研究进展[J].中国药理学通报, 2014,30(5):612-4.
[25]Jiao X C, Zhang H R, Zhang X, et al. Research progress in interactions between neuron and satellite glial cell[J].ChinPharmacolBull, 2014,30(5): 612-4.
[26]Warwick R A, Hanani M. The contribution of satellite glial cells to chemotherapy-induced neuropathic pain[J].EurJPain, 2013, 17(4): 571-80.
[27]Warwick R A, Ledgerwood C J, Brenner T, et al. Satellite glial cells in dorsal root ganglia are activated in experimental autoimmune encephalomyelitis[J].NeurosciLett, 2014, 569: 59-62.
[28]Jasmin L, Vit J P, Bhargava A, et al. Can satellite glial cells be therapeutic targets for pain control[J]?NeuronGliaBiol, 2010, 6(1): 63-71.
[29]Shoji K F, Saez PJ, Harcha P, et al. Pannexin1 channels act downstream of P2X receptors in ATP-induced murine T-cell death[J].Channels(Austin), 2014, 8(2):142-56.
[30]Endong L, Shijie J, Sonobe Y, et al. The gap-junction inhibitor carbenoxolone suppresses the differentiation of Th17 cells through inhibition of IL-23 expression in antigen presenting cells[J].JNeuroimmunol, 2011, 240-1: 58-64.
网络出版时间:2015-1-9 13:37网络出版地址:http://www.cnki.net/kcms/doi/10.3969/j.issn.1001-1978.2015.02.003.html
Recent research progress on the role of gap junction in neuropathic pain
PENG Li-chao,LIANG Shang-dong
(DeptofPhysiology,BasicMedicalCollegeofNanchangUniversity,Nanchang330006,China)
Abstract:Gap junctions are specialized transmembrane channels that enable the direct exchange of materials and transfer chemical or electrical signaling between adjacent cells, thus maintaining cellular homeostasis. In the nervous system, gap junction channels not only mediate intercellular coupling between neurons and between glial cells, but also can be involved in secondary damage under pathological conditions. Recently, some studies have shown that gap junctions play an important role in neuropathic pain caused by nervous system damage. Research on the role of gap junctions in neuropathic pain can contribute to a deeper understanding of the pathogenesis of neuropathic pain, providing a new research direction for the treatment of neuropathic pain.
Key words:gap junction; connexin; nervous system; glial cells; neuropathic pain; gap junction blocker
作者简介:彭力超(1990-),女,硕士生,研究方向:神经生理学与病理生理学, E-mail: 836615177@qq.com;
基金项目:国家自然科学基金资助项目(No 81171184, 31060139, 30860086);第二批江西省“赣鄱英才555工程”领军人才项目;江西省自然科学基金资助项目(No 20142BAB205028);江西省教育厅科技项目(No GJJ13155)
收稿日期:2014-10-27,修回日期:2014-11-25
文献标志码:A
文章编号:1001-1978(2015)02-0157-06
doi:10.3969/j.issn.1001-1978.2015.02.003
