血小板介导肿瘤血行转移的作用及其机制研究进展
2016-01-12曹玉珠刘兆国单云龙孙丽华刘玉萍韦忠红祝娉婷吴红雁王爱云陈文星郑仕中
曹玉珠,刘兆国,单云龙,孙丽华,刘玉萍,韦忠红,祝娉婷,吴红雁,王爱云,陈文星,郑仕中,2,陆 茵,2
(1.南京中医药大学药学院,江苏 南京 210023;2.江苏省中药药效与安全性评价重点实验室,江苏 南京 210023)
血小板介导肿瘤血行转移的作用及其机制研究进展
曹玉珠1,刘兆国1,单云龙1,孙丽华1,刘玉萍1,韦忠红1,祝娉婷1,吴红雁1,王爱云1,陈文星1,郑仕中1,2,陆茵1,2
(1.南京中医药大学药学院,江苏 南京210023;2.江苏省中药药效与安全性评价重点实验室,江苏 南京210023)
中国图书分类号:R-05;R331.124;R331.3;R73-37;R730.2
摘要:肿瘤转移是恶性肿瘤最为重要的生物学特性之一,同时也是影响预后及导致治疗失败的主要因素。临床研究显示,恶性肿瘤患者的血小板数目较正常人及良性肿瘤患者明显升高,表明血小板可能参与了肿瘤的发生发展过程。进一步研究发现,血小板在肿瘤血行转移的过程中能够与肿瘤细胞相互作用形成瘤栓,逃避免疫监视,进而促进了肿瘤的转移。近年来,临床上已经开展了针对血小板治疗肿瘤转移的研究,同时,血小板促进肿瘤转移的相关作用机制也逐步地被揭示。该文对近年来血小板介导肿瘤血行转移的作用及其作用机制研究进展进行综述,探讨临床针对血小板治疗肿瘤转移的策略,为后续的科学研究及指导临床提供参考。
关键词:血小板;瘤栓;肿瘤血行转移;分子机制;治疗策略;临床应用
陆茵(1963-),女,博士,教授,博士生导师,研究方向:活血化瘀中药及其复方抗肿瘤血管生成及对肿瘤转移、肿瘤微环境的影响,通讯作者,Tel:025-85811239, E-mail:luyingreen@126.com
近年来,大量研究表明,血小板在肿瘤血行转移过程中能够与肿瘤细胞相互作用形成瘤栓,进而在肿瘤细胞转移和远端种植过程中发挥关键作用[1-2]。与此同时,临床研究发现,恶性肿瘤患者常伴有血小板升高和聚集现象,且这种现象在晚期肿瘤患者中更为明显[3],降低血小板的数目或抑制血小板的功能均可以明显抑制肿瘤细胞的转移[4]。目前,抑制血小板与肿瘤细胞的相互作用,从而抑制肿瘤转移已经成为近年来抗肿瘤研究的热点。本文对近年来血小板介导肿瘤血行转移及瘤栓形成中的作用研究进展进行综述,重点对其介导调控肿瘤血行转移的作用机制进行概述,并探讨针对血小板治疗肿瘤转移的策略,为后续的科学研究及指导临床提供重要参考。
1血小板在肿瘤血行转移中的作用
正常生理状态下,血小板可以被ADP、血栓烷A2和凝血酶等激活,生物体借助血小板主要发挥修复损伤组织和凝血的作用,包括:(1)参与止血过程[5];(2)促进凝血过程[6];(3)维持毛细血管壁的完整性[7]。血小板被认为是维持内皮细胞的完整性以及免疫细胞转运的调节器,通过释放脑源性神经营养因子(BDNF)、表皮生长因子(EGF)、一磷酸鞘氨醇(S1P)、血管生成素1(ANGPT1)以及血小板活化因子(PAF)等来保持与内皮细胞之间的联系,从而维持血管的稳定[8-9]。已有研究表明,肿瘤细胞能够激活血小板,同时可以诱导血小板分泌多种物质[10-11],这些物质参与肿瘤的发生和发展,并在肿瘤血行转移过程中发挥着关键性的作用。
肿瘤血行转移是肿瘤细胞从原发病灶脱落并随血液循环转移到远端靶器官,逐渐形成转移灶的过程,血小板调控肿瘤血行转移主要包括以下几个方面(图1):(1)血小板通过黏附于肿瘤细胞表面,帮助肿瘤细胞逃避NK细胞的识别,使其逃避免疫监视,从而提高肿瘤细胞在循环系统中的存活率;(2)血小板能够促进肿瘤细胞的外溢过程:血小板能够介导肿瘤细胞与内皮细胞或者白细胞间的黏附,促进肿瘤细胞的外溢,从而易于发生转移;(3)血小板与肿瘤血管生成密切相关:一旦肿瘤细胞外溢出了血管,激活的血小板通过释放多种促血管生成因子,诱导肿瘤血管生成,促进肿瘤细胞在转移灶的生长,维持肿瘤新生血管的完整性。Wang等[12]通过对125例胰腺导管腺癌患者血小板水平与患者预后及整体生存率进行分析发现,较高水平的血小板能够加快肿瘤的发展,并明显促进肿瘤细胞发生远距离转移。Wang等[13]在小鼠肿瘤转移模型中,采用血小板活化抑制剂或使循环血小板缺失后,发现循环肿瘤细胞的转移潜能明显降低。
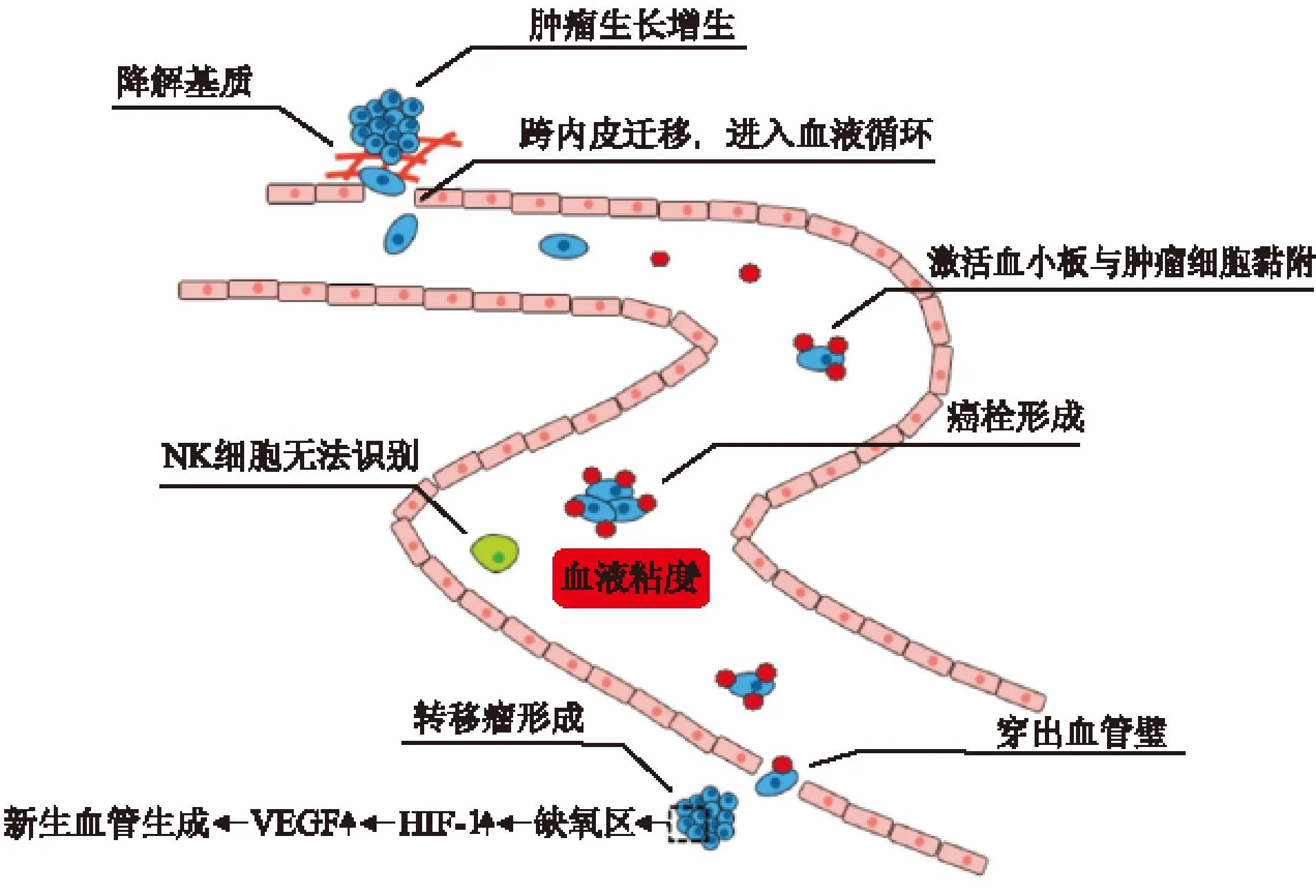
图1血小板介导肿瘤血行转移
1.1血小板介导的瘤栓形成在肿瘤血行转移中的重要作用进入血液的肿瘤细胞能够激活血小板,在黏附分子的介导下,血小板和肿瘤细胞两者相互结合,进而形成瘤栓。瘤栓的形成可以降低肿瘤细胞的免疫原性,逃逸宿主免疫系统的监控[14],从而有助于肿瘤细胞发生血行转移。进一步研究表明,血小板介导肿瘤瘤栓的形成可能与以下因素有关:(1)肿瘤细胞可通过血小板增强黏附于血管内皮细胞的能力[15];(2)正常血液流动的机械力量,可杀死进入循环系统的肿瘤细胞,只有通过血小板介导形成瘤栓,肿瘤细胞才能免受血液湍流的攻击;(3)血小板的聚集可导致内皮细胞收缩,有利于肿瘤细胞移行出血管[16];血小板颗粒的持续分泌可防止炎症诱导的血管损伤,进而防止肿瘤内出血的发生[17];(4)血小板自身分泌的一些生长因子可促进肿瘤细胞的生长和转移[18]。如整合素GPⅠb/Ⅸ/V和血小板糖蛋白VI(GPVI)是调节血小板最初黏附的受体,GPⅠb/Ⅸ/V复合物通过血管性假性血友病因子(vWF)介导参与血小板在高剪切力下与胶原的黏附过程,形成血栓,进而转变为稳定的血小板黏附。这个过程是通过血小板整合素和GPVI与胶原之间相互作用。临床研究表明,血小板计数在不同癌症的发展过程中都可能用于临床预测肿瘤进展情况,血小板增多的症状在结肠癌、乳腺癌、肺癌、胃癌、肾癌、宫颈癌、胰腺癌、子宫内膜癌、脑瘤和卵巢癌等患者中均会出现预后差的现象[9,19]。
1.2血小板介导肿瘤血管生成在肿瘤血行转移中的重要作用正常成人机体中促血管生成因子与抑血管生成因子相互平衡,血小板未被异常激活状态下无血管新生,而在乳腺癌、肺癌、胃癌等多种癌症中均存在血小板被异常激活的现象。Folkman最早提出肿瘤内的血管生成可能作为肿瘤发展的一个必要条件,用以防止缺氧诱导的肿瘤生长停滞和坏死[20]。研究还发现,血小板激活后释放血管内皮生长因子(VEGF),这是第一次证明了血小板促进肿瘤的血管生成[21]。最近的研究显示,血小板具有防止肿瘤内出血的功能,表明血小板的止血功能很可能是肿瘤血管完整性的维持的关键因素[17]。同时,肿瘤内的血管是肿瘤细胞转移的通道,血小板在肿瘤发展过程中可以促进肿瘤血管生长,从而促进肿瘤细胞血行转移的进程。肿瘤的生长和转移需要建立自己的供血系统,为其提供营养和氧气。血小板中含有很多因子,在血小板活化过程中,释放这些因子用以调节血管生成过程。主要有VEGF、血小板源性生长因子(PDGF)、EGF、碱性成纤维细胞生长因子(bFGF,也称为FGF2)、缺氧诱导因子1(HIF-1)、血管生成素1(ANGPT1,又称ANG1)、S1P、血清素、血小板反应蛋白-1(THBS1),以及一些细胞功能因子如白细胞介素-1β(IL-1β)和IL-8,或蛋白酶如基质金属蛋白酶2(MMP2)和基质金属蛋白酶9(MMP9)[22]等促血管生成因子;凝血酶敏感素1、血小板因子4(PF4)等抑血管生成因子,以及具有双向调节肿瘤血管生成作用的TGF-β等[23],它们共同调节肿瘤的血管生成。
2血小板介导肿瘤转移的分子机制
通过文献调研并结合最新研究,我们发现以下三者在血小板介导的肿瘤血行转移过程中发挥重要作用,具体机制如下。
2.1PTEN/MAPK 信号介导血小板调控肿瘤转移 PTEN作为第一个被发现的具有双重特异性磷酸酶活性的肿瘤抑制基因,不仅有脂质磷酸酶活性,还具有蛋白磷酸酶活性,可负性调控PI3K/AKT信号通路、FAK途径以及MAPK途径来调节细胞的增殖、分化、凋亡以及黏附、迁移等。
Kim等采用PAF诱导的实验性肺转移模型,发现携带抑癌基因PTEN cDNA的腺病毒能够逆转PAF诱导的AKT磷酸化的增加,逆转黑色素瘤B16F10的肺转移;另外使用MAPK抑制剂作用后,也可明显抑制PAF诱导的肺转移[24]。最新研究发现,血小板能够促进MAPK磷酸化,在Caco-2和HT29细胞中均能上调MMP-9的表达,而抑制MAPK磷酸化又会明显下调MMP-9表达,并降低肿瘤细胞侵袭能力[25]。表明PTEN/MAPK在PAF诱导肿瘤转移的过程中发挥关键性的作用。
2.2P2Y12受体介导血小板调控肿瘤转移P2Y12受体是血小板表面主要的ADP受体,是血小板活化的重要信号放大因子,其拮抗剂如氯吡格雷(clopidogrel)和普拉格雷(prasugrel)等在临床上被广泛应用于心肌梗死和急性冠脉综合征。大量研究表明,抑制P2Y12可以抑制肿瘤转移,这提示P2Y12可能在肿瘤发生发展中起到重要作用。研究发现,采用小鼠自发性转移模型考察血小板ADP受体P2Y12在Lewis肺癌转移中的作用,证实P2Y12缺失能够明显减少肿瘤细胞的肺转移,同时,P2Y12缺失能够降低Lewis肺癌细胞诱导血小板发生形变的能力以及减少活化型TGF-β1的释放;此外,在小鼠B16黑色素瘤实验性转移模型中,血小板P2Y12的缺失同样能明显减少肿瘤细胞的肺转移[13]。P2Y12受体拮抗剂能够通过阻止ADP介导的下游信号通路(如凝血酶和胶原)的激活抑制血小板病理性聚集,破坏新形成的血小板聚集物的稳定,促进其分解,进而逆转血栓性的血管闭塞[26]。
2.3缺氧诱导因子1(HIF-1)介导血小板调控肿瘤转移缺氧是肿瘤微环境最显著的特点,也是决定肿瘤恶性程度的关键因素。在缺氧调节的信号转导途径中,HIF-1起中枢纽带作用。研究发现,HIF-1具有多种细胞生物学效应,包括调控肿瘤细胞的增殖、凋亡及血管生成等过程,在肿瘤的发生发展以及转移的过程中发挥重要作用,并且在前列腺癌、肺癌、乳腺癌、宫颈癌、食管癌、结直肠癌、脑部肿瘤如神经胶质瘤等诸多实体瘤中都呈高表达[27]。HIF-1不仅能够通过激活葡萄糖转运体基因和糖酵解酶基因的转录促进肿瘤的发展[28],另一方面,HIF-1介导的VEGF的释放也能够明显促进血管形成[29-30]。Zhang等[31]通过RNA干扰技术或者给予地高辛来抑制乳腺癌中HIF-1活性,发现抑制HIF-1活性可以抑制肿瘤生长以及肺转移。
3临床针对血小板治疗肿瘤转移的现状、策略及应用前景
3.1目前临床针对血小板治疗肿瘤转移的现状及存在的问题基于血小板在肿瘤转移中的重要作用,目前,国内外已经对针对血小板进行肿瘤转移的治疗开展了广泛的研究。通常抑制和干扰血小板的功能,进而实现抑制肿瘤转移主要可以从以下几个环节入手:(1)抑制血小板的激活和聚集:凝血酶是重要的血小板激活因子,因此,通过抑制凝血酶的作用,理论上即可实现抑制肿瘤转移的目的。研究发现,水蛭素对凝血酶有极强的抑制作用,相关研究也表明,水蛭素能够明显地抑制肿瘤的转移[21];(2) 抑制P-选择素:如抗凝剂肝素能够抑制P-选择素的功能,同样可以抑制肿瘤的转移[32];(3) 抑制血小板激活过程中相关酶的活性;研究发现,花生四烯酸在脂氧合酶或环氧合酶(COX)的作用下可生成前列腺素,已有研究表明前列腺素能够促进血小板聚集和脱颗粒,因此,应用脂氧合酶拮抗剂或COX抑制剂可以抑制血小板的功能,进而抑制肿瘤细胞的转移[33]。Mitrugno等[11]对大量的临床数据进行Meta分析发现,每天低剂量使用血栓素抑制剂阿司匹林,在降低肿瘤发病率的同时,也能够抑制肿瘤的生长和转移。
3.2基于现有研究指导临床针对血小板治疗肿瘤转移的策略及应用前景鉴于最新的机制研究结果,我们认为临床针对血小板进行肿瘤转移治疗的策略可以分为3种:(1) 针对PTEN/MAPK信号,研发PTEN的特异性抑制剂,并联合应用MAPK抑制剂,从而达到抑制肿瘤转移的目的;(2) 靶向P2Y12受体,应用特异性的受体阻断剂或拮抗剂,通过调控血小板的功能,进而实现抑制肿瘤转移的目的。基于现有关于P2Y12受体在临床前的研究结果,我们认为靶向P2Y12受体治疗肿瘤的转移,应用前景广阔;(3) 以HIF-1为靶点,应用HIF-1的抑制剂或PDGF-B的阻断剂,扰乱HIF-1与PDGF-B的结合,以此达到抑制肿瘤转移的目的。
4小结
近年来,肿瘤给人类的健康带来了巨大威胁[34],而肿瘤转移更是成为导致治疗失败及预后较差的主要因素。研究发现,在诸多调控肿瘤转移的因子中,血小板发挥了关键性的作用,其不仅可以保护肿瘤细胞逃避免疫系统杀伤,同时也调控了肿瘤发生发展及转移的多个环节。随着对血小板介导肿瘤转移研究的不断深入,其作用机制也不断被发现。当然,目前对血小板在肿瘤转移中的研究尚不全面,很多实验只是在临床前阶段,尚未真正地开展临床研究,而且其准确的作用机制仍有待进一步的实验予以阐明。但目前对血小板在肿瘤转移中的作用机制研究,丰富了人们对肿瘤侵袭转移的认识,也为临床肿瘤转移机制提供了新的理论依据和潜在的药物靶点,相信在不久的将来,临床针对血小板治疗肿瘤转移会取得很大进展。综上所述,笔者认为,临床针对血小板治疗肿瘤转移有望成为新一类的抗肿瘤转移靶点,并具有广阔的应用前景。
参考文献:
[1]Erpenbeck L, Schön M P. Deadly allies: the fatal interplay between platelets and metastasizing cancer cells[J].Blood, 2010, 115(17):3427-36.
[2]Schumacher D, Strilic B, Sivaraj K K, et al. Platelet-derived nucleotides promote tumor-cell transendothelial migration and metastasis via P2Y2 receptor[J].CancerCell, 2013, 24(1):130-7.
[3]Simanek R, Vormittag R, Ay C, et al. High platelet count associated with venous thromboembolism in cancer patients: results from the Vienna Cancer and Thrombosis Study (CATS)[J].JThrombHaemost, 2010, 8(1):114-20.
[4]Labelle M, Begum S, Hynes R O. Direct signaling between platelets and cancer cells induces an epithelial-mesenchymal-like transition and promotes metastasis[J].CancerCell, 2011, 20(5):576-90.
[5]Ware J, Corken A, Khetpal R. Platelet function beyond hemostasis and thrombosis [J].CurrOpinHematol, 2013, 20(5):451-6.
[6]Heemskerk J W, Mattheij N J, Cosemans J M. Platelet-based coagulation: different populations, different functions[J].JThrombHaemost, 2013, 11(1):2-16.
[7]Roh J W, Huang J, Hu W, et al. Biologic effects of platelet-derived growth factor receptor α blockade in uterine cancer[J].ClinCancerRes, 2014, 20(10):2740-50.
[8]Huang H S, Chang H H. Platelets in inflammation and immune modulations: functions beyond hemostasis[J].ArchImmunolTherExp(Warsz), 2012, 60(6):443-51.
[9]Ozaki Y, Suzuki-Inoue K, Inoue O. Platelet receptors activated viamulitmerization: glycoprotein VI, GPIb-IX-V, and CLEC-2[J].JThrombHaemost, 2013, 11 Suppl 1:330-9.
[10]Takagi S, Sato S, Oh-hara T, et al. Platelets promote tumor growth and metastasis via direct interaction between Aggrus/podoplanin and CLEC-2. [J].PLoSOne, 2013, 8(8): e73609.
[11]Mitrugno A, Williams D, Kerrigan S W, et al. A novel and essential role for FcγRIIa in cancer cell-induced platelet activation[J].Blood, 2014, 123 (2): 249-60.
[12]Wang H, Gao J, Bai M, et al. The pretreatment platelet and plasma fibrinogen level correlate with tumor progression and metastasis in patients with pancreatic cancer[J].Platelets, 2014, 25(5):382-7.
[13]Wang Y, Sun Y, Li D, et al. Platelet P2Y12 is involved in murine pulmonary metastasis[J].PLoSOne, 2013, 8(11):e80780.
[14]Tsuruo T, Fujita N. Platelet aggregation in the formation of tumor metastasis[J].ProcJpnAcadSerBPhysBiolSci, 2008, 84(6):189-98.
[15]Zhang N, Zhang W J, Cai H Q, et al. Platelet adhesion and fusion to endothelial cell facilitate the metastasis of tumor cell in hypoxia-reoxygenation condition[J].ClinExpMetastasis, 2011, 28(1):1-12.
[16]Cohen S A, Trikha M, Mascelli M A. Potential future clinical applications for the GPIIb/IIIa antagonist, abciximab in thrombosis, vascular and oncological indications [J].PatholOncolRes, 2000, 6(3):163-74.
[17]Ho-Tin-Noé B, Goerge T, Cifuni S M, et al. Platelet granule secretion continuously prevents intratumor hemorrhage[J].CancerRes, 2008, 68(16):6851-8.
[18]Appelmann I, Liersch R, Kessler T, et al. Angiogenesis inhibition in cancer therapy: platelet-derived growth factor (PDGF) and vascular endothelial growth factor (VEGF) and their receptors: biological functions and role in malignancy[J].RecentResultsCancerRes, 2010, 180:51-81.
[19]Kaushansky K. Historical review: megakaryopoiesis and thrombopoiesis[J].Blood, 2008, 111(3): 981-6.
[20]Schito L, Rey S, Tafani M, et al. Hypoxia-inducible factor 1-dependent expression of platelet-derived growth factor B promotes lymphatic metastasis of hypoxic breast cancer cells[J].ProcNatlAcadSciUSA, 2012, 109(40):E2707-16.
[21]Guo R R, Liu Y, Lu W L, et al. A recombinant peptide, hirudin, potentiates the inhibitory effects of stealthy liposomal vinblastine on the growth and metastasis of melanoma[J].BiolPharmBull, 2008, 31(4):696-702.
[22]Coppinger J A, Cagney G, Toomey S, et al. Characterization of the proteins released from activated platelets leads to localization of novel platelet proteins in human atherosclerotic lesions[J].Blood, 2004, 103(6): 2096-104.
[22]韦忠红,汪思亮,盛晓波,等.出芽式肿瘤血管生成的分子调控机制[J].中国药理学通报,2013,29(9):1196-200.
[23]Wei Z H, Wang S L, Sheng X B, et al. Molecule regulation mechanism of tumor sprouting angiogenesis[J].ChinPharmacolBull, 2013, 29(9): 1196-200.
[24]Möhle R, Green D, Moore M A, et al. Constitutive production and thrombin-induced release of vascular endothelial growth factor by human megakaryocytes and platelets[J].ProceedNatAcadSci, 1997, 94(2): 663-8.
[25]Radziwon-Balicka A, Santos-Martinez M J, Corbalan J J, et al. Mechanisms of platelet-stimulated colon cancer invasion: role of clusterin and thrombospondin 1 in regulation of the P38MAPK-MMP-9 pathways[J].Carcinogenesis, 2014, 35(2):324-32.
[26]Speich H E, Bhal V, Houser K H, et al. Signaling via P2Y12 may be critical for early stabilization of platelet aggregates[J].JCardiovascPharmacol, 2014, 63(6): 520-7.
[27]Semenza G L. HIF-1 mediates metabolic responses to intratumoral hypoxia and oncogenic mutations[J].JClinInvest, 2013, 123(9): 3664-71.
[28]Semenza G L. HIF-1: upstream and downstream of cancer metabolism[J].CurrOpinGenetDev, 2010, 20(1): 51-6.
[30]Shen K, Ji L, Gong C, et al. Notoginsenoside Ft1 promotes angiogenesis via HIF-1α mediated VEGF secretion and the regulation of PI3K/AKT and Raf/MEK/ERK signaling pathways[J].BiochemPharmacol, 2012, 84(6): 784-92.
[30]Ahn G O, Seita J, Hong B J, et al. Transcriptional activation of hypoxia-inducible factor-1 (HIF-1) in myeloid cells promotes angiogenesis through VEGF and S100A8[J].ProcNatlAcadSciUSA, 2014, 111(7):2698-703.
[31]Zhang H, Wong C C, Wei H, et al. HIF-1-dependent expression of angiopoietin-like 4 and L1CAM mediates vascular metastasis of hypoxic breast cancer cells to the lungs[J].Oncogene, 2012, 31(14): 1757-70.
[32]Borsig L. Antimetastatic activities of modified heparins: selectin inhibition by heparin attenuates metastasis[J].SeminThrombHemost, 2007, 33(5):540-6.
[33]Ferrández A, Piazuelo E, Castells A. Aspirin and the prevention of colorectal cancer[J].BestPractResClinGastroenterol, 2012, 26(2):185-95.
[34]刘兆国,范方田,韦忠红,等.BRAF突变的黑色素瘤耐药机制研究进展[J]. 中国药理学通报,2013,29(10):1349-51.
[34]Liu Z G, Fan F T, Wei Z H, et al. Research progress of the mechanisms for drug resistance in melanoma with BRAF-mutation[J].ChinPharmacolBull, 2013, 29(10):1349-51.
Research progress on the role of platelet in mediating tumor metastasis
网络出版时间:2015-1-9 13:37网络出版地址:http://www.cnki.net/kcms/doi/10.3969/j.issn.1001-1978.2015.02.005.html
by hematogenous spread and its mechanisms
CAO Yu-zhu1, LIU Zhao-guo1, SHAN Yun-long1, SUN Li-hua1, LIU Yu-ping1, WEI Zhong-hong1,
ZHU Pin-ting1, WU Hong-yan1, WANG Ai-yun1, CHEN Wen-xing1,ZHENG Shi-zhong1,2, LU Yin1,2
(1.CollegeofPharmacy,NanjingUniversityofChineseMedicine,Nanjing210023,China;
2.JiangsuKeyLaboratoryforPharmacologyandSafetyEvaluationofChineseMateriaMedicine,Nanjing210023,China)
Abstract:Tumor metastasis is one of the most important biological characteristics of malignant tumor, and it is also the main factors that cause treatment failure and poor prognosis. Clinical studies have shown that the number of platelets in patients with malignant tumor increased more significantly than that in benign tumor patients and healthy people, which indicate that platelet might be involved in the development process of tumor. Further study found that in the process of cancer spreading to blood, platelet could interact with tumor cells to form tumor emboli, helped tumor cells escape from immune surveillance, thus promoted the tumor metastasis. In recent years, related mechanisms on platelets in promoting tumor metastasis were revealed gradually, and several targeted therapies based on platelets were also carried out. This paper reviews the role of platelet in mediating tumor metastasis by hematogenous spread and its mechanisms and discusses the therapy strategies that target platelet, which may provide references for follow-up research and clinical treatment.
Key words:platelet; tumor embolus; tumor hematogenous spread; molecular mechanisms; therapy strategies; clinical application
作者简介:曹玉珠(1989-),女,硕士生,研究方向:肿瘤药物治疗及其机制,E-mail:576438252@qq.com;
基金项目:国家自然科学基金资助项目(No 81173174,81202655);教育部博士点基金资助项目(No 20113237110008);江苏省普通高校研究生科研创新计划项目(No KYLX0972, KYZZ0270)
收稿日期:2014-11-03,修回日期:2014-12-10
文献标志码:A
文章编号:1001-1978(2015)02-0166-04
doi:10.3969/j.issn.1001-1978.2015.02.005
