一氧化碳释放分子3对缺氧/复氧心肌细胞内活性氧的影响
2016-01-12张在其幸小亮贺凯黄雪霜杨勇张荔铭
张在其 幸小亮 贺凯 黄雪霜 杨勇 张荔铭
心博骤停(cardiac arrest,CA)引起严重的全身性组织缺氧缺血,心肺复苏(cardiopulmonary resuscitation, CPR)可使机体恢复自主循环,但也会造成不可逆全身性缺血/再灌注损伤[1-3]。以往研究发现,过多的活性氧(reactive oxygen species,ROS)对心肌细胞有显著损害作用[4-6]。因此,如何降低缺血/再灌注损伤时大量ROS的产生成为临床上的研究重点。诱导内源性一氧化碳产生可有效保护复苏后心功能和缺氧/复氧损伤的心肌细胞[7-9],但其是否通过降低ROS而起作用未见报道。本研究采用一氧化碳释放分子3(CO-releasing molecules, CORM-3)干预缺氧/复氧大鼠心肌细胞,通过观察CORM-3的不同浓度及不同干预时间对心肌细胞内ROS产生的影响,探讨CORM-3保护作用的浓度和时间效应。
材料与方法
一、实验材料
大鼠心肌细胞H9c2株购于武汉博士德生物工程有限公司,细胞培养所需要的高糖DMEM、无糖DMEM、胎牛血清、胰酶均购于GIBICO公司,CORM-3购于Sigma公司,ROS检测试剂盒购于上海碧云天生物技术有限公司,实验仪器及耗材均由湖南医药学院生物医学研究中心提供。
二、实验方法
1.大鼠心肌细胞H9c2的培养及缺氧/复氧处理:根据参考文献进行大鼠心肌细胞H9c2的缺氧处理[10-12]。将大鼠心肌细胞H9c2置于含100 g/L胎牛血清(fetal bovine serum,FBS)的DMEM高糖培养基中培养,每2~3 d更换培养基,当细胞生长至汇合度90%左右时用2.5 g/L胰酶消化转至24孔板进行培养,随机分为对照组、缺氧6 h组和缺氧10 h 组。对照培养和复氧培养均采用100 g/L FBS的高糖DMEM培养基,放入5%CO2、95%空气、37℃培养箱中培养;缺氧培养采用无FBS的DMEM无糖培养基,置于5%CO2、95%N2、37℃缺氧培养箱中培养。各组实验结束后检测心肌细胞内ROS量。
2.CORM-3溶液配制及干预分组:10 mg CORM-3粉末溶于3.4 mL无菌水中溶解后配成10 mmol/L的浓储液,分装至PCR管中-20℃保存,使用时再进行稀释。将CORM-3溶解在PBS(pH值7.40)中稀释并室温静止2 d,使用前用N2鼓泡10 min去除液体中残余的CO,制备成含CO活性的CORM溶液。为探讨不同浓度CORM-3对缺氧/复氧心肌细胞内ROS的影响,将H9c2心肌细胞缺氧6 h后,分别采用10 μM、50 μM、100 μM和200 μM 的CORM-3复氧6 h进行心肌细胞内ROS检测;为探讨不同复氧时间对缺氧/复氧心肌细胞内ROS的影响,选用50 μM CORM-3对缺氧6 h的心肌细胞分别进行2 h、4 h、6 h、10 h复氧后检测心肌细胞内ROS量。
3.心肌细胞内ROS检测:各组心肌细胞按照1∶10 00的比例加入10 mM的2,7-二氯荧光黄双乙酸盐(2′,7′-dichlorofluorescein diacetate,DCFH-DA)使其终浓度为10 μM,在37℃培养箱中放置20 min后用PBS洗涤细胞3次,再用0.25%胰酶消化后重悬于100 μL PBS中,将细胞转移至黑色平底96孔板中置于多功能酶标仪中测量495 nm/525 nm波长下的荧光值。荧光值与对照组相比进行归一化处理,计算相对吸光度(A)。
三、统计学分析
结 果
一、不同缺氧时间对心肌细胞内ROS的影响
与对照组相比,缺氧6 h组的心肌细胞内ROS量升高极显著(P<0.0001);缺氧10 h组的心肌细胞死亡过多,未进行ROS检测见图1。
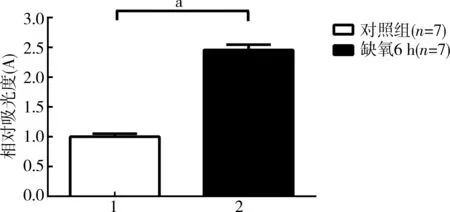
注:aP<0.000 1
图1缺氧6 h对心肌细胞内ROS量的影响
二、不同浓度CORM-3对缺氧/复氧心肌细胞内ROS的影响
与对照组相比,10 μmol/L CORM-3组的心肌细胞内ROS量有所降低,但差异无统计学意义(P>0.05);50 μmol/L、100 μmol/L CORM-3组的心肌细胞内ROS量均显著降低P<0.05;200 μmol/L CORM-3组的心肌细胞内ROS量有所升高,但差异无统计学意义(P>0.05),然而与50 μmol/L、100 μmol/L组相比时,心肌细胞内ROS量均显著升高(P<0.05)。见图2。
三、不同复氧时间对缺氧/复氧心肌细胞内ROS的影响
与对照组相比,复氧2 h、4 h组细胞内ROS量有所降低,但差异均无统计学意义(P>0.05)。复氧6 h、10 h组细胞内ROS量均显著降低(P<0.05)。与复氧2 h、4 h组相比,复氧6 h组细胞内ROS量均显著降低(P<0.05)。与复氧6 h组相比,复氧10 h组细胞内ROS量有轻微的升高(P>0.05)。见图3。
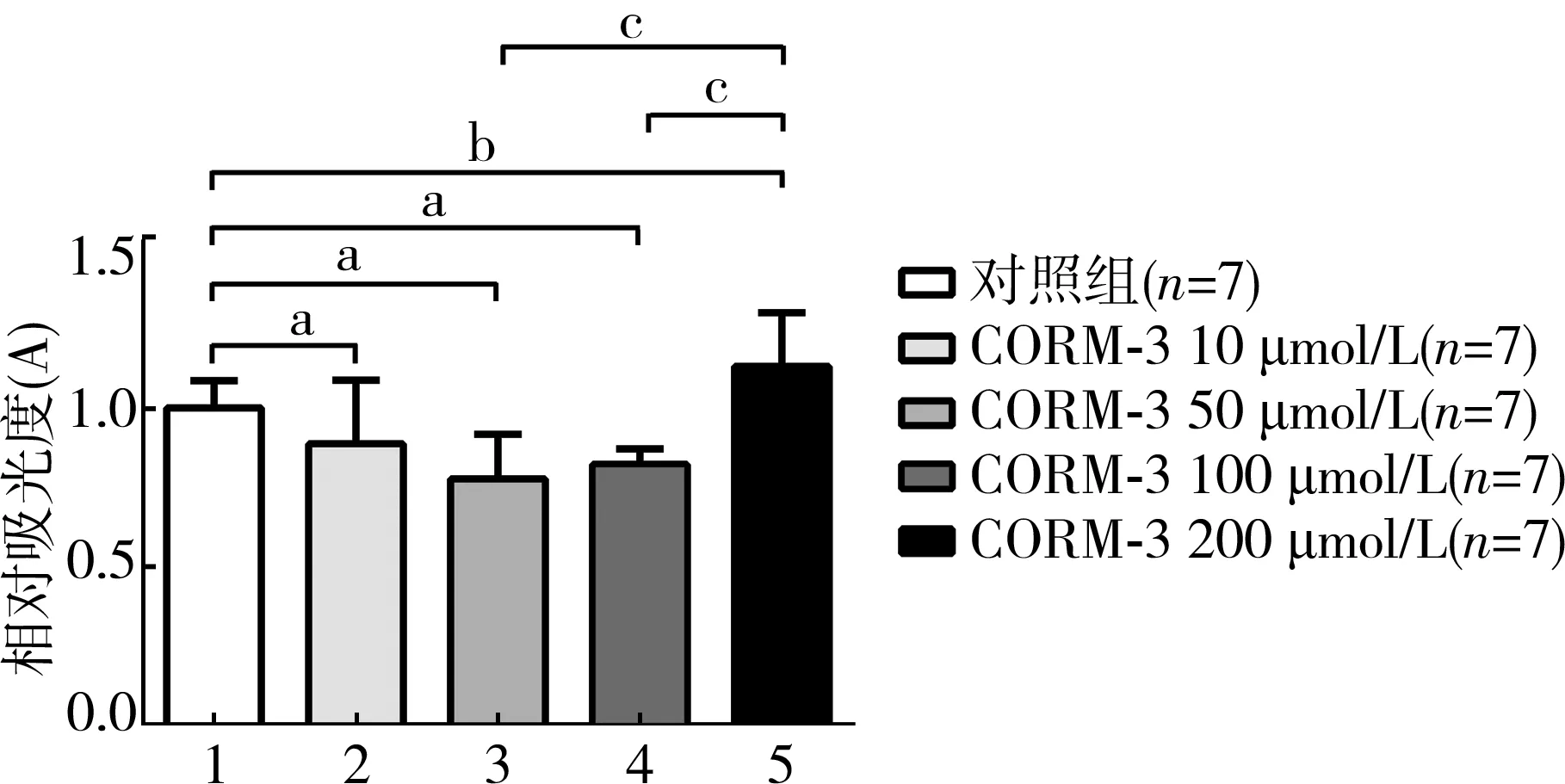
注:分别为CORM-3 10 μmol/L,50 μmol/L,100 μmol/L,与对照组比较aP<0.05;CORM-3 200 μmol/L与对照组比较,bP<0.05;分别为CORM-3 50 μmol/L,100 μmol/L,与200 μmol/L比较cP<0.05
图2不同浓度CORM-3对缺氧/复氧心肌细胞内ROS的影响
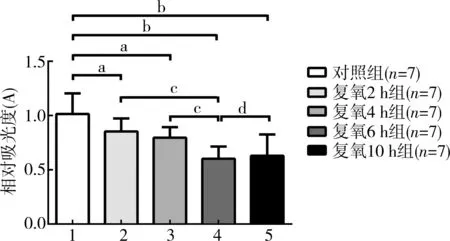
注:复氧2 h组,4 h组与对照组相比,aP>0.05;复氧6 h组,10 h 组与对照组相比bP<0.05;复氧2 h组,4 h组与复氧6 h组相比cP<0.05;复氧10 h组与复氧6 h组相比,dP<0.05
图3不同复氧时间对缺氧/复氧心肌细胞内ROS的影响
讨 论
心肺复苏是抢救心脏骤停患者的主要措施,但同时也会造成不可逆缺血/再灌注损伤[1-3],复苏后心功能不全是复苏早期高死亡率的重要原因。目前,关于缺血/再灌注损伤存在多种学说进行,其中之一就是ROS损伤学说,主要原因为缺氧早期引起大量ROS的产生,引起氧化应激反应,导致CPR后组织细胞损伤,因此,有研究者认为改善氧化应激反应对于减少心脏骤停的损伤具有重要作用[13-15]。ROS是细胞代谢过程中产生的氧自由基和能转化为氧自由基的物质,其中内源性ROS主要来自线粒体的有氧呼吸与代谢,为呼吸链的主要产物源。ROS是机体内不可或缺的物质,一定浓度的ROS对机体起着重要的生理作用[16],当浓度较高时,反而会对机体产生损伤[17-18]。Hao等[19]认为高浓度的ROS不宜外周造血干细胞特性的维持。Zhang等[20]认为,ROS在胰腺癌中起“双刃剑”的作用,高浓度ROS显著损伤癌细胞并导致其死亡,Yang等[21]认为,癌细胞内ROS量较正常细胞明显增多,因此成为选择性治疗癌症新的研究靶点。降低缺氧细胞内ROS量的产生对维持机体正常功能具有重要意义。
CORM-3为水溶性CO释放分子[22-23],Pizarro等[24]研究发现,使用CORM-3能减轻捐赠者肝脏冷冻保存和转移中的损伤,研究者认为该辅助保护方法同样适用于心脏、肾脏等气管的保存和转运。Kim等[25]研究发现,CORM-3联合NO能反向诱导肝线粒体生成,成为治疗线粒体疾病的一项重要策略。Long等[23]研究发现,CORM-3能通过磷酸盐运输解偶联线粒体的呼吸作用。Bergstraesser 等[26]研究发现,CORM-3能抑制内皮细胞血管细胞粘附分子-1的表达,该抑制作用也是通过线粒体呼吸作用及抑制p38实现的。因此,鉴于CORM-3在线粒体呼吸中的作用及对肝、心、肾等器官的保护作用,笔者推测CORM-3可能通过降低细胞ROS量减小再灌注损伤作用。为此,笔者首先探讨不同缺氧时间对心肌细胞内ROS的影响,发现缺氧6 h心肌细胞内ROS显著升高,缺氧10 h心肌细胞死亡过多,ROS产生量无可比性,故未进行ROS检测,从而选择6 h作为本研究后续实验的缺氧时间,而复氧时间则参考文献设定[12, 27-29]。
本研究发现50 μmol/L和100 μmol/L浓度的CORM-3进行缺氧/复氧干预时,细胞内ROS的量显著降低,其中,50 μmol/L的CORM-3效果更好;但当继续增加CORM-3浓度至200 μmol/L时,细胞内ROS量反而升高,提示CORM-3对缺氧/复氧的心肌细胞可能存在“双刃剑”效应,即适当浓度时,存在保护作用;浓度过高时,反而损伤细胞。此外,为探讨CORM-3对缺氧/复氧心肌细胞的保护作用是否存在时间效应,选择50 μmol/L浓度的CORM-3对缺氧6 h的心肌细胞分别进行复氧2 h、4 h、6 h、10 h的研究,发现进行2 h、4 h复氧时,细胞内ROS量呈现降低,但差异不显著;但当复氧时间分别延长至6 h、10 h时,细胞内ROS量均呈现显著降低,其中复氧6 h的效果更好,提示CORM-3对降低细胞内ROS的量与其复氧时间相关。
1 Jentzer JC,Chonde MD,Dezfulian C.Myocardial dysfunction and shock after cardiac arrest [J].Biomed Res Int, 2015:314796.
2 Patil KD,Halperin HR,Becker LB.Cardiac arrest: resuscitation and reperfusion[J].Circ Res, 2015,116(12):2041-2049.
3 Scolletta S,Donadello K,Santonocito C,et al.Biomarkers as predictors of outcome after cardiac arrest[J].Expert Rev Clin Pharmacol, 2012,5(6):687-699.
4 Wang ZH,Liu JL,Wu L,et al.Concentration-dependent wrestling between detrimental and protective effects of H2O2 during myocardial ischemia/reperfusion[J].Cell Death Dis,2014,5:1297.
5 Xie J,Zhou X,Hu X,et al.H2O2 evokes injury of cardiomyocytes through upregulating HMGB1[J].Hellenic J Cardiol,2014,55(2):101-106.
6 Qu D,Han J,Ren H,et al.Cardioprotective effects of astragalin against myocardial ischemia/reperfusion injury in isolated rat heart[J].Oxid Med Cell Longev,2016:8194690.
7 Stein AB,Bolli R,Dawn B,et al.Carbon monoxide induces a late preconditioning-mimetic cardioprotective and antiapoptotic milieu in the myocardium[J].J Mol Cell Cardiol,2012, 52(1):228-236.
8 Zhao S,Lin Q,Li H,et al.Carbon monoxide releasing molecule2 attenuated ischemia/reperfusioninduced apoptosis in cardiomyocytes via a mitochondrial pathway[J].Mol Med Rep,2014,9(2):754-762.
9 Peers C,Steele DS.Carbon monoxide: a vital signalling molecule and potent toxin in the myocardium[J].J Mol Cell Cardiol, 2012,52(2):359-365.
10 Zhang Y,Liao H,Zhong S,et al.Effect of N-n-butyl haloperidol iodide on ROS/JNK/Egr-1 signaling in H9c2 cells after hypoxia/reoxygenation[J].Sci Rep, 2015,5:11809.
11 Zhao P,Li F,Gao W,et al.Angiotensin1-7 protects cardiomyocytes from hypoxia/reoxygenation-induced oxidative stress by preventing ROS-associated mitochondrial dysfunction and activating the Akt signaling pathway[J].Acta Histochem, 2015, 117(8):803-810.
12 Li C,Hu M,Wang Y,et al.Hydrogen sulfide preconditioning protects against myocardial ischemia/reperfusion injury in rats through inhibition of endo/sarcoplasmic reticulum stress[J].Int J Clin Exp Pathol, 2015,8(7):7740-7751.
13 Zhuo X,Xie L,Shi FR,et al. The benefits of respective and combined use of green tea polyphenols and ERK inhibitor on the survival and neurologic outcomes in cardiac arrest rats induced by ventricular fibrillation[J].Am J Emerg Med, 2016,34(3):570-575.
14 Liu B,Qian JM.Cytoprotective role of heme oxygenase-1 in liver ischemia reperfusion injury[J].Int J Clin Exp Med,2015,8(11):19867-19873.
15 Yao L,Wang P,Chen M,et al.Carbon monoxide-releasing molecules attenuate postresuscitation myocardial injury and protect cardiac mitochondrial function by reducing the production of mitochondrial reactive oxygen species in a rat model of cardiac arrest[J].J Cardiovasc Pharmacol Ther,2015,20(3):330-341.
16 Sugamura K,Keaney JF.Reactive oxygen species in cardiovascular disease[J].Free Radic Biol Med,2011,51(5):978-992.
17 Kalogeris T,Bao Y,Korthuis RJ.Mitochondrial reactive oxygen species: a double edged sword in ischemia/reperfusion vs preconditioning[J].Redox Biol,2014,2:702-714.
18 Zuo L,Best TM,Roberts WJ,et al.Characterization of reactive oxygen species in diaphragm[J].Acta Physiol (Oxf), 2015,213(3):700-710.
19 Hao YW,Xu HM,Cheng DY,et al.Role of antioxidant in protecting the biological function of hematopoietic stem cells[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2014,22(1):142-147.
20 Zhang L,Li J,Zong L,et al.Reactive oxygen species and targeted therapy for pancreatic cancer[J]. Oxid Med Cell Longev,2016:1616781.
21 Yang Y,Karakhanova S,Hartwig W,et al. Mitochondria and mitochondrial ROS in cancer: novel targets for anticancer therapy[J].J Cell Physiol, 2016.
22 Foresti R,Hammad J,Clark JE,et al.Vasoactive properties of CORM-3, a novel water-soluble carbon monoxide-releasing molecule[J].Br J Pharmacol,2004,142(3):453-460.
23 Long R,Salouage I,Berdeaux A,et al.CORM-3, a water soluble CO-releasing molecule, uncouples mitochondrial respiration via interaction with the phosphate carrier[J].Biochim Biophys Acta,2014,1837(1):201-209.
24 Pizarro MD,Rodriguez JV,Mamprin ME,et al.Protective effects of a carbon monoxide-releasing molecule (CORM-3) during hepatic cold preservation[J].Cryobiology, 2009, 58(3):248-255.
25 Kim SK,Joe Y,Zheng M,et al.Resveratrol induces hepatic mitochondrial biogenesis through the sequential activation of nitric oxide and carbon monoxide production[J].Antioxid Redox Signal,2014,20(16):2589-2605.
26 Bergstraesser C,Hoeger S,Song H,et al.Inhibition of VCAM-1 expression in endothelial cells by CORM-3:the role of the ubiquitin-proteasome system, p38, and mitochondrial respiration[J].Free Radic Biol Med, 2012,52(4):794-802.
27 Cong B,Xu Y,Sheng H,et al.Cardioprotection of 17beta-estradiol against hypoxia/reoxygenation in cardiomyocytes is partly through up-regulation of CRH receptor type 2[J].Mol Cell Endocrinol,2014,382(1):17-25.
28 Dong G,Chen T,Ren X,et al.Rg1 prevents myocardial hypoxia/reoxygenation injury by regulating mitochondrial dynamics imbalance via modulation of glutamate dehydrogenase and mitofusin 2[J].Mitochondrion,2016,26:7-18.
29 Gao Y,Jia P,Shu W,et al.The protective effect of lycopene on hypoxia/reoxygenation-induced endoplasmic reticulum stress in H9C2 cardiomyocytes[J].Eur J Pharmacol,2016, 774:71-79.
