右向左分流患者的脑血流自动调节受损:偏头痛和隐源性卒中的潜在机制
2016-01-12郭珍妮邢英琦刘嘉王爽闫硕靳航杨弋译者吕珊郭雨竹
郭珍妮,邢英琦,刘嘉,王爽,闫硕,靳航,杨弋(译者:吕珊,郭雨竹)
目前,已有充分的证据表明右向左分流(right-to-left shunts,RLS)与偏头痛和隐源性卒中有着密切联系[1-3],其机制尚不明确。现被广泛认可的理论是:来自静脉系统的代谢产物和栓子直接进入动脉系统,引起了偏头痛和栓塞(反常栓塞理论)[3-7]。但这个理论尚不完善,因为在脑灌注良好的情况下,脑血管系统有清除栓子的能力,引起栓塞的可能性很小。因此,研究者假设伴有RLS的患者脑血流自动调节功能受损,大脑难以维持稳定的灌注,以致于脑血管系统清除栓子和代谢产物的能力降低[8],最终导致代谢产物积聚并发生栓塞。
已有报道表明偏头痛和卒中可能与脑血流自动调节异常有关[9-12]。然而,这些研究并没有探讨脑血流自动调节功能受损与RLS是否有关联。
为明确偏头痛和隐源性卒中的机制,本课题组研究了RLS与动态脑血流自动调节(dynamic cerebral autoregulation,dCA)之间的关系,旨在明确dCA在RLS、偏头痛和隐源性卒中之间的作用。
1 对象与方法
1.1 研究对象 本研究获得吉林大学第一医院伦理委员会批准。所有受试对象均签署了知情同意书,未成年受试者由其父母/监护人代签。研究者在签署知情同意书之前对未成年人及其父母/监护人解释了本研究的细节、可行性和可能带来的危害,并尊重他们的意见。
这项前瞻性的研究连续纳入了自2013年4月至2013年12月期间在吉林大学第一医院神经科的被确诊为偏头痛的患者。所有患者均由两位神经内科医师按照国际头痛协会的标准确诊为偏头痛[13]。
入组年龄标准为大于14岁且小于50岁,排除颅内/颅外动脉狭窄或闭塞以及心房颤动的患者。临床检查包括全面的体格检查、实验室检查、经颅多普勒(MultiDop X2,DWL,Sipplingen,德国)、颈动脉超声(IU22,Phillips,Andover,Massachusetts,美国)、对比增强经颅多普勒超声(MultiDopX4;DWL,Sipplingen,德国),以及磁共振成像(1.5T,Signa,General Electric Medical Systems,Milwaukee,WI)。本研究采用T1加权序列(repetition time 450 ms;echo time 9 ms;field of view 240 mm;matrix 256×224;slice thickness 5 mm;intersection gap 2 mm;band width 15.63 kHz)和快速自旋回波T2加权序列(repetition time 4200 ms;echo time 85 ms;echo train length11;field of view 240 mm;matrix 256×256;slice thickness 5 mm;intersection gap 2 mm;band width 15.63 kHz)作为评价脑梗死的指标,并用T2像测量梗死范围。每位患者由两名神经内科医师诊断为隐源性卒中,诊断依据包括病史、临床检查、实验室检查、头部磁共振成像(magnetic resonance imaging,MRI)、经颅多普勒超声(transcranial Doppler,TCD)、颈动脉超声和心电图。根据急性卒中治疗低分子肝素实验病因分型法(Trial of Org 10 172 in Acute Stroke Treatment,TOAST),大动脉粥样硬化性卒中、心源性栓塞、腔隙性卒中或其他有明确病因的卒中患者被排除在外。
本研究将患者分为2组:RLS组和无RLS组;RLS组又被分为少量分流组(正常呼吸或Valsalva动作后有1~10个微气泡)和大量分流组(正常呼吸或Valsalva动作后微气泡数>10个)。此外,RLS组还被分为2组:固有分流组(RLS在静息状态和Valsalva动作后均出现)和潜在分流组(RLS只在Valsalva动作后出现)。
1.2 对比增强经颅多普勒超声(contrastenhanced TCD,c-TCD)实验操作 患者取仰卧位,用18 G套管针于肘静脉留置通路。采用TCD监测一侧大脑中动脉(middle cerebral artery,MCA)。用9 ml等渗盐水、1 ml空气以及1滴患者自身血液配成造影剂,通过1个三通管将2支10 ml注射器连接,充分混合上述溶液。反复抽吸混匀30次,将造影剂弹丸式注入肘静脉。第一次注射是在平静呼吸(静息)下完成,第二次注射后5 s嘱患者做Valsalva动作维持10 s。根据平静呼吸和Valsalva动作下监测MCA的最多微气泡数来判断最大分流量[5]。
1.3 dCA实验操作 用自动血压监护仪(Omron 711)测量肱动脉基线动脉血压(arterial blood pressure,ABP)。采用TCD于45~60 mm深度下连续监测双侧MCA血流速度,通过在中指连接无创手指血压连续监测仪,实时同步监测ABP,同时将附有鼻套管的面罩连于二氧化碳(carbon dioxide,CO2)分析仪(MultiDop X2,DWL,Sipplingen,德国)以监测呼气末CO2(end tidal CO2,EtCO2)。
dCA检查在c-TCD检查后第2天进行,确保患者检查前避免接触烟、酒及尼古丁至少12 h。检查在环境安静的专用研究室中进行,室温控制在20~24 ℃,将外界刺激降到最低。受试者取仰卧位,平静休息10 min后开始测量基线ABP。之后,继续于仰卧位连续监测10 min血流速度和ABP。记录数据用于评估dCA。
1.4 数据分析 采集的数据由MATLAB处理。通过互相关函数去除多普勒脑血流速度(cerebral blood flow velocity,CBFV)信号和ABP信号间的延时,使信号按心率逐拍对齐。然后,先对信号滤波,防止降采导致信号畸变,再将信号都降采至1 Hz。计算降采后数据间的传递函数即可评估动态脑血流自动调节机能。其计算方法是求ABP和CBFV在频域上的自相关和互相关谱的商。通过传递函数[14]又可计算出ABP和CBFV间的阶跃响应和频率响应。在时域,阶跃响应可视为ABP产生阶跃变化后CBFV对其的响应过程。将求得的阶跃响应与Tiecks模型[15]定义的10个代表不同调节功能水平的阶跃响应通过相关性进行对比,对应相关系数最大的阶跃响应即作为脑血流自动调节功能指数,其值为该阶跃响应对应的序号。在频域,通过频率响应可计算信号间在0.06~0.12 Hz范围内(与调节功能相关的频带)的增益、相位差(phase difference,PD)、相干函数,用于评价脑血流自动调节功能。自动调节指数(autoregulation index,ARI)的详细计算方法在Mahony等[16-17]的文章中有所提及。
1.5 统计学分析 使用SPSS 17.0统计软件(SPSS,IBM,West Grove,PA,USA)对所有数据进行统计学分析。计量资料以表示,采用t检验分析。计数资料以率(百分比)表示,采用卡方检验和Fisher确切概率法分析。P<0.05为差异具有显著性。
2 结果
本研究共纳入66例偏头痛患者[平均年龄(30.9±9.9)岁,男性19例,女性47例]。其中36例患者无RLS,30例患者有RLS。RLS组中,16例为固有分流(53.3%),14例为潜在分流(45.5%);8例为少量分流(26.7%),22例为大量分流(73.3%)。根据MRI检查结果,RLS组中有7例(23.3%)隐源性卒中患者,其中4例为放射冠梗死,3例为基底节区梗死;这7例患者RLS均为大量分流。无RLS组中,只有3例(8.3%)隐源性卒中患者(均为放射冠梗死)。隐源性卒中的发病率在RLS组与无RLS组之间差异无显著性(P>0.05),并且所有患者的梗死灶均小于1 cm。
RLS组中,17例(56.7%)有先兆症状(闪光或暗点)。发作频率为(3.8±3.2)次/月。所有患者每次发作均伴有恶心,22例伴有眩晕,6例伴有肢体麻木。视觉模拟评分为(6.0±0.16)分。无RLS组,6例(16.7%)有先兆症状(闪光感)。发作频率为(2.9±1.8)次/月;23例发作时伴有恶心,18例伴有眩晕,4例发作时间与月经周期一致。视觉模拟评分为(5.8±0.17)分。
RLS组和无RLS组患者的性别、年龄、平均血压、心率及EtCO2均无显著性差异(表1)。
2.1 RLS组与无RLS组 RLS组的PD显著低于无RLS组(t=-1.4,P<0.001)。RLS组的增益与无RLS组差异无显著性。RLS组的ARI低于无RLS组(t=-3.3,P<0.05,表2,图1~2)。
在排除了隐源性卒中的患者后,本研究对两组的数据重新做了比较,结果与之前相同(RLS与无RLS组,PD:46.65°±21.58°与67.1°±18.0°,P<0.001;增益:0.74±0.32与0.79±0.33,P>0.05;ARI:7.03±1.59与7.91±1.26,P<0.05)。
2.2 大量分流组与少量分流组 大量分流组的PD显著低于少量分流组(t=3.1,P<0.01)与无RLS组(t=5.4,P<0.001)。大量分流组的增益与少量分流组和无RLS组差异无显著性。大量分流组的ARI与少量分流组差异无显著性,但明显低于无RLS组(t=3.6,P<0.001,表2,图1~2)。
少量分流组的PD、增益和ARI均与无RLS组差异无显著性(表2,图1~2)。
2.3 固有分流组与潜在分流组 固有分流组的PD与潜在分流组差异无显著性,但显著低于无RLS组(t=4.6,P<0.001)。这3组的整体增益差异均无显著性(表2,图1~2)。
潜在分流组的PD与ARI均低于无RLS组(PD:t=2.7,P<0.05;ARI:t=3.4,P<0.05),然而这两组的增益差异却无显著性(表2,图1~2)。

表1 基本特征
3 讨论
本研究发现,与无RLS的偏头痛患者相比,伴有RLS的患者自动调节参数PD和ARI均受损,表明其dCA能力下降。为了探明这一现象的根源,本研究依据两个不同的标准将RLS组又分成2个亚组。研究发现大量分流组与少量分流组相比dCA能力明显下降,然而固有分流组和潜在分流组之间的dCA差异无显著性。这些发现证实了研究者的假设:RLS是偏头痛患者dCA受损的潜在原因。
曾有报道指出偏头痛患者的dCA受损[9,18]。Müller等[9]研究了22例偏头痛患者和33例健康对照者,发现偏头痛患者的dCA相位和增益与健康对照组完全不同。他们认为这可能是由于交感神经受到抑制,副交感神经控制脑血流速度的缘故。最近,Reinhard等[18]运用相关系数发现了先兆偏头痛患者的dCA受损,作者认为这一改变与偏头痛患者的卒中风险增加有关。然而,这些研究并没有说明偏头痛患者dCA受损的潜在原因。本研究之所以研究RLS,是因为人们普遍认为它是偏头痛(超过40%的偏头痛患者发现有RLS)和隐源性卒中的危险因素[5-7,19]。事实上,本研究也发现了有RLS的偏头痛患者dCA受损的证据。鉴于dCA受损的程度与RLS的大小有关(RLS越大,dCA越差),作者相信RLS与dCA受损之间存在着某种直接联系。
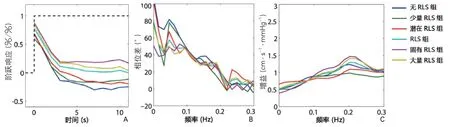
图1 通过传递函数得到的3组自动调节参数
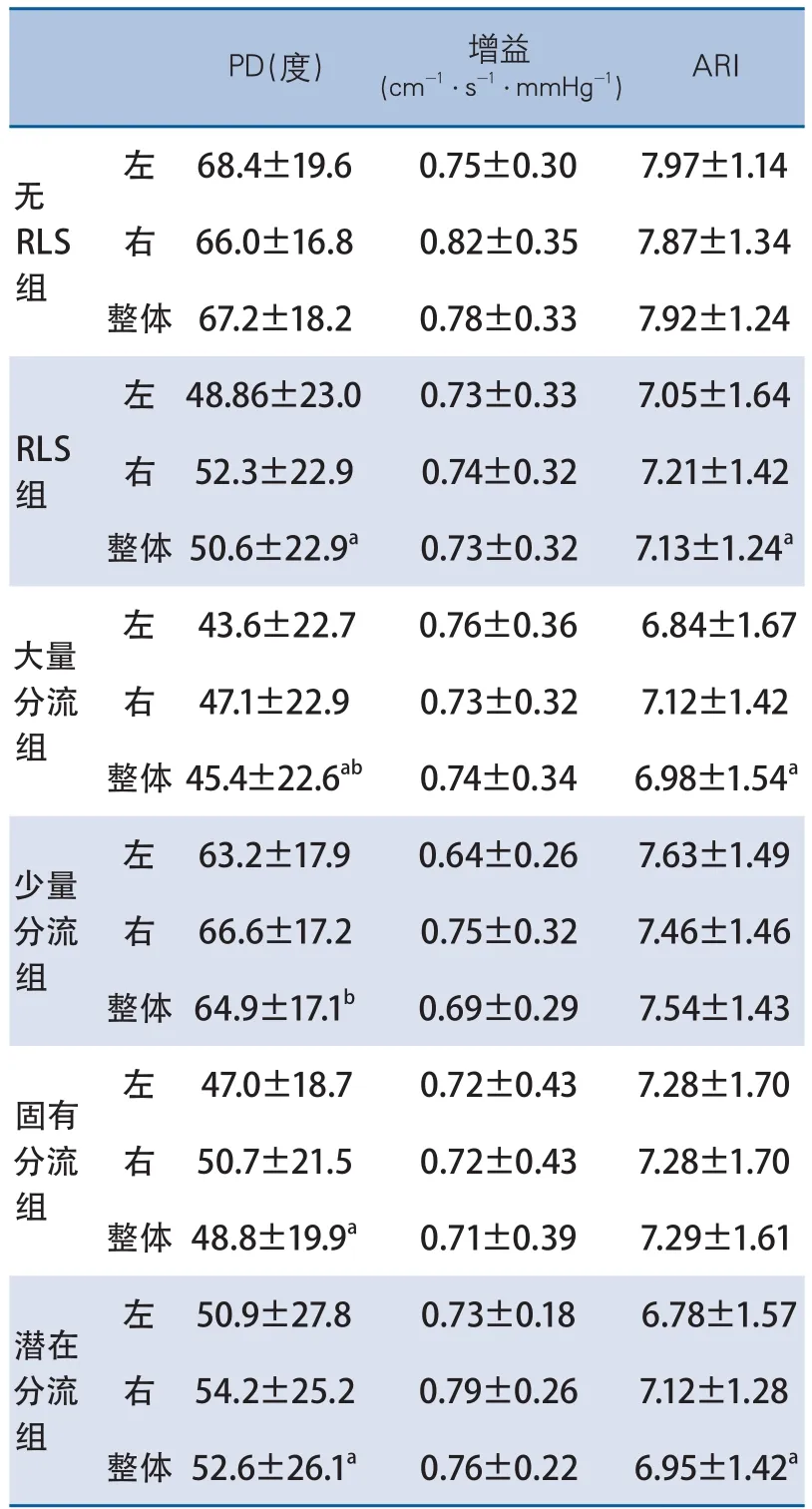
表2 各组的PD、增益和ARI

图2 各参数的统计学分布
综上,本研究的研究证据表明,RLS患者的dCA受损是其脑血管发生病理生理变化的结果。一个可能的原因是脑动脉代谢产物的变化。CO2、5-羟色胺及其他物质可以直接从静脉系统进入动脉,这可能引起脑动脉扩张[20],导致脑血管舒张功能降低。另一可能的机制为微栓子引起的皮层传播抑制(cortical spreading depression,CSD)[2]。CSD可以影响脑血管反应性[21-22],但是它对dCA的影响尚不明确。
曾有研究报道过RLS[通常是卵圆孔未闭(patent foramen ovale,PFO)所致]偏头痛和隐源性卒中共存的情况。在本研究中,偏头痛和隐源性卒中的共存率在RLS组为23.3%,在无RLS组为8.3%;可能是由于样本例数较少的缘故,尽管2组的数值有明显的差距,但差异并无显著性。将这几种疾病联系在一起的机制尚不清楚,有人提议将反常栓塞作为一种可能的解释。除了反常栓塞之外,本研究建议将dCA受损也作为可能的机制之一,它可以导致脑血管对栓子和代谢产物的清除能力下降[8],最终产生临床症状。
关于PFO封堵的决策尚存争议。在本研究中,大量分流的患者表现出明显的dCA受损,这一发现提供了支持PFO封堵的证据:防止栓塞事件的反复发作。然而,dCA在少量分流组中保持完好,表明其血流动力学没有发生明显改变,不推荐行PFO封堵术。
本研究存在一定的局限性。首先,由于c-TCD是一种微创检查,本研究无法招募到足够的无偏头痛但有RLS的志愿者与偏头痛患者做比较。样本数量较小是另一个局限之处。此外,有一些偏头痛患者的头痛并非主要位于一侧,所以本研究没有足够的数据比较疼痛侧与健侧的dCA差异。
偏头痛伴有大量RLS的患者存在dCA受损,这可能是联系RLS、偏头痛和隐源性卒中的潜在机制。
1 Pezzini A,Grassi M,Lodigiani C,et al.Predictors of migraine subtypes in young adults with ischemic stroke:the Italian project on stroke in young adults[J].Stroke,2011,42:17-21.
2 Nozari A,Dilekoz E,Sukhotinsky I,et al.Microemboli may link spreading depression,migraineaura,and patent foramen ovale[J].Ann Neurol,2010,67:221-229.
3 Giardini A,Donti A,Formigari R,et al.Spontaneous large right-to-left shunt and migraine headache with aura are risk factors for recurrent stroke in patients with a patent foramen ovale[J].Int J Cardiol,2007,120:357-362.
4 Sharma A,Gheewala N,Silver P.Role of patent foramen ovale in migraine etiology and treatment:a review[J].Echocardiography,2011,28:913-917.
5 Yang Y,Guo ZN,Wu J,et al.Prevalence and extent of right-to-left shunt in migraine:a survey of 217 Chinese patients[J].Eur J Neurol,2012,19:1367-1372.
6 Cabanes L,Mas JL,Cohen A,et al.Atrial septal aneurysm and patent foramen ovale as risk factors for cryptogenic stroke in patients less than 55 years of age.A study using transesophageal echocardiography[J].Stroke,1993,24:1865-1873.
7 Webster MW,Chancellor AM,Smith HJ,et al.Patent foramen ovale in young stroke patients[J].Lancet,1988,2:11-12.
8 Caplan LR,Hennerici M.Impaired clearance of emboli (washout) is an important link between hypoperfusion,embolism,and ischemic stroke[J].Arch Neurol,1998,55:1475-1482.
9 Muller M,Marziniak M.The linear behavior of the system middle cerebral artery flow velocity and blood pressure in patients with migraine:lack of autonomic control[J].Stroke,2005,36:1886-1890.
10 Eames PJ,Blake MJ,Dawson SL,et al.Dynamic cerebral autoregulation and beat to beat blood pressure control are impaired in acute ischaemic stroke[J].J Neurol Neurosurg Psychiatry,2002,72:467-472.
11 Dawson SL,Panerai RB,Potter JF.Serial changes in static and dynamic cerebral autoregulation after acute ischaemic stroke[J].Cerebrovasc Dis,2003,16:69-75.
12 Saeed NP,Panerai RB,Horsfield MA,et al.Does stroke subtype and measurement technique influence estimation of cerebral autoregulation in acute ischaemic stroke?[J].Cerebrovasc Dis,2013,35:257-261.
13 Headache Classification Subcommittee of the International Headache S.The International Classification of Headache Disorders:2nd edition[J].Cephalalgia,2004,24 Suppl 1:9-160.
14 Zhang R,Zuckerman JH,Giller CA,et al.Transfer function analysis of dynamic cerebral autoregulation in humans[J].Am J Physiol,1998,274:H233-H241.
15 Tiecks FP,Lam AM,Aaslid R,et al.Comparison of static and dynamic cerebral autoregulation measurements[J].Stroke,1995,26:1014-1019.
16 Mahony PJ,Panerai RB,Deverson ST,et al.Assessment of the thigh cuff technique for measurement of dynamic cerebral autoregulation[J].Stroke,2000,31:476-480.
17 Haubrich C,Wendt A,Diehl RR,et al.Dynamic autoregulation testing in the posterior cerebral artery[J].Stroke,2004,35:848-852.
18 Reinhard M,Schork J,Allignol A,et al.Cerebellar and cerebral autoregulation in migraine[J].Stroke,2012,43:987-993.
19 Del Sette M,Angeli S,Leandri M,et al.Migraine with aura and right-to-left shunt on transcranial Doppler:a case-control study[J].Cerebrovasc Dis,1998,8:327-330.
20 Schwerzmann M,Nedeltchev K,Lagger F,et al.Prevalence and size of directly detected patent foramen ovale in migraine with aura[J].Neurology,2005,65:1415-1418.
21 Florence G,Bonvento G,Charbonne R,et al.Spreading depression reversibly impairs autoregulation of cortical blood flow[J].Am J Physiol,1994,266:R1136-1140.
22 Lauritzen M.Long-lasting reduction of cortical blood flow of the brain after spreading depression with preserved autoregulation and impaired CO2response[J].J Cereb Blood Flow metab,1984,4:546-554.
