抗疏健骨颗粒水提工艺研究
2016-01-09杜星,郭东艳,史传道等
抗疏健骨颗粒水提工艺研究
杜星,郭东艳,史传道,王露,曹瑞
(陕西中医学院,陕西 咸阳 712046)
摘要:目的优化抗疏健骨颗粒水提工艺条件,为抗疏健骨颗粒剂的进一步研究奠定基础。方法以β-蜕皮甾酮含量及出膏率为评价指标,在单因素实验的基础上,通过正交试验筛选抗疏健骨颗粒最佳水提工艺。结果影响水提工艺各因素的作用主次为:C提取次数>B提取时间>A溶剂用量,最佳提取工艺条件是A2B2C3,即用10倍量水,提取3次,每次90 min。结论通过单因素试验、正交试验设计优选得到的抗疏健骨颗粒中牛膝、白术2味药材的水提工艺条件稳定可行。
关键词:抗疏健骨颗粒;β-蜕皮甾酮;正交设计;提取工艺
DOI:10.13463/j.cnki.jlzyy.2015.01.022
中图分类号:R284.2文献标志码: A
文章编号:1003-5699(2015)01-0074-03
基金项目:陕西省科技厅资助项目(2012KTCL03-22)。
作者简介:杜星(1988-),女,硕士研究生,主要从事中药新制剂与新剂型研究。
收稿日期:(责任编辑:张瑞彬2014-08-06)

Study on the process of water extraction for Kangshu Jiangu Granules
DU Xing,GUO Dongyan,SHI Chuandao,WANG Lu,CAO Rui
(Shaanxi University of Chinese Medicine,Xianyang 712046,Shanxi Provincce,China)
Abstract:ObjectiveTo optimize water extraction method for Kangshu Jiangu Granules and lay a solid foundation for its further study.MethodsThe extracting method of Kangshu Jiangu Granule was optimized by orthogonal design,taking the extraction rate of β-ecdysterone and extract yield as indexes.ResultsThe factors that influence water extraction:C extraction times>B extraction time>A solvent consumption.The optimum extracting condition was A2B2C3:with the volume of 10 folds,extracting for 3 times,90mins one time.ConclusionThe optimum technology is stable and feasible for the extraction of Kangshu Jiangu Granules by orthogonal and single factor experiment.
Keywords:Kangshu Jiangu Granules;β-ecdysterone;orthogonal design;extraction process
抗疏健骨颗粒由淫羊藿、杜仲、牛膝、白术、丹参等药物组成,具有补肾健脾、活血壮骨之功,主要用于脾肾两虚、气血瘀阻导致的骨质疏松症。牛膝是我国常用中药材之一,具有补肝肾、强筋骨、通淋利尿、引血下行之功[1]。目前发现牛膝中的活性成分主要为皂苷、植物甾酮、多糖以及黄酮类和生物碱类物质[2]。现代药理学研究表明,牛膝具有免疫调节、抗炎、抗菌、子宫兴奋、抗骨质疏松等多种作用[3-6]。白术主要含挥发油、白术内酯、白术多糖、苷类、氨基酸等成分,挥发油中的白术内酯类成分是白术中比较有特征的成分,也是重要的活性成分[7],另外苍术酮不稳定,在空气中易氧化[8]。白术具有健脾益气、调节胃肠功能、抗炎、抗肿瘤、抗氧化、延缓肾脏衰老等作用[9-11]。结合2味药材所含化学成分的理化性质及现代药理研究结果,本实验拟在单因素实验的基础上,以β-蜕皮甾酮含量及出膏率为评价指标,采用4因素3水平的L9(34)正交实验设计对水提工艺进行优化,为抗疏健骨颗粒的进一步研究提供参考依据。
1实验材料
1.1材料牛膝(批号:130401)、白术(批号:121201)均购于西安盛兴中药饮片有限责任公司,β-蜕皮甾酮对照品(供含量测定用,批号:111638-200603,中国药品生物制品检定所),乙腈、甲醇、甲酸为色谱纯(Honeywell),水为过滤后的娃哈哈纯净水。
1.2仪器安捷伦1260型高效液相色谱仪(G1329B型进样器,G1311C型四元泵,G4212B型二极管阵列检测器,ChemStation for LC 3D systems)。METTLER TOLEDO(AL204)电子天平(万分之一),Sartorius MC电子天平(十万分之一)。D101型电热鼓风干燥箱。
2方法与结果
2.1浸泡时间及吸水率的考察按处方比例称取牛膝、白术,共54 g,加5倍量水进行浸泡,至药物完全浸透,滤去多余水分,药渣称重,记录药材吸水后的重量,计算吸水率。
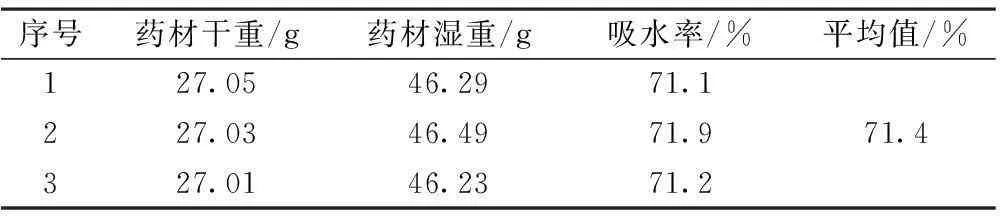
表1 药材吸水率试验结果( n=3)
结果表明,药材的吸水率为71.4%,即在首次加水时应多加1.0倍量。
2.2β-蜕皮甾酮含量测定
2.2.1色谱条件Thermo ODSC18(250 mm×4.6 mm,5 μm)色谱柱,流动相为乙腈-水-甲酸(16∶84∶0.1),流速1.0 mL/min,检测波长250 nm,柱温为室温。
2.2.2对照品溶液的制备精密称取β-蜕皮甾酮对照品适量,加甲醇制成每1 mL含0.1 mg的溶液,即得。
2.2.3供试品溶液制备精密移取各样品液10 mL,用0.45 μm微孔滤膜滤过,取续滤液,即得。
2.2.4标准曲线的绘制分别精密吸取β-蜕皮甾酮对照品溶液(浓度0.1 mg/mL)1,2,4,6,8,10,12 μL,按上述色谱条件注入色谱仪,测定峰面积。以峰面积为纵坐标,β-蜕皮甾酮含量(μg)为横坐标绘制标准曲线。计算的回归方程为:Y=1 668.2X+104.16,相关系数R2=0.999 9,β-蜕皮甾酮在0.1~1.2 μg之间线性关系良好。
2.2.5样品测定精密吸取供试品溶液与对照品溶液各10 μL,依据2.2.1项下色谱条件进行测定。
2.3出膏率的测定精密吸取各浓缩定容至100 mL的样品液10 mL,置已干燥至恒重的蒸发皿中,水浴蒸干,于105 ℃烘箱内干燥至恒重,至干燥器中冷却30 min,迅速精密称定重量。按下式计算出膏率。出膏率=[(浸膏重量×10)/药材重量]×100%
2.4单因素试验
2.4.1提取时间考察按处方比例称取牛膝、白术5份,每份54 g,分别加10倍量水煎煮1次,每次30,60,90,120,150 min,滤过,浓缩,定容至100 mL量瓶中。结果见表2。

表2 不同提取时间考察结果
2.4.2加水量考察按处方比例称取牛膝、白术6份,每份54 g,分别加6,8,10,12,14,16倍量水,煎煮2次,每次90 min,滤过,合并滤液,浓缩,定容至100 mL量瓶中。结果见表3。

表3 不同加水量考察结果
2.4.3提取次数考察按处方比例称取牛膝、白术4份,每份54 g,加10倍量水分别提取1,2,3,4次,每次90 min,滤过,浓缩,分别定容至100 mL量瓶中。结果见表4。β-蜕皮甾酮含量在第1次时为57.94 μg/mL,第2次为16.58 μg/mL,第3次为6.31 μg/mL。由此可以看出,提取3次时已基本提取完全。
2.5正交试验优选最佳水提工艺
2.5.1试验设计及结果[12-15]参照单因素设计试验
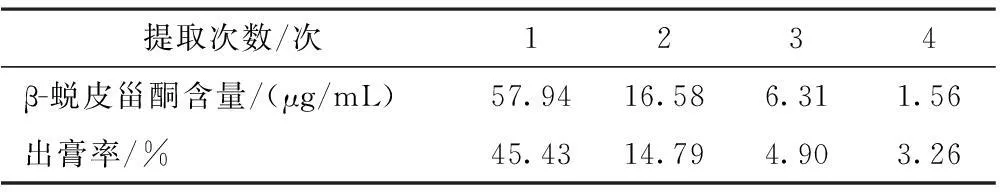
表4 不同提取次数考察结果
结果,选择加水量,提取时间,提取次数3个因素,每个因素选择3个水平,按L9(34)正交表进行试验,以出膏率、β-蜕皮甾酮含量的加和为综合指标筛选最佳提取工艺参数。因素水平表见表5。
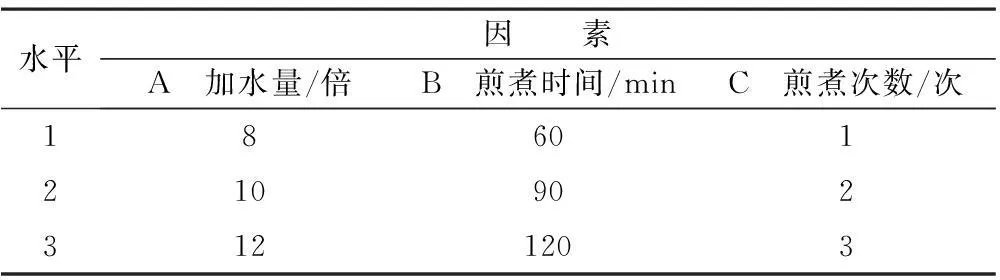
表5 因素水平
2.5.1.1试验方法按处方比例称取牛膝、白术9份,每份54 g,按照正交试验因素水平表安排用L9(34)正交表进行提取,滤过,滤液浓缩并定容至100 mL量瓶中,备用。
2.5.1.2出膏率测定精密移取10 mL样品液至已干燥恒重的蒸发皿中,水浴蒸干,于105 ℃干燥12 h,置干燥器中冷却30 min,迅速称重。按下式计算出膏率,结果见表6。出膏率=[浸膏重量×10/药材重量]×100%。
2.5.1.3β-蜕皮甾酮含量测定按单因素项下供试品溶液制备方法,制备供试品溶液,按“2.2”项下色谱条件进行测定,记录峰面积,计算β-蜕皮甾酮含量,结果见表6,方差分析结果见表7。综合评分(OD)=0.4W1/Wmax1+0.6W2/Wmax2
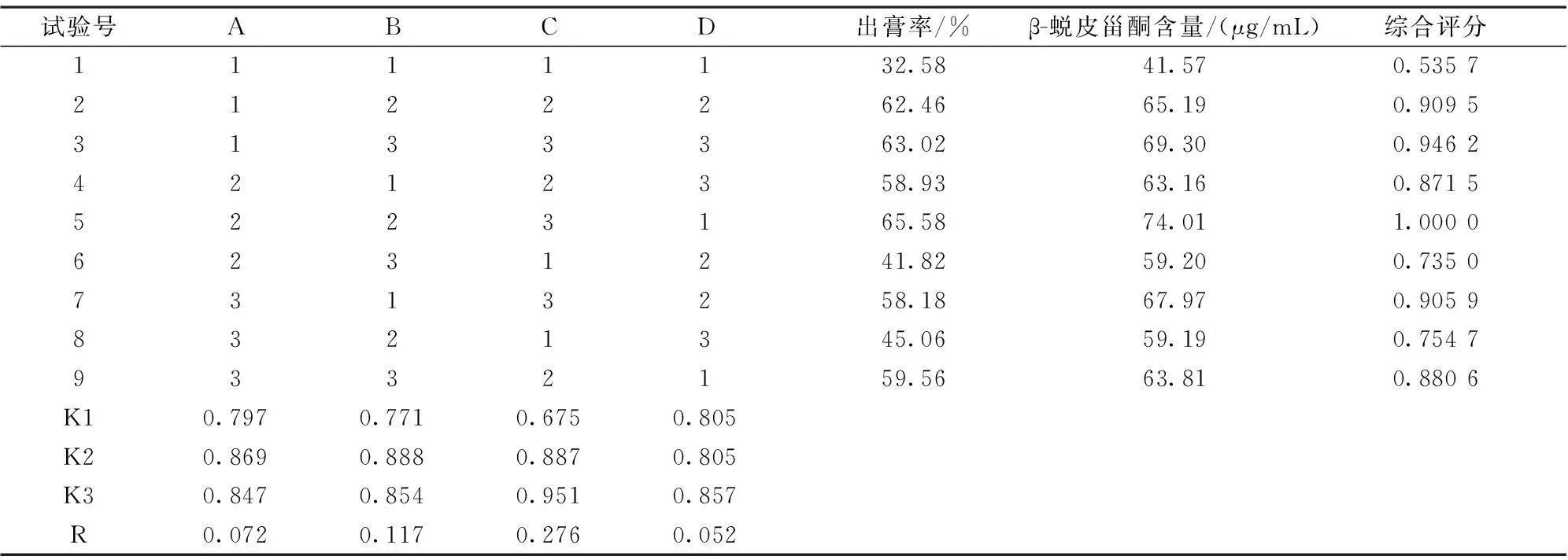
表6 正交试验设计与结果
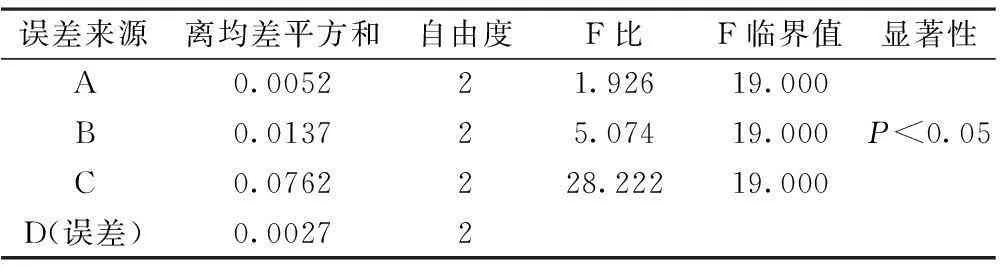
表7 正交试验方差分析
以综合评分为考察指标,由表6中极差R值大小显示,各因素的作用主次为C(提取次数)>B(提取时间)>A(溶剂用量)。表7方差分析结果表明:C因素各水平之间差异具有显著性(P<0.05),A、B因素各水平之间差异无显著性(P>0.05)。综上所述最终提取工艺确定为:A2B2C3,即10倍量水提取3次,每次90 min。
2.5.2验证试验为了考察正交试验的结果是否具有重现性,进行验证实验。称取以上2味药材3份,每份108 g,按照优选的工艺条件进行提取,测定出膏率、β-蜕皮甾酮含量,结果见表8。
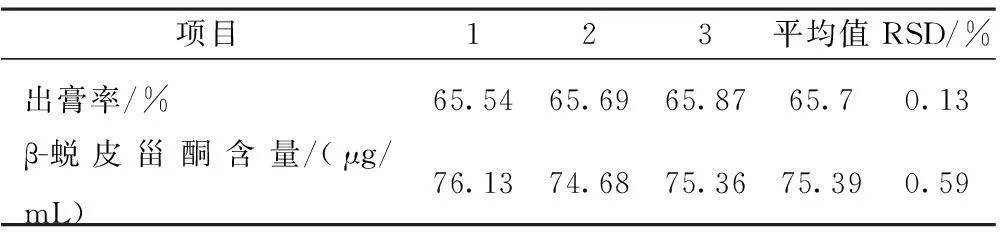
表8 验证实验结果
验证试验结果表明:该工艺条件合理可行,具重现性。
3讨论
牛膝是一味补骨中药,现代药理研究结果表明,含牛膝的补骨中药组方可减轻大鼠子宫重量,增加骨小梁密度、面积、总体积及密质骨面积,减小骨髓腔面积[16],从牛膝中提取的甾酮成分具有明显的促进促成骨细胞增长的活性[17],考虑到甾酮类成分为牛膝中的主要活性成分,因此在工艺筛选中以β-蜕皮甾酮含量作为评价指标之一。笔者曾对白术中所含挥发油的含量进行了预实验研究,结果表明,白术中的挥发油含量过于偏低,采用水蒸汽蒸馏法提取白术挥发油,出油率仅为0.2%。有文献报道白术水煎液可明显促进骨髓细胞增殖,增强机体免疫力[18],综合考虑到大生产及节约成本,本方中的白术考虑舍弃提取挥发油,直接水煎煮提取白术中的活性成分,并以出膏率作为评价指标之一。
本试验建立了β-蜕皮甾酮含量及出膏率的测定方法。通过正交设计试验法优选所得的最佳提取工艺为10倍量水提取3次,每次90min,验证试验结果表明,该工艺条件合理可行,重现性较好。
参考文献:
[1]陈坤.牛膝对肝脏损伤保护作用的研究[D].扬州:扬州大学,2010.
[2]孟大利.中药牛膝化学成分及其生物活性的研究[D].沈阳:沈阳药科大学,2004.
[3]李宗锴,李电东.牛膝多糖的免疫调节作用[J].药学学报,1997,32(12):2-8.
[4]高昌琨,高建,马如龙,等.牛膝总皂苷抗炎、镇痛和活血作用研究[J].安徽医药,2003,7(4):248-249.
[5]刘建华,梁生旺,王淑美.牛膝皂苷栓的抗生育作用研究[J].河南中医学院学报,2006,21(1):35,37.
[6]李建新,门田重利.牛膝的抗骨吸收活性成分[J].亚太传统医药,2006(1):77-78.
[7]杨娥,钟艳梅,冯毅凡.白术化学成分和药理作用的研究进展[J].广东药学院学报,2012,28(2):218-221.
[8]陈晓萍,张长林.白术不同化学成分的药理作用研究概况[J].中医药信息,2011,28(2):124-126.
[9]张奕强,许实波,林永成.白术内酯系列物的胃肠抑制作用[J].中药材,1999,22(12):636-640.
[10]朱金照,张捷,许其增,等.白术促进大鼠胃肠道运动的机制探讨[J].中国临床药学杂志,2001,10(6):365-368.
[11]金维哲,王大江,王溯,等.中药白术延缓小鼠肾脏衰老的形态学研究[J].中国老年学杂志,1997,17(6):365-367.
[12]赵晓平,吕杨,范小璇,等.健脑益智胶囊提取工艺研究[J].陕西中医学院学报,2013,36(5):83-85.
[13]郭东艳,张丽娟,师延琼,等.基于谱效相关的多指标综合加权评分法优选生地黄的提取工艺[J].中成药,2011,33(12):2183-2185.
[14]黄晓巍,初洪波,位鸿,等.正交试验法优选参红补血颗粒提取工艺[J].吉林中医药,2012,32(11):1152-1153.
[15]薛立平,张艳,尤献民,等.中药定心胶囊的提取工艺研究[J].长春中医药大学学报,2011,27(3):490-491.
[16]崔洪英,张柏丽,安秀玲.补肾中药对骨质疏松大鼠骨形态的影响[J].天津中医,1997,14(5):35-36.
[17]高晓燕,王大为,李发美,等.牛膝提取物对成骨样细胞增殖的作用[J].沈阳药科大学学报,2000,17(3):210-213.
[18]牛新华,邱世翠,丁长玲.白术对小鼠骨髓细胞增殖和白细胞介素-1的影响[J].中国现代医学杂志,2002,12(3):83-84.
