疏风宣肺方和解表清里方体外干预甲型流感病毒H1N1诱导炎性细胞因子分泌作用的研究 ※
2016-01-09葛世杰,刘晓婷,张沂等
疏风宣肺方和解表清里方体外干预甲型流感病毒H1N1诱导炎性细胞因子分泌作用的研究※
葛世杰刘晓婷张沂卢娜娜顾立刚△吴珺邱泽计张洪春1晁恩祥1
(北京中医药大学基础医学院中医药抗病毒重点实验室,北京100029)
【摘要】目的研究疏风宣肺方和解表清里方对甲型流感病毒H1N1感染的人肺腺癌上皮细胞(A549)中炎性细胞因子的影响。方法培养A549,甲型流感病毒H1N1感染A549后,分为细胞对照组、H1V1感染组、奥司他韦对照组、疏风宣肺组及解表清里组。采用实时定量聚合酶链式反应(RT-PCR)和Western blotting法检测各组细胞中炎症相关的白细胞介素(IL)1、肿瘤坏死因子α(TNF-α)、IL-6、IL-10、单核细胞趋化蛋白1(MCP-1)、调节活化正常T细胞表达和分泌的趋化因子(RANTES)的mRNA及蛋白表达的变化。结果基因芯片结果提示,与细胞对照组比较,H1N1感染组差异表达基因Il1β、Thf、Ccl5、Il10、Il6、Ccl2明显上调。与H1N1感染组比较,奥司他韦组、疏风宣肺组和解表清里组差异基因Thf、Il1β、Ccl5、Il10、Il6、Ccl2表达显著下调。RT-PCR结果显示,与细胞对照组比较,H1N1感染组IL-1、TNF-α、IL-6、IL-10、MCP-1、RANTES的mRNA表达均显著升高(P<0.01)。与H1N1感染组比较,疏风宣肺组IL-1、TNF-α、IL-6、IL-10、MCP-1的mRNA表达均明显降低(P<0.01,P<0.05),解表清里组IL-1、TNF-α、IL-6、MCP-1的mRNA表达均明显降低(P<0.01,P<0.05)。Western blotting结果显示,H1N1感染组IL-1、TNF-α、IL-6、IL-10、MCP-1、RANTES蛋白表达较细胞对照组显著升高(P<0.05);与H1N1感染组比较,疏风宣肺组及解表清里组IL-1、TNF-α、IL-6、IL-10、MCP-1、RANTES蛋白表达均显著降低(P<0.05,P<0.01)。结论疏风宣肺方和解表清里方均可抑制流感病毒感染后炎性细胞因子IL-1、TNF-α、IL-6、MCP-1的mRNA过表达及蛋白分泌,减轻炎症反应,并恢复机体免疫功能的稳定和平衡。
【关键词】流感病毒A型,H1N1亚型;抗病毒药(中药);炎症趋化因子类;体外研究;基因表达调控,病毒
doi:10.3969/j.issn.1002-2619.2015.06.024
【中图分类号】R373.13;R978.7;R349.64;R9-33;R392.114
【文献标识码】A
【文章编号】1002-2619(2015)06-0863-05
通讯作者:△北京中医药大学基础医学院医学病原学系,北京100029
作者简介:葛世杰(1981—),男,医师,博士研究生在读。研究方向:中医药抗流感免疫学和分子生物学研究。
Abstract【】ObjectiveTo investigate the effects of Shufeng-xuanfei and Jiebiao-qingli formulae on inflammatory cytokines induced by virus H1N1 in human pulmonary carcinoma cell A549. MethodsHuman pulmonary epithelial cells A549 were cultured and infected by influenza virus H1N1,and were divided into cell control group,H1N1-infected group,oseltamivir group,Shufeng-xuanfei group and Jiebiao-qingli group. The mRNA and protein expression of IL-1,TNF-α,IL-6,IL-10,MCP-1 and RANTES were detected by DNA microarray,real-time PCR and western-blotting. ResultsGene microarray showed that,as compared with cell control group,the expressions of Il1β,Tnf,Ccl5,Il10,Il6,Ccl2 were obviously up-regulated in H1N1-infected group. Compared with H1N1-infected group,the expressions of Il1β,Tnf,Ccl5,Il10,Il6,Ccl2 were obviously down-regulated in oseltamivir group,Shufeng-qingre group and Jiebiao-qingli group. RT-PCR showed that,as compared with cell control group,the mRNA expressions of IL-1,TNF-α,IL-6,IL-10,MCP-1 and RANTES were significantly increased in H1N1-infected group (P<0.01). Compared with H1N1-infected group,the mRNA expressions of IL-1,TNF-α,IL-6,IL-10 and MCP-1 were significantly decreased in Shufeng-xuanfei group (P<0.01,P<0.05),and the mRNA expressions of IL-1、TNF-、IL-6、MCP-1 in Jiebiao-qingli group were significantly decreased (P<0.01,P<0.05). Western blotting showed that,the levels of L-1,TNF-α,IL-6,IL-10,MCP-1 and RANTES in H1N1-infected group were obviously increased as compared with those in cell control group (P<0.05). The levels of IL-1,TNF-α,IL-6,IL-10,MCP-1 and RANTES in Shufeng-qingre and Jiebiao-qingli group were decreased as compared with those in H1N1-infected group (P<0.05,P<0.01). ConclusionShufeng-xuanfei formula and Jiebiao-qingli formula can down-regulate the over-expressions of IL-1,TNF-α,IL-6,MCP-1 and RANTES mRNA and protein,reducing inflammation,restoring stability and balance of body's immune function.
收稿日期:(2014-12-31)
※项目来源:国家自然科学基金资助项目(编号:81173371)
1北京中日友好医院呼吸内科,北京100029
Investigation of extraorgan intervention of combination of Shufeng-xuanfei formula and Jiebiao-qingli formula on the secretory action of influenza virus H1N1-induced inflammatory cytokinesGEShijie,LIUXiaoting,ZHANGYi,etal.KeyLaboratoryofChineseMedicineonViralDisease,BasicMedicalCollege,BeijingUniversityofChineseMedicine,Beijing100029
【Key words】Influenza virus type A,H1N1;Antiviral agent (Traditional Chinese medicine);Chemokines;In vitro study;Gene expression regulation;Virus
人流感病毒分为甲(A)、乙(B)、丙(C)3型,其中甲型流感病毒抗原性易发生变异,多次引起世界性大流行[1]。尽管世界卫生组织(WHO)已在2010-08宣布甲型H1N1流感流行已经过去,但每年季节性流感流行及某时某种新型流感的出现仍会严重威胁人类健康[2]。近年来,随着中医药对流感病因病机、作用靶点等研究的不断深入,传统中医药在治疗流感方面取得了满意疗效,表现出独特优势。其中,中药对流感病毒感染机体免疫调控网络中的炎性细胞因子的干预研究成为热病微观化研究的热点之一[3]。疏风宣肺方和解表清里方是根据中医“外感风寒,内蕴热毒”的病机理论,结合长期临床实践配伍而成。本实验研究通过动态观察2种不同治法方药对甲型H1N1流感病毒感染所致人肺腺癌上皮细胞(A549)炎症性细胞因子的影响,探讨其治疗流感的药效学机制。
1材料与方法
1.1材料
1.1.1实验试剂及仪器A549,购自中国医学科学院细胞中心。McCoy's 5A培养基和胎牛血清,美国gibco公司;0.25%胰酶-0.02% 乙二胺四乙酸(EDTA),美国Thermo公司;细胞培养液(含10 %胎牛血清和1% 青-链霉素混合物的完全McCoy's 5A培养基),细胞维持液(含2.0%胎牛血清的McCoy's 5A培养基),1.5%鸡红细胞混悬液;聚合酶链式反应(PCR)引物由生工生物工程(上海)股份有限公司合成;逆转录酶(M-MLV)反转录试剂盒,TaKaRa公司;实时定量PCR(RT-PCR)扩增试剂盒,购自北京泽平科技有限责任公司;100 bp DNA ladder,购自北京全式金生物技术有限公司;基因芯片检测试剂盒(Ambion 8AM1753),CA,USA;基因芯片HOA 5.1,Phalanx Biotech Group,Inc,Taiwan;One Array®预杂交缓冲液[5XSSPE,0.1%十二烷基硫酸钠(SDS),1%牛血清白蛋白(BSA)];扫描仪AXON4000B,Molecular Device,CA,USA;软件Rosetta Resolver®System,Rosetta Biosoftware,USA。白细胞介素(IL)1、肿瘤坏死因子α(TNF-α)、IL-6、IL-10、单核细胞趋化蛋白1(MCP-1)、调节活化正常T细胞表达和分泌的趋化因子(RANTES),一抗购自北京博奥森生物技术有限公司,二抗购自北京中杉金桥生物技术有限公司,蛋白质分子量Marker购自美国Biorad。
1.1.2流感病毒甲型流感病毒H1N1,A1/黔防/166/85株,中国中医科学院中药研究所提供,长期低温(-76 ℃)保存备用。于9日龄鸡胚尿囊腔连续传代2次后,病毒原液血凝滴度为1∶128,组织培养感染剂量(TCID)50=10-3.778。
1.1.3实验药物疏风宣肺方由金银花、连翘、牛蒡子、蝉蜕、荆芥、大青叶、淡豆豉、板蓝根、生甘草等组成;解表清里方由炙麻黄、生石膏、黄芩、杏仁、生甘草、紫苏叶、荆芥、独活、桔梗等组成。均由中日友好医院药厂经选料—去杂—工业提取—浓缩—干燥—制粒成颗粒,疏风宣肺方每包6.2 g,解表清里方每包7.3 g。磷酸奥司他韦胶囊(达菲,瑞士巴塞尔豪夫·迈罗氏有限公司,进口药品注册证号H20090377,分装批号SH0037)。
1.2实验方法
1.2.1细胞培养A549加细胞培养液经3~4次传代后,细胞恢复正常生长周期。将生长状态良好的细胞加入0.25%胰酶-0.02% EDTA消化细胞,洗脱后加入细胞培养液,调整细胞浓度为1.5×105/ mL,接种于60 mm培养皿中,在37 ℃、5%二氧化碳(CO2)培养箱中常规培养24 h后,使细胞呈单层贴于孔底。取增殖旺盛、状态良好的细胞用于实验。
1.2.2分组将培养的细胞分为5组,即细胞对照组(N组)、H1N1感染组(M组)、奥司他韦对照组(D组,浓度0.75 μg/mL)、疏风宣肺组(S组,浓度2.5 μg/mL)、解表清里组(J组,浓度2.5μg/ mL),每组8孔。除细胞对照组外,其余4组均用流感病毒H1N1吸附2 h后,H1N1感染组小心吸弃各孔病毒液,换用维持液继续培养;奥司他韦对照组、疏风宣肺组及解表清里组弃掉病毒液,磷酸盐缓冲液(PBS)清洗2次后,分别加入相应浓度药物作用24 h后弃去上清,PBS清洗1次后,加入细胞裂解液,置-80 ℃冷冻过夜,待检。
1.2.3基因芯片分析芯片实验由华联生物科技股份有限公司完成,包括3次生物学重复。在样本中提取各组细胞总mRNA后,在收集的样本中提取细胞总RNA,定量并鉴定其完整性,保证没有降解。RNA首先被反转录合成cDNA,用荧光染料Cy3和Cys双色荧光标记,检定荧光强度和标记效率,芯片杂交及扫描,实验重复3次,计算探针信号在各组与H1N1感染组的强度比值。查找基因信息功能及生物路径,筛选出炎症通路相关的差异表达基因。各组探针讯号的强度比值以log2(比值)表示。与H1N1感染组比较,log2(比值)>1,表示显著上调的表达基因;log2(比值)<-1,表示显著下调的表达基因。
1.2.4RT-PCR检测提取各组细胞总mRNA后,进行反转录。按试剂盒说明进行PCR反应。RT-PCR产物进行琼脂糖凝胶电泳。将凝胶置于紫外自动成像系统,启动自动分析软件,记录目的基因扩增条带的灰度值,并分别计算内参基因甘油醛-3-磷酸脱氢酶(GAPDH)值与各样本目的基因比值,统计目的基因表达的相对量,采用2-ΔΔCT方法计算[4]。
1.2.5Western blotting法检测相关蛋白表达收集细胞提取细胞总蛋白,测定蛋白浓度。样品上样,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),半干电转膜仪转膜。封闭后加入IL-1、TNF-α、IL-6、IL-10、MCP-1、RANTES一抗,4 ℃过夜。洗膜3次,加入漂洗液稀释的辣根过氧化物酶标记的二抗,振荡。将聚偏二氟乙烯(PVDF)膜于室温下振荡温育。增强化学发光法(ECL)显色,X线胶片曝光,经显影、定影、扫描后观察结果。应用 Image-Pro Plus 软件对扫描图像的目的条带进行吸光度分析各目的条带与GAPDH的吸光度比值为目的蛋白的相对表达量。
2结果
2.15组H1N1感染A549中IL-1、TNF-α、IL-6、IL-10、MCP-1、RANTES的mRNA转录水平比较见表1。
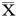
表1 5组H1N1感染A549中IL-1、TNF-α、IL-6、IL-10、MCP-1、RANTES的mRNA转录水平比较 ± s
由表1可见,与细胞对照组比较,H1N1感染组IL-1、TNF-α、IL-6、IL-10、MCP-1、RANTES的mRNA表达均显著升高(P<0.01)。与H1N1感染组比较,疏风宣肺组的IL-1、TNF-α、IL-6、IL-10、MCP-1的mRNA表达均明显降低(P<0.05,P<0.01),解表清里组IL-1、TNF-α、IL-6、MCP-1的mRNA表达均明显降低(P<0.05,P<0.01)。奥司他韦组IL-1、TNF-α、IL-6、IL-10、MCP-1、RANTES的mRNA表达均明显降低(P<0.01)。
2.2甲型流感病毒H1N1感染A549后炎症通路中基因转录的变化见表2。
由表2可见,与细胞对照组比较,H1N1感染组差异表达基因Il1β、Tnf、Ccl5、Il10、Il6、Ccl2明显上调。与H1N1感染组比较,奥司他韦组、疏风宣肺组和解表清里组均对差异基因Il1β、Tnf、Ccl5、Il10、Il6、Ccl2的表达有显著的下调作用。
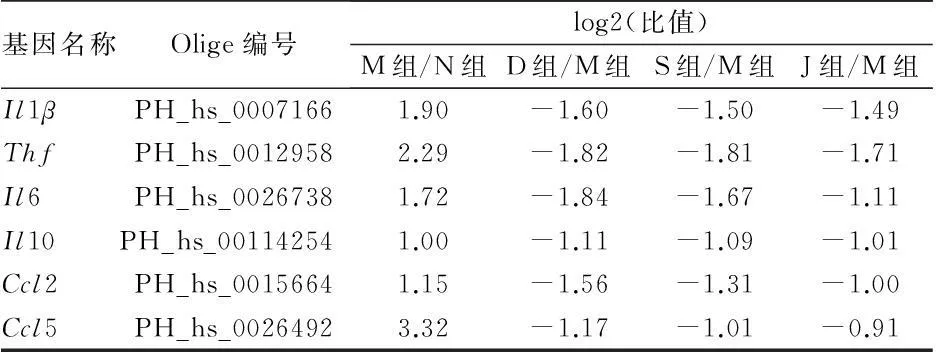
表2 甲型流感病毒H1N1感染A549后炎症通路中基因转录的变化
2.35组H1N1感染A549中IL-1、TNF-α、IL-6、IL-10、MCP-1、RANTES蛋白表达比较见图1。
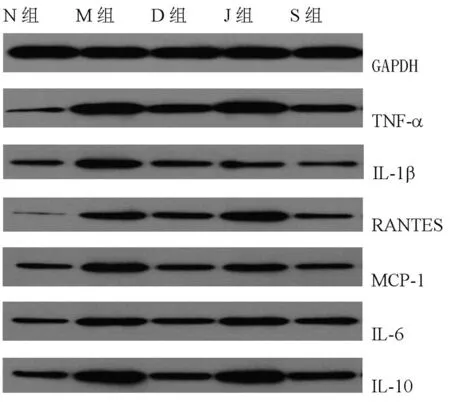
图1 5组H1N1感染A549中IL-1、TNF-α、IL-6、IL-10、MCP-1、RANTES蛋白表达比较
由图1可见,H1N1感染组的IL-1、TNF-α、IL-6、IL-10、MCP-1、RANTES蛋白表达较细胞对照组显著升高(P<0.05)。与H1N1感染组比较,疏风宣肺组、解表清里组及奥司他韦组IL-1、TNF-α、IL-6、IL-10、MCP-1、RANTES蛋白表达均显著降低(P<0.05,P<0.01)。
3讨论
流感属中医学“时行感冒”范畴,以外感风寒为外因,易入里化热、内蕴热毒为内因。临床表现为咳嗽、头痛、鼻塞、流涕、恶寒发热、全身不适等症状。疏风宣肺方是以银翘散为基础方加减而成,既能疏风宣肺,又能清热化痰,临床上用于治疗感冒属风热袭肺者。解表清里方是以麻杏石甘汤合防风通圣散为基础方加减而成,既能发汗解表,又能清里热,临床上用于治疗感冒属风热壅盛、表里俱实者[5]。前期体内实验研究表明,疏风宣肺方和解表清里方可降低病毒性肺炎小鼠的肺指数,改善流感病毒感染小鼠肺组织病理损伤,有抗流感病毒的作用[6]。
为了更好地对比2种方药的治疗效果,本体外实验观察表明,流感病毒H1N1感染A549后,H1N1感染组细胞因子IL-1、TNF-α、IL-6、IL-10、MCP-1、RANTES的mRNA和蛋白表达较细胞对照组均有上升趋势,这可能与流感病毒感染后免疫应激有关。正常状态下,流感病毒诱导并释放流感病毒免疫炎性细胞因子,促进局部炎症反应而发挥抗病毒作用。但当病毒毒力过强,免疫病理损伤是流感病毒感染后的重要致病机制,表现为促炎细胞因子IL-1、TNF-α、IL-6水平明显升高,以及前炎症因子 RANTES、MCP-1α、MCP-1过度释放。疏风宣肺方和解表清里方干预后,IL-1、TNF-α、IL-6、MCP-1的mRNA和蛋白水平降低,病理损伤减轻,对靶器官有较强的免疫保护作用。同时,疏风宣肺方能降低IL-10高水平表达,抑制其与促炎因子发生的过度反应,提高炎性细胞因子对流感病毒刺激的反应性,增强和延长辅助性T2细胞(Th2)类细胞因子的产生,激活宿主免疫调节[7]。
疏风宣肺方和解表清里方多选用清热解毒药物组方,具有良好的抗炎和免疫调控作用。疏风宣肺方方中金银花提取物可有效抑制甲型流感病毒FM1株体外增殖,对感染流感病毒鸡胚具有预防和保护治疗作用[8];连翘可抑制甲型流感病毒核蛋白(NP)与病毒RNA结合形成NP复合物而阻碍流感病毒复制[9];大青叶具有明显的体外阻止H1N1流感病毒增殖作用[10];板蓝根能抑制TNF-α的过度表达[11]。解表清里方方中石膏、甘草、黄芩三药合用,将“清、透、解”融为一体,清气透邪解毒,使毒邪从上、从表而出,从而达到排除毒素、退热,并治疗流感的目的[12]。综上所述,疏风宣肺方和解表清里方在体外均有直接抗炎、抗病毒作用,为下一步研究其抗流感病毒的作用机制和作用环节奠定了基础。
参考文献
[1]闫章才,薛丽香,李国才,等.流行性感冒防控基础研究状况及关键科学问题分析[J].中国科学:生命科学,2014,44(1):101-106.
[2]Wu S,Yang P,Li H,et al.Influenza vaccination coverage rates among adults before and after the 2009 influenza pandemic and the reasons for non-vaccination in Beijing,China:A cross-sectional study[J].BMC Public Health,2013,13(8):636.
[3]余小萍,傅慧婷.中医药防治流感的免疫调节机制的研究概况[J].辽宁中医杂志,2006,33(8):1044-1046.
[4]Arocho A,Chen B,Ladanyi M,et al.Validation of the 2-DeltaDeltaCt calculation as an alternate method of data analysis for quantitative PCR of BCR-ABL P210 transcripts[J].Diagnostic Molecular Pathology,2006,15(1):56-61.
[5]卢娜娜.两种不同治法方药对流感病毒感染小鼠差异基因调控作用的研究[D].北京:北京中医药大学,2014.
[6]刘琪,顾立刚,周旭澎,等.疏风宣肺及解表清里方药对流感病毒感染小鼠肺损伤的保护研究[J].中华中医药杂志,2013,28(7):2132-2134,插1.
[7]卢娜娜,刘琪,顾立刚,等.流感病毒性肺炎小鼠肺组织炎性细胞因子表达及疏风宣肺方和解表清里方的调控作用[J].细胞与分子免疫学杂志,2014,30 (3):254-257.
[8]潘曌曌,王雪峰,南春红,等.银翘散主要药物提取物体外抑制流感病毒作用的比较研究[J].中医儿科杂志,2011,7(1):9-12.
[9]段林建,张清,王农荣,等.连翘苷对甲型流感病毒核蛋白基因表达的影响研究[J].中国全科医学,2012,15(18):2082-2084.
[10]许涛,梁剑平,余四九,等.大青叶中4(3H)喹唑酮体外抗H1N1型流感病毒的作用研究[J].中国兽医医药信息杂志,2008,27(3):7-9.
[11]杨海霞,李晓眠.板蓝根提取液体内抗流感病毒作用的研究[J].天津医科大学学报,2007,13(1):19-22.
[12]徐红日,王成祥,沈杏生,等.清热解毒中药对流感病毒FM1株感染所致小鼠肺组织病理损伤的影响[J].环球中医药,2011,4(3):161-167.
(本文编辑:曹志娟)
