非水相酶促合成阿魏酸酯及其对自由基的清除
2016-01-03陈林林辛嘉英
陈林林 李 伟 辛嘉英,2
非水相酶促合成阿魏酸酯及其对自由基的清除
陈林林1李 伟1辛嘉英1,2
(哈尔滨商业大学省高校食品科学与工程重点实验室1,哈尔滨 150076)
(中国科学院兰州化学物理研究所羰基合成与选择氧化国家重点实验室2,兰州 730000)
在非水相反应体系中,研究脂肪酶Novozym 435催化合成阿魏酸油酸甘油酯。得出酶促合成反应的最佳溶剂为甲苯,摇床转速200 r/min,脂肪酶添加量与底物质量比为10%,反应温度55℃,底物阿魏酸乙酯与三油酸甘油酯的摩尔比为1∶2,反应体系初始水活度应控制为0.11,反应过程中分子筛添加量为10%。在此反应条件下,反应120 h后产物最高产率可达56.63%。经过6个批次反应后,阿魏酸油酸甘油酯的产率降至41.08%,脂肪酶相对酶活保持在50%以上。通过考察阿魏酸酯对自由基的清除能力,发现产物阿魏酸单油酸甘油酯对DPPH·清除的IC50值仅为0.006 6 mg/mL,清除能力高于阿魏酸乙酯及阿魏酸双油酸甘油酯;阿魏酸双油酸甘油酯对O2·-的清除能力与VC相当,显示了其对核黄素氧化较好的抑制效果。
非水相 脂肪酶 阿魏酸油酸甘油酯 自由基
阿魏酸分子中的烷烃较短且含有双键,在水相和有机相中的溶解度均较低,难以深入生物膜脂质双分子层结构中而发挥抗氧化作用,同时这也限制了其在脂溶性食品加工中的应用,因此将其酯化合成一些脂溶性阿魏酸衍生物的研究引起了广大研究学者的兴趣[1-2]。研究发现,经过化学改性得到的阿魏酸酯比阿魏酸有着更强的生理活性和抗氧化性。Lee等[3]以Novozym 435为催化剂合成具有有效地防止油脂发生自动氧化作用的阿魏酸乙酯。Chigorimbo-Murefu等[4]将醋酸乙烯酯与阿魏酸通过直接酯化合成阿魏酸乙烯酯,在Novozyme 435脂肪酶催化作用下,通过转酯反应合成阿魏酸辛酯和阿魏酸固醇酯,所有合成后的酯的抗氧化活性均高于前体阿魏酸。
本研究将通过酯交换法采用脂肪酶催化合成阿魏酸油酸甘油酯。阿魏酸油酸甘油酯包括阿魏酸双油酸甘油酯(ferulyl diolein,FDO)和阿魏酸单油酸甘油酯(ferulyl monoolein,FMO),它既能保持阿魏酸的生理活性,又将克服阿魏酸分子本身亲水性强难以在油品中发挥其功效的弊端,还可以保持甘油酯优良性能,是一种具有多种活性的双功能分子。酶法合成将克服化学合成法副产物多、过程复杂、反应条件苛刻、环境污染严重、某些化合物难以合成等缺点。因此可以广泛应用在食品、药品及化妆品行业[5]。本研究将进行阿魏酸油酸甘油酯对自由基清除能力的测定,从而推测合成后产物的抗氧化性能,以期实现BHA(丁基羟基茴香醚)和BHT(二丁基羟基甲苯)等的代替,成为新型的天然油脂抗氧化剂。
1 材料与方法
1.1 材料与试剂
固定化南极假丝酵母脂肪酶Novozym 435(L4777,10 000 U/g):丹麦Novozymes A/S 公司;阿魏酸、阿魏酸乙酯(ethyl ferulate,EF)标准品(纯度>95%):苏州畅通化学有限公司;三油酸甘油酯(Triolein,TO):国药集团化学试剂有限公司;4Å分子筛购于大连催化剂厂;甲醇(色谱纯)购于Fisher公司;甲苯、苯、乙醚、二氯甲烷、正己烷、正丁醇、异丁醇、异戊醇、氯化锂、氯化镁、溴化钠、氯化钠、硝酸钾均为分析纯:哈尔滨新春化工厂。
1.2 主要仪器
KH-2000型薄层色谱扫描仪:上海科贺生化科技有限公司:TB-Ⅱ型全自动薄层制板器:上海科贺生化科技有限公司;SP-Ⅱ型薄层电动点样器:上海科贺生化科技有限公司。
1.3 试验方法
1.3.1 非水相酶促转酯反应
在25 mL具塞三角瓶分别加入1 mmol阿魏酸乙酯,2 mmol三油酸甘油酯和5.0 mL有机溶剂后加入110 mg的Novozym435脂肪酶,在一定温度条件下摇床振荡反应120 h,定时取样分析,计算反应产率。具体实验条件由反应体系因素的不同有所改变。
1.3.2 反应体系水活度的控制
转酯反应体系中水分的控制是影响酶活性的重要因素[6-7]。反应使用的底物(TO、EF)、酶和有机相均按参考文献[8]的方法采用饱和盐溶液预平衡法对反应初期的水活度进行控制。反应开始前,在温度为25℃的条件下,将固定化脂肪酶、底物EF和TO及有机相分别置于盛有不同盐饱和水溶液的密闭容器中,气相平衡5 d以上,以使酶与底物的水活度和饱和盐溶液的水活度相同。试验中所用的盐包括:LiCl饱和盐溶液(aw∶0.11),MgCl2饱和盐溶液(aw∶0.33),NaBr饱和盐溶液(aw∶0.57),NaCl饱和盐溶液(aw∶0.75),KNO3饱和盐溶液(aw∶0.94)。试验中以4Å分子筛(aw<0.01)控制水活度方法作比较。
1.3.3 产物检测与分离
采用薄层层析(TLC)分析每隔一定的时间吸取2.5μL的反应混合物进行反应进程监测。将反应样品和对照样品分别在GF 254硅胶板上点样,展开剂根据筛选的最佳溶剂组分[9]之间的配比为正己烷∶苯∶二氯甲烷∶乙醚(0.2∶3∶5∶2)(体积比),展开距离为10.5 cm,254 nm紫外光下观察,监测产物阿魏酸双油酸甘油酯(FDO)和阿魏酸单油酸甘油酯(FMO)、底物阿魏酸乙酯(EF)、副产物阿魏酸(FA)和阿魏酸甘油酯(ferulyl glycerol,FG)的含量变化。根据薄层层析的展开条件和分离效果,对反应后滤去酶的反应液进行硅胶柱分离纯化,硅胶柱(40 cm×5 cm),分别按照洗脱剂为正己烷,正己烷∶苯∶二氯甲烷(1∶4∶5)、正己烷∶苯∶二氯甲烷∶乙醚(0.2∶4∶5∶1)的顺序洗脱,收集各部分洗脱液旋转蒸发后可得到淡黄色目标产物FDO和FMO。
利用高效液相色谱(HPLC)进行定量分析,色谱柱:XDB -C18(4.6 mm ×150 mm,5 μm);流动相:溶剂A(0.1% 醋酸溶液)和溶剂B(100% 甲醇),梯度洗脱:0 min时50%A +50%B,2 min时100%B+0%A,保持3 min;流速为1 mL/min;样品经甲醇稀释20倍,进样量10μL;检测波长:325 nm;检测温度:30℃。
根据报道[10-12],阿魏酸系列化合物在反应过程中的峰面积总和保持恒定,因此阿魏酸油酸甘油酯产率按各物种峰面积进行计算:
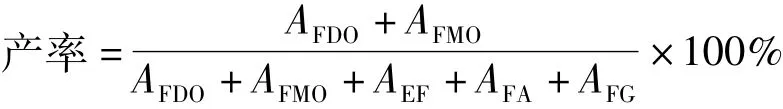
式中:AFDO、AFMO分别为产物阿魏酸双油酸甘油酯和阿魏酸单油酸甘油酯的峰面积;AEF为底物阿魏酸乙酯的峰面积;AFA和AFG分别为副产物阿魏酸和阿魏酸甘油酯的峰面积。
1.3.4 脂肪酶活力测定方法
采用橄榄油乳化法[13]。
1.3.5 阿魏酸油酸甘油酯对自由基清除能力测定
1.3.5.1 DPPH自由基清除能力测定
DPPH·浓度标准曲线:配制DPPH·溶液浓度分别为:0.05、0.10、0.15、0.20、0.25 mmol/L,在515 nm处以试剂空白为参比,测定吸光值,确定吸光值与DPPH·的定量关系。以浓度-吸光值进行回归,绘制标准曲线,求得回归方程:A=12.645C-0.241 9,C 为DPPH·质量浓度(mg/mL),A 为吸光值,相关系数r=0.999,表明在该浓度范围内线性关系良好。
阿魏酸油酸甘油酯对DPPH·清除能力的方法依据文献[14]:DPPH·反应测定体系包括DPPH自由基、甲醇和测定样品,测定样品包括阿魏酸(FA),阿魏酸乙酯(EF),产物阿魏酸单油酸甘油酯FMO和阿魏酸双油酸甘油酯FDO,以BHT和VE为对照。将DPPH·用甲醇溶解配制成6×10-5mol/L的溶液。取定容后待测样甲醇溶液0.1 mL及DPPH·溶液3.9 mL加入到同一具塞试管中,摇匀。515 nm测定清除DPPH·反应体系的吸光值Asample,直到反应达到平衡。同时测定反应30 min后6×10-5mol/L DPPH·溶液与0.1 mL甲醇混合后吸光度Acontrol以及0.1 mL测定样液与3.9 mL甲醇混合后的吸光度Ablank。绘制DPPH·清除率对测定样品浓度曲线,由曲线读取出DPPH自由基清除率为50%时所需测定样品浓度(C50)计算IC50。以IC50值反映样品的抗氧化与自由基清除活性,IC50值表示当清除率为50%时,抗氧化剂的浓度值。IC50值越高,抗氧化剂的自由基清除能力越强。
1.3.5.2 超氧阴离子(O2-·)自由基清除能力测定
采用光照核黄素体系产生O2-·,依据具有抗氧化活性的物质抑制氯化硝基四氮唑蓝(NBT)在光下的还原作用来确定抑制O2-·活性大小。测定方法[15]:用pH 7.8的0.05 moI/L混合磷酸盐缓冲液为溶剂,配制含3 ×10-6mol/L 核黄素,0.02 mol/L 蛋氨酸和1×10-4mol/L氯化硝基四氮唑蓝,总体积3.0 mL混匀后在25℃,4 000 Lx照度下光照30 min,于560 nm处测定溶液的吸光值。按公式计算清除率:

式中:A0为空白的吸光值;A1为样品的吸光值。
2 结果与分析
2.1 反应产物分析
将脂肪酶Novozym 435催化转酯后的反应液进行高效液相色谱分析。其液相色谱图如图1、图2所示。
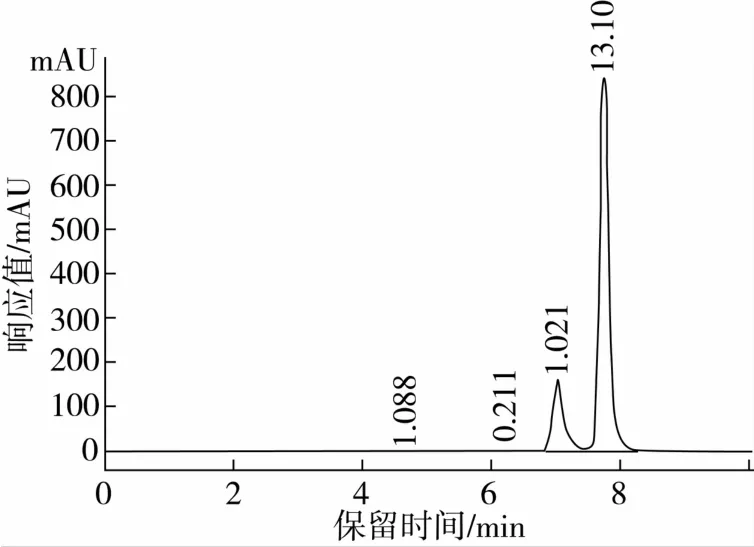
图1 阿魏酸和阿魏酸乙酯混标液相色谱图
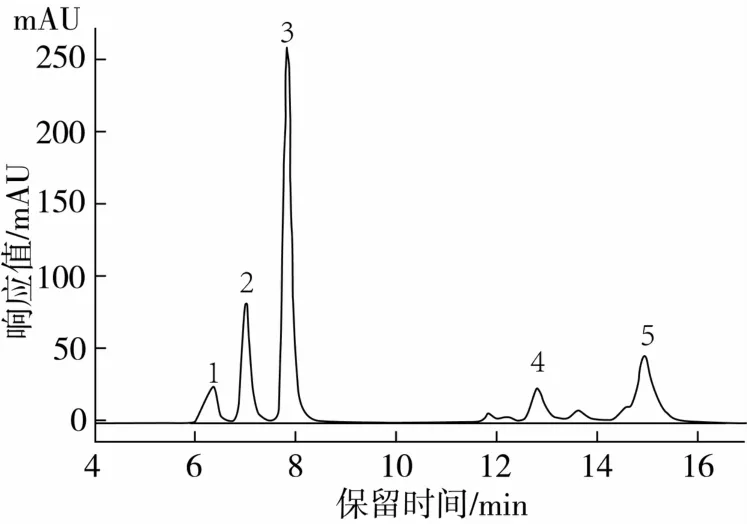
图2 Novozym 435脂肪酶催化转酯反应的液相色谱图
对照图1、图2可知,转酯反应图2中的2号和3号峰为阿魏酸和阿魏酸乙酯;从疏水性大小判断推测1号峰为极性最强的阿魏酸甘油酯、4号峰为阿魏酸单油酸甘油酯、5号峰为阿魏酸双油酸甘油酯。
2.2 非水相体系催化转酯反应
2.2.1 有机溶剂种类对转酯反应的影响
分别测定二甲基亚砜、异丁醇、正丁醇、异戊醇、甲苯、正己烷等有机溶剂对反应初速度和产率的影响,结果见表1。随着有机溶剂极性的增大,反应产率呈现先上升后下降的趋势。结果表明,二甲基亚砜虽然对底物阿魏酸具有较好的溶解性,但极性较大,剥夺了酶的“必需水”,导致脂肪酶迅速失活而无催化反应发生;在正己烷中,由于阿魏酸乙酯的不溶性,与酶接触困难,导致产率极低;而在极性较小的甲苯中,脂肪酶稳定性保持的很好,而且能使底物阿魏酸乙酯完全溶解,阿魏酸油酸甘油酯的产率可达到37.39%。因此,确定甲苯作为理想的反应介质。这个结果与Yadav等[16]研究乙酰乙酸甲酯与正丁醇转酯反应有机相选择的结果一致。
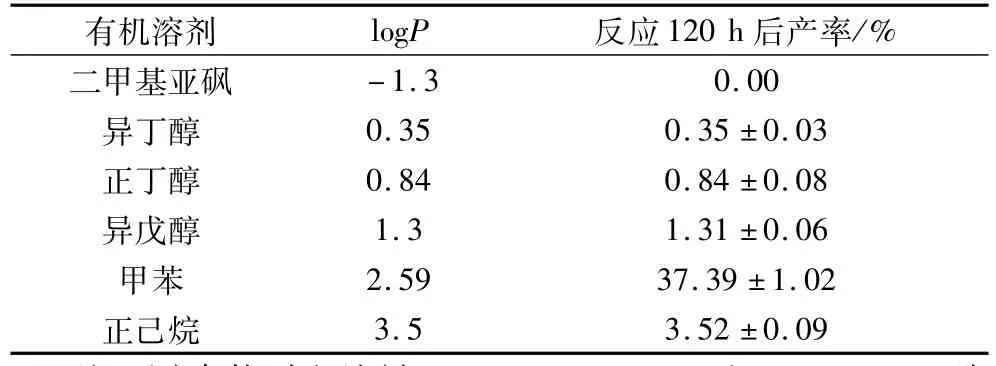
表1 有机溶剂对脂肪酶催化合成阿魏酸油酸甘油酯产率的影响
2.2.2 反应体系条件对转酯反应的影响
对反应体系条件:摇床转速、脂肪酶添加量、反应温度和底物比对转酯反应的影响如图3~图6所示。
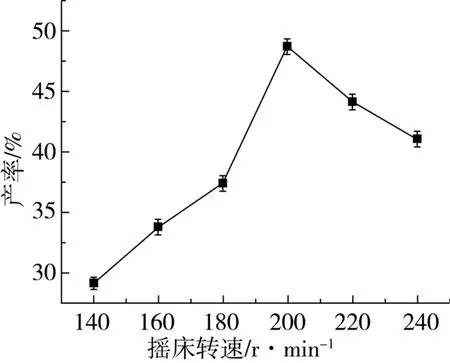
图3 摇床转速对转酯反应的影响
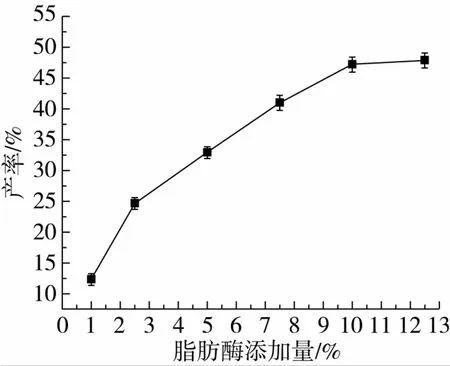
图4 脂肪酶添加量对转酯反应的影响
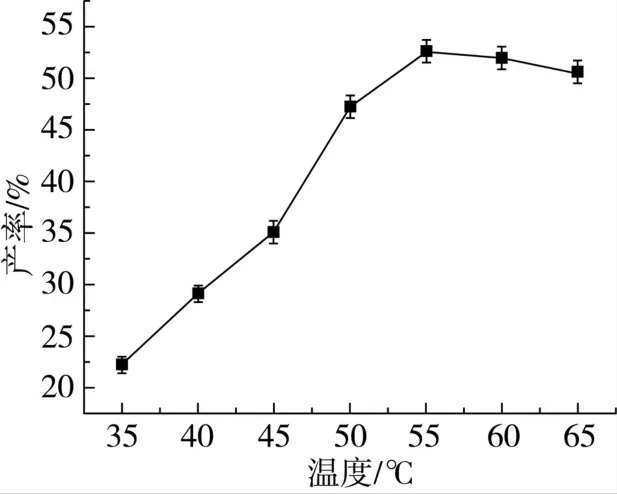
图5 反应温度对转酯反应的影响
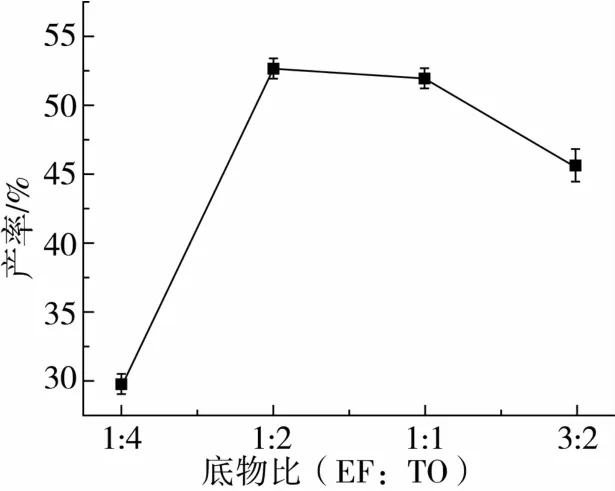
图6 底物比对转酯反应的影响
确定转酯反应的为摇床转速200 r/min,Novozym 435脂肪酶加入量与底物质量比10%,温度为55℃,底物阿魏酸乙酯与三油酸甘油酯的摩尔比为1∶2。
2.2.3 反应初始水活度的影响
在不同的初始水活度(<0.01~0.94)下进行转酯反应,进一步考察反应初始水活度对转酯反应有影响。反应72 h后测定产率,结果如图7所示。在使用不同盐的饱和水溶液来预平衡时,当控制初始水活度为0.33时,可获得最高产率。这可能是适当水分子的存在降低了酶分子内部强极性基团间的静电相互作用,使酶分子具有足够的柔性,能够处于催化作用所必需的构象状态。与4Å分子筛(aw<0.01)相比,虽然提高水活度有利于产物阿魏酸油酸甘油酯的形成,但随着水活度的增加,阿魏酸乙酯水解副产物阿魏酸随之增加,阿魏酸乙酯的水解率明显提高。当反应体系的水活度为0.11时,能够保证产率的同时,还可以防止体系由于水分的增加而带来的底物水解。
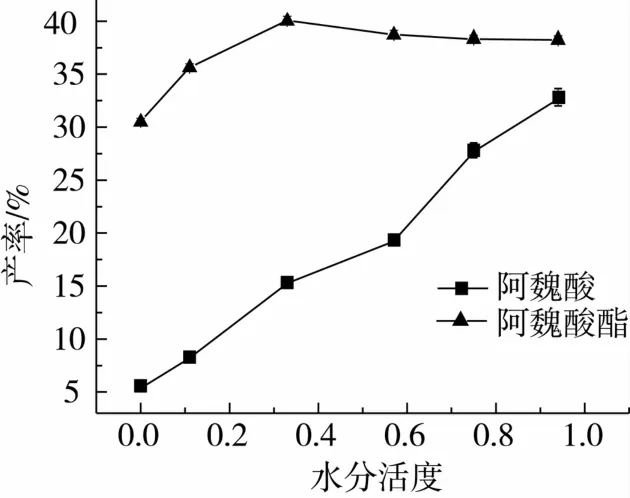
图7 初始水分活度对转酯反应的影响
2.2.4 分子筛添加量对转酯反应的影响
待反应72 h后,通过向反应体系中添加4Å分子筛控制水分活度,保持体系含水量恒定,并可以吸附反应过程中产生的乙醇[17],加快反应进行,结果如图8所示。若不加分子筛,反应最终产率只有35.60%,而当分子筛添加量增加到10%时,产率迅速增加;当分子筛添加量大于10%时,反应产率开始变化不大;当分子筛添加量超过20%时,反应产率开始下降较快,说明过量的分子筛,争夺酶催化合成所必需的水,导致酶的部分失活所致。因此,分子筛添加量以10%为宜。
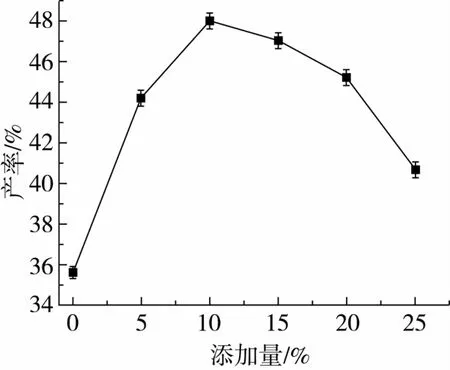
图8 分子筛添加量对转酯反应的影响
2.2.5 批式反应操作稳定性对转酯反应的影响
在最适的反应条件下,随着反应批次的进行,固定化脂肪酶Novozym 435的相对活性及对转酯反应产率的影响见图9。随着反应批数的增加酶的相对活性逐渐降低,一方面是由于每次洗涤干燥的过程中酶的变性失活引起,另一方面可能是酶从固定载体上脱落所致。经过6个批次反应后,阿魏酸油酸甘油酯的产率由56.63%降至41.08%,变化较小,脂肪酶相对酶活保持在50%以上,说明整个反应体系在优化条件下具有较好的操作稳定性。
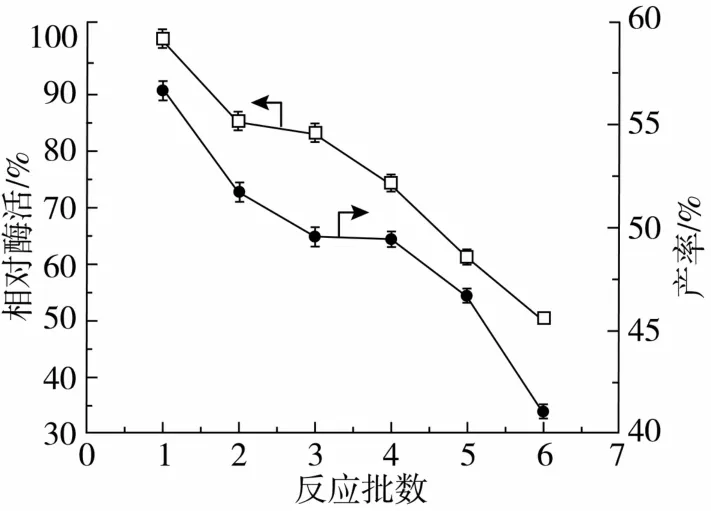
图9 Novozym 435脂肪酶的批式操作稳定性
2.3 阿魏酸油酸甘油酯对自由基的清除作用
2.3.1 对DPPH自由基清除作用
测定样品FA、EF、FMO、FDO以及BHT和VE的浓度为20μmol/L对DPPH·清除体系中反应持续50 min,清除结果如表2所示。
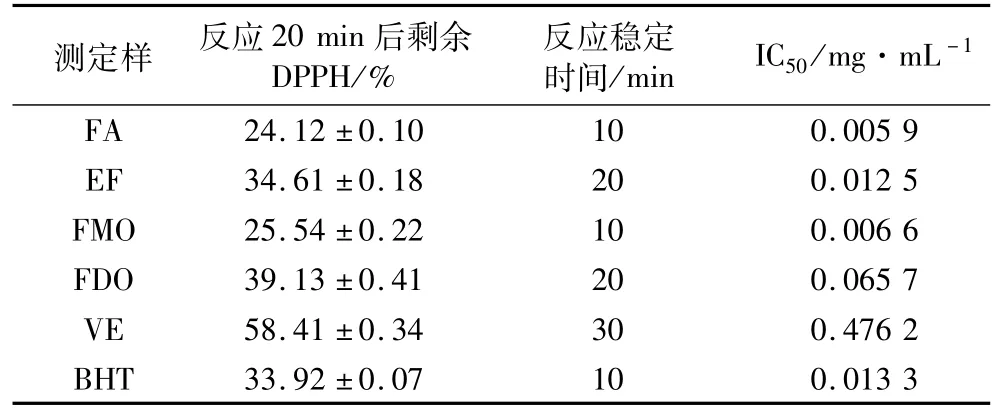
表2 对DPPH·清除能力测定
由表2可知,在清除反应中,测定试样反应20 min后剩余DPPH量相差较大,FA仅为24.12%,FMO与FA相差不大。EF与BHT的清除能力区别不明显,但BHT达到反应平衡的时间较短;FA、FMO到达反应平衡时间最快。清除能力由大到小的排序为:FA>FMO>EF>BHT>FDO>VE。IC50值越低表明抗氧化剂的清除能力越强,FMO的IC50值为0.006 6 mg/mL,抗氧化能力好于FDO,原因在于FDO结构中双油酸的取代,甘油上的羟基全部被取代,使分子的极性更低,因此不利于直接抽氢反应(氢原子转移反应,HAT)反应的发生所致。
2.3.2 对超氧阴离子(O2-·)自由基清除作用
不同浓度的FA、EF、FMO、FDO以及VC等测定样品对光照核黄素体系产生O2-·的清除作用结果如表3所示。
由表3可以看出,在光照核黄素体系中,FMO显示了最佳的清除能力。在试验剂量范围内,抑制剂与光照核黄素氧化速率的抑制呈明显的量效关系,由IC50值可知,FDO在此核黄素体系中的清除能力与VC相当,显示了其对核黄素氧化较好的抑制效果。清除能力由大到小的排序为:FMO>FA>BHT>EF>FDO>VC。
表3 对光照核黄素体系产生·的清除效果
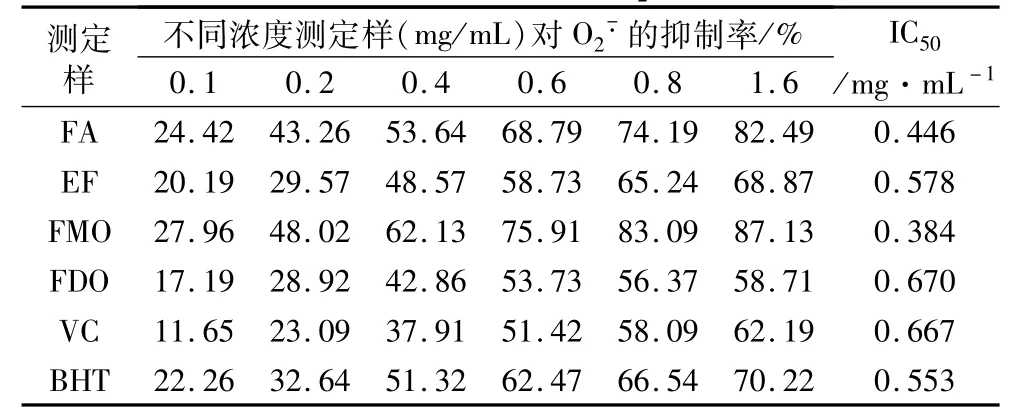
表3 对光照核黄素体系产生·的清除效果
注:IC50=O2-·被清除50%时抗氧化剂的质量浓度。
测定样不同浓度测定样(mg/mL)对O2-·的抑制率/%0.1 0.2 0.4 0.6 0.8 1.6 IC50/mg·mL -1 FA 24.42 43.26 53.64 68.79 74.19 82.49 0.446 EF 20.19 29.57 48.57 58.73 65.24 68.87 0.578 FMO 27.96 48.02 62.13 75.91 83.09 87.13 0.384 FDO 17.19 28.92 42.86 53.73 56.37 58.71 0.670 VC 11.65 23.09 37.91 51.42 58.09 62.19 0.667 BHT 22.26 32.64 51.32 62.47 66.54 70.22 0.553
3 结论
研究了Novozym 435脂肪酶在非水相体系中催化阿魏酸乙酯与三油酸甘油酯合成阿魏酸双油酸甘油酯和阿魏酸单油酸甘油酯,非水相中转酯反应产物产率可达56.63%。反应体系初始水活度采用饱和盐对预平衡法控制在0.11。脂肪酶经过6次批式反应后的相对活性较好,对产物的合成影响不明显。本研究确立了阿魏酸油酸甘油酯非水相酶法合成反应条件,通过产物清除自由基能力的确定,为2种产物在食品添加剂中应用的提供了参考。
[1]Stamatls H,Seretlv,Kolisis F N.Enzymatic synthesis of hydrophilic and hydrophobic derivatives of natural phenolic acids in Organic media[J].Journal of Molecular Catalysis B:Enzymatic,2001,11:323 -328
[2]Ferreira P,Diez N,Faulds CB.Release of ferulic acid and feruloylated oligosaccharides from sugar beet pulp by Streptomyces tendae[J].Bioresource Technology,2007,98(8):1522-1528
[3]Lee G S,Widjaja A.Enzymatic synthesis of cinnamic acid derivatives[J].Biotechnology Letters,2006,28:581 -585
[4]Chigorimbo-Murefu N T L,Riva S,Burton SG.Lipasecatalysed synthesis of esters of ferulic acid with natural compounds and evaluation of their antioxidant properties[J].Journal of Molecular Catalysis B:Enzymatic,2009,56,277-282
[5]Asao H.Syntheses of ferulic acid derivatives and there suppressive effects on cyclooxygenase -2 promoter activity[J].Bioorganic and Medicinal Chemistry,2002,10(4):1189 -1196
[6]Irimescu R,Iwasaki Y,Hou C T.Study of TAG ethanolysis to 2-MAG by immobilized Candida antarctica lipase and synthesis of symmetrically structured TAG[J].Journal of the American Oil Chemists Society,2002,79:879-883
[7]Lundhaug K,Overbeeke PL A,Jonge JA,et al.Organic co-solvents restore the inherently high enantiomeric ratio of lipase B from Candida antarctica in hydrolytic resolution by relieving the enantiospecific inhibition of product alcohol[J].Tetrahedron:Asymmetry,1998,9(16):2851 -2855
[8]Wehtje E,Costes D,Adlercreutz P.Enantioselectivity of lipases:Effects of water activity[J].Journal of Molecular Catalysis B:Enzymatic.1997,3:221-230
[9]辛嘉英,梁宏野,陈林林,等.均匀设计法优化α-生育酚阿魏酸酯薄层色谱展开剂系统[J].食品工业科技,2009,30(12):179-181
Xin Jiaying,Liang Hongye,Chen Linlin,et al.Optimization of the TLC solvent system of alpha-tocopheryl ferulater by the uniform experimential design[J].Science and Technology of Food Industry,2009,30(12):179 -181
[10]Compton D L,Laszlo J A.Lipase- catalyzed synthesis of ferulate esters[J].Journal of the American Oil Chemists Society,2000,77(5):513 -519
[11]Laszlo J A,Compton D L,Eller F,et al.Packed - bed bioreactor synthesis of feruloylated monoacyl and diacylglycerols:clean production of a “green”sunscreen[J
].Greem Chemistry,2003,5:382-386
[12]Laszlo JA,Compton D L.Enzymatic glycerolysis and transesterification of vegetable oil for enhanced production of feruloylated glycerols[J].Journal of the American Oil Chemists Society,2006,83(9):765 -770
[13]胡坤,韩亚杰,代斌.猪胰脂肪酶固定化载体的优化[J].安徽农业科技,2009,37(15):6865-6868
Hu Kun,Han Yajie,Dai Bin.Research on the Optimization of Immobilized Vector of PPL[J].Journal of Anhui Agricultural Sciences,2009,37(15):6865 -6868
[14]Brand-Williams W,Cuvelier M E,Berset C.Use of a free radical method to evaluate antioxidant activity[J].Lebensmittel-Wissenschaft und-Technologie,1995,28:25-30
[15]Charles B,Irwin F.Superoxide Dismutase:Improved assays and an assay applicable to acrylamide gels[J].Analytical Biochemistry,1971,44:276-287
[16]Yadav G D,Lathi P S.Lipase catalyzed transesterification of methyl acetoacetatewith n - butanol[J].Journal of Molecular Catalysis B:Enzymatic,2005,32:107-113
[17]胡婉男.脂肪酶Candida Antarctic B催化合成碳酸甘油酯的研究[D].无锡:江南大学,2009:20-21
Hu Wannan.Study on the synthesis of glycerol Carbonate catalyzed by Candida[D].Wuxi:Jiangnan University,2009:20 -21.
Enzymatic Synthesis in Nonaqueous Medium and Free Radical Scavenging Ability of Ferulyl Oleins
Chen Linlin1Li Wei1Xin Jiaying1,2
(Local Key Laboratory of Food Science and Engineering,Harbin University of Commerce1,Haerbin 150076)
(China State Key Laboratory of Oxo Synthesis& Selective Oxidation Lanzhou Institute of Chemical Physics,Chinese Academy of Sciences2,Lanzhou 730000)
The synthesis of ferulyl oleins catalyzed by lipase Novozym 435 in non-aqueous reaction system was studied.The optimal solvent was determined as toluene.The shaking speed was 200 r/min.The amount of molecular sieves was 10%,reaction temperature was 55℃.Under the optimum conditions,a maximum yield of 56.63%of ferulyl oleins was obtained using 1∶2 molar ratio of ethyl ferulate to triolein catalyzed by 10% (m/m,the ratio to substrate)of lipase with 0.11 of initial water activity at 55 ℃ under the rotation speed of 200 r/min for 120 h.The yield reduced to 41.08%and the relative activity of lipase remained 50%after 6 cycles batchwise reaction.The free radical scavenging ability of ferulyl oleins were evaluated.It was indicate that IC50of scavenging effect of ferulyl monoolein on DPPH·was only up to 0.006 6 mg/mL.The free radical scavenging ability of ferulyl monoolein was higher than that of ethyl ferulate and ferulyl diolein.The inhibition of ferulyl diolein had showed better effect on riboflavin oxidation and the scavenging ability of ferulyl diolein on O2-·was similar to VC.
nonaqueous medium,lipase,ferulyl oleins,free radical
TQ645.6
A
1003-0174(2016)07-0120-06
国家自然科学基金(21073050),哈尔滨市应用技术研究与开发(2014RFQXJ115)
2014-11-21
陈林林,女,1979年出生,副教授,食品科学
