饲料氧化鱼油对草鱼(Ctenopharyngodon idellus)肠道谷胱甘肽/谷胱甘肽转移酶通路基因表达活性的影响
2016-01-03林秀秀叶元土蔡春芳黄雨薇陈科全徐登辉罗其刚
林秀秀 叶元土 蔡春芳 吴 萍 黄雨薇 陈科全 彭 侃 徐登辉 罗其刚
饲料氧化鱼油对草鱼(Ctenopharyngodon idellus)肠道谷胱甘肽/谷胱甘肽转移酶通路基因表达活性的影响
林秀秀 叶元土 蔡春芳 吴 萍 黄雨薇 陈科全 彭 侃 徐登辉 罗其刚
(苏州大学基础医学与生物科学学院,苏州 215123)
为了研究饲料氧化鱼油对草鱼肠道抗氧化防御能力的影响,以谷胱甘肽/谷胱甘肽转移酶(GSH/GSTs)通路为研究对象,以豆油、鱼油、氧化鱼油为饲料脂肪源分别设计豆油组(6S)、鱼油组(6F)、2%氧化鱼油(2OF)、4%氧化鱼油(4OF)及6%氧化鱼油(6OF)5组等氮、等能半纯化饲料,在池塘网箱养殖草鱼[平均体重(74.8±1)g]72 d。采用荧光定量PCR(RT-QPCR)的方法,测定了草鱼肠道组织中谷氨酸-半胱氨酸连接酶催化亚(GCLC)、谷胱甘肽合成酶(GSS)和谷胱甘肽还原酶(GSR)以及谷胱甘肽S-转移酶的ω1(GSTω1)、PI-谷胱甘肽S-转移酶(GSTPI)和微粒体谷胱甘肽S-转移酶1(MGSt1)的表达活性,并测定了肠道中谷胱甘肽GSH的含量。结果显示,2OF、4OF和6OF组草鱼肠道中GSH/GSTs通路基因表达均上调,其中6F组中MSGT1在肠道中表达显著上调(P<0.05),4OF组中GSR和MGST1在肠道中表达显著上调(P<0.05),6OF中GCLC和MGST1在草鱼肠道中表达显著上调(P<0.05);GCLC表达活性与饲料中MDA含量呈多项式的关系,MGST1表达活性与饲料中AV和(EPA+DHA)呈多项式关系。结果表明,氧化鱼油使草鱼肠道GSH/GSTs通路基因表达活性上调,且GSH/GSTs通路基因表达活性对不同浓度氧化鱼油所引起的肠道氧化损伤具有不同的应对方式。
草鱼 肠道 氧化鱼油 谷胱甘肽 基因
脂类在水产动物中具有重要的生理作用[1]。鱼油因富含高不饱和脂肪酸是鱼类重要的油脂原料[2]。然而,鱼油氧化酸败能产生多种氧化产物,会破坏动物肠道组织细胞,损害动物生产性能及影响动物抗氧化能力[3]。因此,饲料中的鱼油对于养殖动物的作用具有二重性:一方面提供动物所需的高不饱和脂肪酸(必需脂肪酸)的营养作用;另一方面,由于氧化酸败而提供对鱼体健康具有损伤作用的氧化产物,其损伤程度与氧化产物种类、含量有直接的关系。
GSH/GSTs是动物重要的解毒、抗氧化系统[4],刘进[5]通过还原型GSH结合三联疗法治疗十二指肠球部溃疡,提高溃疡愈合质量。已证实了GSH具有调节仔猪和黄羽肉鸡的抗氧化能力[6],并且通过在饲料中添加GSH能提高草鱼、罗非鱼的生长性能以及机体自身的抗氧化能力[7-9]。GST是启动GSH结合反应的关键酶[10],它能够催化还原谷胱甘肽的硫醇基团与各种亲电化合物相结合,增加内源和外源有毒物质的可溶性而利于其排出体外。然而有关GSH/GSTs功能系统在水产动物中的报道非常有限。本研究采用荧光定量PCR技术,测定了草鱼摄食含有氧化鱼油饲料后肠道中GSH/GSTs通路基因表达活性,以揭示饲料氧化鱼油饲料对草鱼肠道免疫防御能力的影响。
1 材料与方法
1.1 饲料的制备
氧化鱼油来源及制备:豆油为“福临门”牌一级大豆油,鱼油来源于广东省良种引进服务公司生产的“高美牌”精炼鱼油,氧化鱼油为鱼油在实验室条件下氧化制备[11]。分别测定了3种油脂过氧化值(POV)、酸价(AV)和丙二醛(MDA)含量,并计算(饲料中POV、AV、MDA尚无有效监测方法),试验饲料中POV、AV、MDA值分别见表1。
饲料配制:以酪蛋白和秘鲁蒸汽鱼粉为主要蛋白源,采用等氮、等能方案设计基础饲料,设置了6%豆油组(简称6S组)、6%鱼油组(6F)、2%氧化鱼油+4%豆油组(2OF)、4%氧化鱼油+2%豆油组(4OF)、6%氧化鱼油组(6OF)作为脂肪源配制5组等氮等能的试验饲料。饲料组成成分见表2。各组蛋白质量分数为29.52%~30.55%,无显著差异;各组能量为19.943 ~20.860 kJ/g,无显著差异。
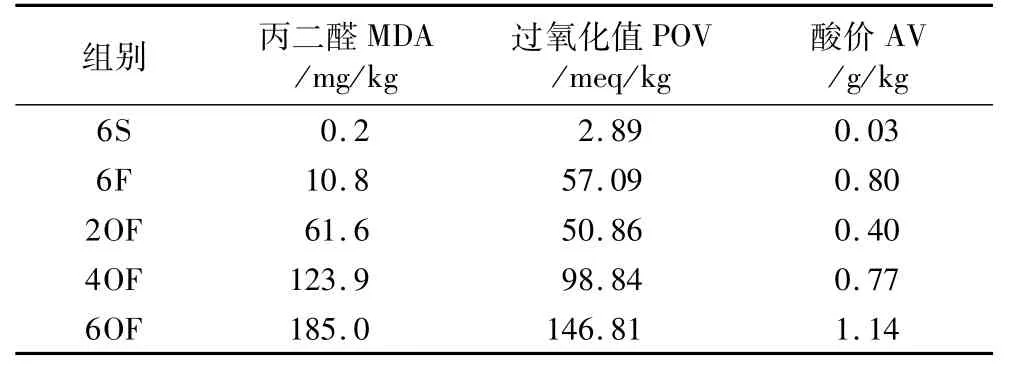
表1 试验饲料中POV值、AV值和MDA含量
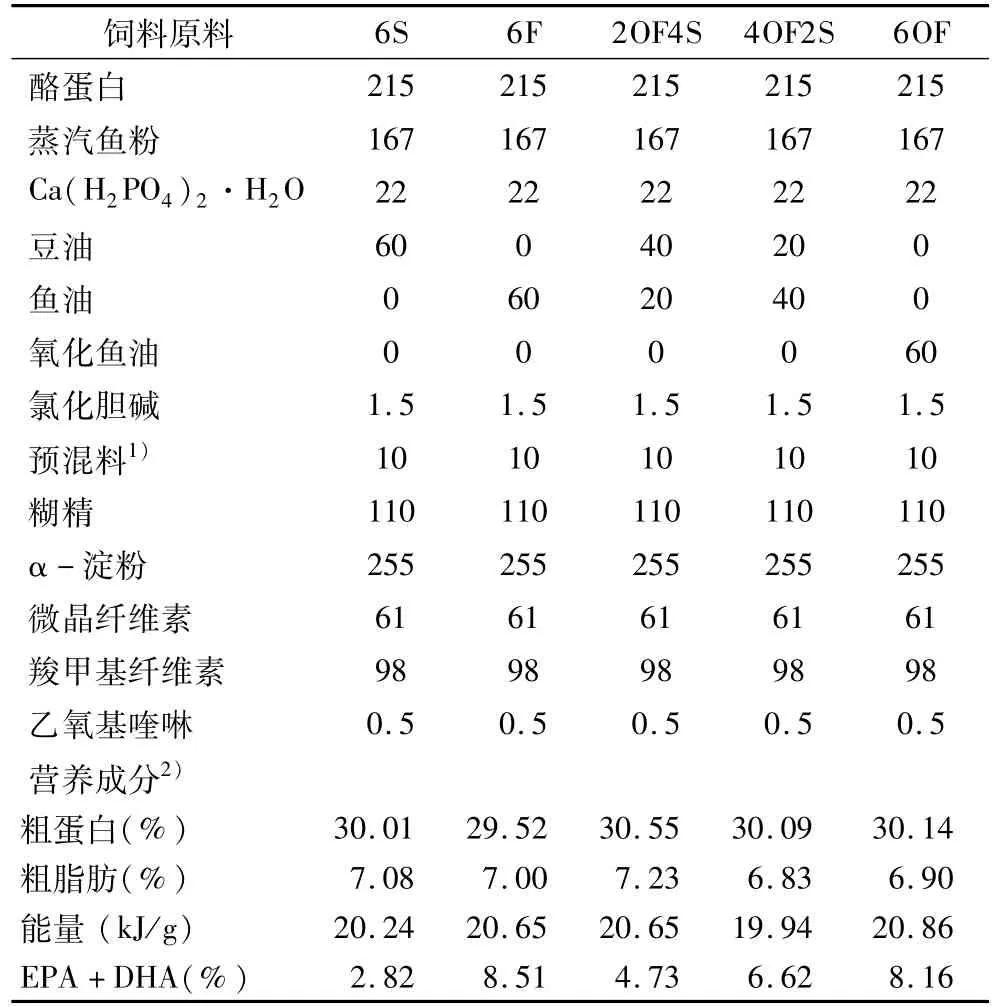
表2 试验饲料组成及营养水平(干物质基础)
1.2 试验鱼与饲养管理
草鱼来源于浙江一星饲料有限公司养殖基地,为池塘培育的1冬龄鱼种共350尾,平均体重为(74.8±1)g。草鱼随机分为5组,每组设3重复,每重复20尾。
养殖试验在浙江一星饲料集团试验基地进行,在面积为5×667 m2(平均水深1.8 m)池塘中设置网箱,网箱规格为1.0 m×1.5 m×2.0 m。将各组试验草鱼随机分配在5组、15个网箱中。
分别用商品饲料训化1周后,开始正式投喂。每天08:00和15:00定时投喂,投饲率为2%~4%。每10 d依据投饲量估算鱼体增重并调整投喂率,记录每天投饲量。正式试验共养殖72 d。
每周用试剂盒测定水质1次,试验期间溶解氧质量浓度>8.0 mg/L,pH 7.08 ~8.4,氨氮质量浓度<0.2 mg/L,亚硝酸盐质量浓度<0.01 mg/L,硫化物质量浓度<0.05 mg/L。养殖期间水温25~33℃
1.3 样本采集与分析
1.3.1 样本采集
养殖72 d、停食24 h后,每网箱随机取3尾、每组共9尾作为基因分析样本试验鱼。鱼体表面经75%酒精消毒,常规解剖,快速取出内脏团,在冰浴中取出肠道,剪取中肠的前四分之一肠段,用PBS漂洗2~3次,一式2份,迅速装于EP管中,液氮速冻,于-80℃保存备用。采样所用剪刀镊子均经灭酶灭菌处理。
按上述方法,每网箱随机另取3尾鱼肠部分肠段,用于GSH含量测定。
1.3.2 GSH含量测定
肠道组织匀浆后,2 000 r/min离心15 min,取上清液用于GSH含量的测定。GSH测定用GSH试剂盒(南京建成生物工程研究所)测定。
1.3.3 引物设计
基因序列依据叶元土等[12]基因测序结果,定量PCR 中GCLC、GSS、GSR、GSTω1、GSTPI和MGST1 基因及内参基因β-actin所使用的Taqman引物由prime5.0软件设计,引物序列见表3。

表3 定量PCR引物
1.3.4 总RNA的提取和反转录CDNA
利用1.3.1所采集的单个网箱3尾草鱼肠段样本,分别取3个肠段样本各25 mg合并为一个样本用于总RNA提取,每组共3个平行样本(共9尾鱼、3个测定样本)。加入液氮,研磨成粉末后,加入1 mL Trizol覆盖粉末,待Trizol解冻成液体后全部转移到1.5 mL的EP管中,按照Trizol方法提取不同组织的总RNA。按照PrimeScriptTMRT Mastetr Mix(TaKaRa公司)反转录试剂盒的方法将RNA转录成CDNA,将反转录产物稀释后于-20℃保存备用。
1.3.5 定量PCR
使用CFX96荧光定量PCR仪和SYBR Premix Ex TaqTMⅡ(TaKaRa公司)荧光染料对草鱼谷胱甘肽通路的相关基因(GCLC、GSS、GSR、GSTω1、GSTPI和MGST1)及β-actin进行荧光定量分析。反应体系为20 μL:SYBR Premix Ex TaqTMⅡ (TaKaRa)10μL,上下游引物各1 μL,cDNA 2 μL,灭菌水6 μL。PCR反应采用两步法,反应条件为:95℃预变性30 s、95℃变性5 s、60℃ 退火30 s,共40个循环,最后进行溶解曲线(Melting Curve)分析。
1.4 数据处理
公式:2-△△CT= 2-(Ct目的基因-Ct管家基因),以β -actin为内参基因根据计算公式得到相对表达量。用SPSS 18.0统计分析软件进行分析,组间差异显著性用One-way ANOVA进行统计分析,结果以平均值±标准误(mean±SD)表示。
2 结果
2.1 饲料氧化鱼油使肠道谷胱甘肽含量显著增加
养殖72 d后,采用试剂盒测定了不同试验组草鱼肠道组织中谷胱甘肽含量,结果如图1所示。与6S相比,其他试验组肠道组织中谷胱甘肽含量均显著上升(P <0.05)。

图1 草鱼肠道组织GSH的含量
2.2 饲料氧化鱼油影响了草鱼肠道谷胱甘肽合成酶基因表达活性
采用荧光定量RT-PCR的方法检测了催化以谷氨酸(Glu)、半胱氨酸(Cys)和甘氨酸(Gly)为原料合成谷胱甘肽的GCLC、GSS基因,以及催化GSSG还原为GSH的GSR基因的表达活性,结果如图2所示。
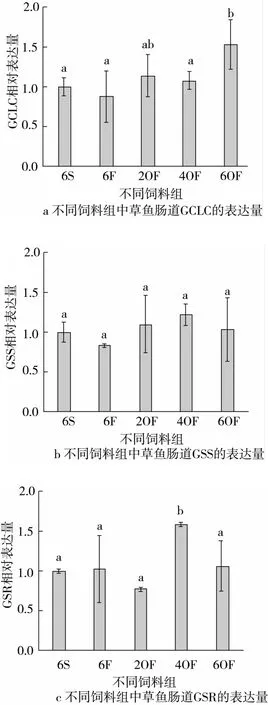
图2 不同饲料组中草鱼肠道谷胱甘肽合成酶基因的表达量
与6S组比较,GCLC除在6F组草鱼肠道中表达有所下调外,在2OF、4OF和6OF组中表达均上调,其中在6OF组中显著上调(P<0.05)。GSS除在6F组草鱼肠道中表达有所下调外,在2OF、4OF和6OF组中表达均上调,但均无显著差异。GSR除在2OF组草鱼肠道中表达有所下调外,在6F、4OF和6OF组中表达均上调,其中4OF组中显著上调(P<0.05)。
随着饲料中氧化鱼油添加量的逐渐增加,GCLC在2OF与4OF组肠道中表达无显著差异,但6OF组肠道中显著上调(P<0.05)。GSS在2OF、4OF和6OF组肠道中表达均无显著差。GSR在2OF和4OF组在肠道中无明显差异,但在4OF组肠道中显著上调(P <0.05)。
2.3 饲料氧化鱼油影响了草鱼肠道谷胱甘肽转移酶基因的表达活性
采用荧光定量RT-QPCR的方法检测了GSTω1、GSTPI及MGST1 3种谷胱甘肽转移酶基因的表达活性,结果如图3所示。

图3 不同饲料组中草鱼肠道GSTs的表达量
以6S组为对照,GSTω1除在6F组草鱼肠道中表达有所下调外,在2OF、4OF和6OF组中表达均上调,但无显著差异。GSTPI在6F、2OF、4OF和6OF组草鱼肠道中表达均上调,但无显著差异。MGST1在6F、2OF、4OF和6OF组草鱼肠道中表达均显著上调(P<0.05)。
随着饲料中氧化鱼油添加量的逐渐增加,GSTω1及GSTPI基因表达量随之下调,但均无显著差;MGST基因表达量随之上调,但均无显著差异。
2.4 GSH/GSTs通路相关基因表达活性与饲料油脂氧化产物和EPA、DHA含量的相关性
将各组饲料中的MDA、POV、AV和(EPA+DHA)的含量与GSH/GSTs通路中的相关基因GCLC、GSS、GSR、GSTω1、GSTPI和MGST1 在肠道中的相对表达量做Pearson相关性分析,检验双侧显著性,结果见表4。
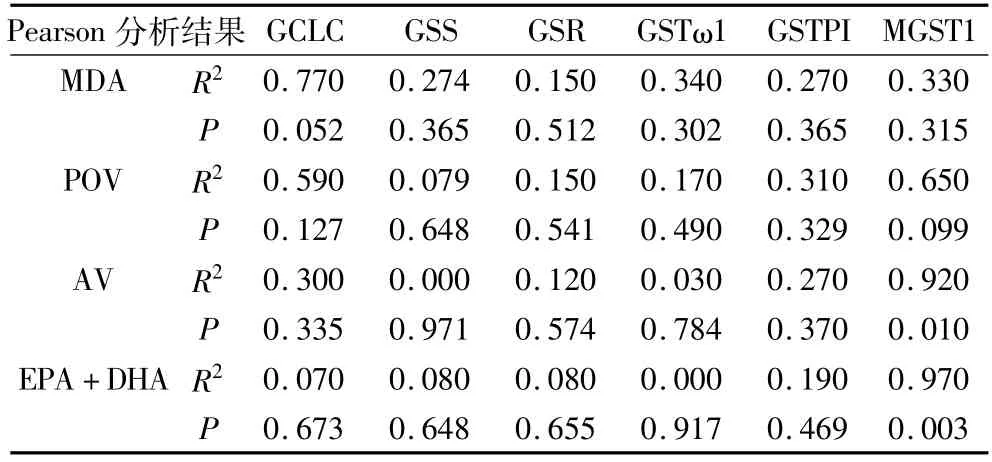
表4 GSH/GSTs通路相关基因表达活性与饲料中MDA、POV、AV和(EPA+DHA)相关性
由表4可知,饲料鱼油氧化产物中MDA含量对GCLC在肠道中的相对表达量影响最大,相关系数为0.77;而营养物质EPA+DHA的含量对其表达量影响很小,相关系数为0.07。MGST1在肠道中的相对表达量主要受到饲料AV及(EPA+DHA)的共同影响。AV与MGST1的相关系数为0.92,且表现极显著(P<0.01)。EPA+DHA与MGST1的相关系数为0.97,且表现极显著(P <0.01)。
再对相关系数R2>0.70的因子作回归分析如图4所示,GCLC的相对表达量与MDA值呈二项式关系,随着饲料中MDA含量的增加,草鱼肠道中GCLC的相对表达量先降低后增加。且GCLC相比6S组的表达量变化率为-11.9%~59%。当MDA为10 mg/kg时,GCLC在肠道中的表达量最小。AV值与MGST1的相对表达量呈多项式关系,随着饲料中的AV含量的增加,草鱼肠道中MGST1的相对表达量先增加后下降。当AV为1.28 g/kg时,MGST1在肠道中的表达量达到了最大值。(EPA+DHA)值与MGST1的相对表达量呈二项式关系,随着饲料中(EPA+DHA)含量增加,草鱼肠道中MGST1的相对表达量先增加后下降。当(EPA+DHA)的质量分数为10.3%时,MGST1在肠道中的表达量达到了最大值。且MGST1相比6S组的表达量上升率为74.7%~149.6%。
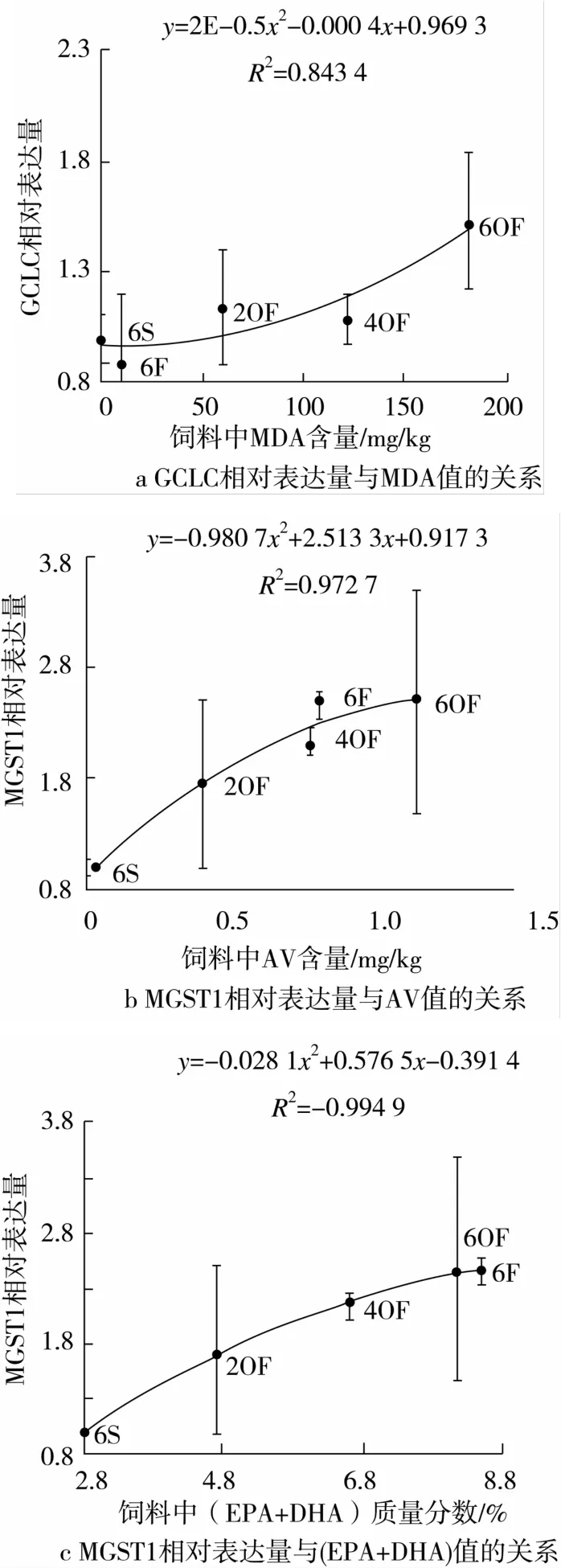
图4 MDA、POV、AV 和(EPA +DHA)与GSH/GSTs通路相关基因表达量关系
3 讨论
3.1 饲料氧化鱼油对草鱼肠道GSH含量、GSH合成酶基因表达活性有显著性的影响
饲料氧化鱼油促使草鱼肠道组织GSH含量显著增加,以应对油脂氧化中间产物所产生的氧化应激作用。GSH分子中的半胱氨酸残端有疏基-SH,它是一种强亲核性物质,可以通过亲核取代和加成作用使有毒亲电物质钝化[13],这是一种自我损伤修复与保护作用。
还原型GSH在机体内的来源有2条途径:①合成途径,以Glu、Cys和Gly等3种氨基酸作为底物在GCLC和GSS的催化下完成。其中,γ-GCL是GSH的合成的限速步骤,而催化该反应的GCLC酶是限制酶;②还原途径,GSSG在GSR作用及还原性辅酶Ⅱ提供H+下还原成GSH。小肠可通过是吸收其他器官组织产生的GSH,是主要吸收部位[14]。Vincenzini等[15]、Linder 等[16]分别在兔子、猪的肠道均发现存在GSH的转运系统,它们通过吸收其他器官组织产生的GSH而使之成为自身的组成部分。本试验中,6F与2OF组在GSH/GSTs通路中的各个基因表达均无明显差异。然而,测定草鱼肠道中GSH含量时,6F与2OF组草鱼肠道的GSH含量却显著上升,且6F组的含量高于2OF组。可能是因为这2组鱼油氧化产物含量较低,肠道可通过GSH运转载体吸收从鱼体其他器官组织所产生的GSH以应对体内的氧化应激作用。另一方面,4OF组草鱼肠道中将GSSG还原为GSH的GSR表达量显著上调(P<0.05)。这可能是由于草鱼肠道吸收从其他器官中产生的GSH与自由基反应,而形成过多的氧化性GSH(GSSG),促进了GSSG向GSH的转化。当受到氧化鱼油的刺激后,通过上调草鱼肠道中GSR的表达量将GSSG还原成GSH,发挥保护肠道的作用。当饲料中脂肪酸氧化产物AV、POV、MDA含量达到一定数量之后(如6OF组),才会刺激GSH的生物合成酶基因的上调表达,以满足对GSH的需要。如图4a所示,GCLC的表达与饲料中的MDA呈二项式关系,其表达量随MDA含量的上升而呈现升高的趋势。MDA是脂质过氧化物的最终分解产物之一,其含量能直接反映机体脂质过氧化程度[17]。因而,常作为脂类过氧化的测定指标之一。当MDA含量较低时,脂质过氧化程度较低,肠道可通过吸收其他器官的GSH使机体免受氧化损伤。当MDA含量较高、外界GSH不足以满足鱼体应对肠道的氧化损伤,因而促使草鱼肠道GCLC表达上调,以3种氨基酸结合生成GSH的方式来提高GSH含量,以抵抗肠道氧化损伤作用,因此GCLC在草鱼肠道中与MDA呈二项式关系。
3.2 饲料氧化鱼油对草鱼肠道谷胱甘肽转移酶基因的表达有显著性的影响
本研究涉及GSTs的3种类型,分别为胞液的GSTω1、GSTPi,膜结合酶的MGST1。GSTs 作为一个属于Ⅱ相代谢解毒酶的同工酶家族,具有清除体内自由基和解毒的双重功能:一方面,可催化GSH与亲电子物质结合而起到解毒作用,最后形成硫醇尿酸经肾脏排出体外;另一方面,具有谷胱甘肽过氧化物酶活力,能防止脂质过氧化损伤[18-19]。但无论哪种作用机制,GST的作用都需要有GSH的参与、是一种依赖GSH发挥解毒、抗氧化作用的酶系,GST在抗氧化系统和解毒代谢中起着十分重要的作用[20]。摄食饲料氧化鱼油72 d后,各组草鱼肠道GSTs 3种酶的表达都受到了一定的影响。其中肠中MGST1的表达量相比GSTω1、GSTPI上调幅度更大,且MGST1在6F、4OF和6OF组中均显著上调(P<0.05)。MGST1作为一种Ⅱ相药物代谢酶在体内具有上述的双重功能,MGST1还担当“感受器”的角色,其具有的半胧氨酸(Cys49)可感受亲电子剂等而被修饰并行使对机体的保护作用[21]。可能因为MGST1作为“感受器”的原因,使其比胞浆GSTs更快、更有效的发挥作用,氧化鱼油产生多种初级与次级的氧化产物,而这些氧化产物能够刺激MGST1的“感受器”使其快速反应并且提高自身的催化活性,发挥清除体内自由基和解毒的功能。
如图4b、图4c所示,饲料中AV值和(EPA+DHA)的含量同肠道的MGST1的表达量呈多项式关系,均随着AV、(EPA+DHA)含量的增加而呈现出先增加后减少的趋势。研究发现MGST1的表达量在2OF组中相比于6S组中无显著差异。这可能是由于饲料中(EPA+DHA)的营养作用与AV的损伤作用共同影响的结果,2OF的AV增加、但与此同时2OF的(EPA+DHA)也有所增加。2种共同作用使得肠道中MGST1的表达量与只添加豆油的6S组并无显著差异。这也显示了鱼油的营养作用、氧化产物损伤作用的双重性。当AV含量从较少的0.4 g/kg升高到0.77、0.8、1.14 g/kg,(EPA +DHA)也从质量分数较少的4.7%升高到6.6%、8.2%、8.5%时肠道中MGST1的表达量显著升高(P<0.05)。这可能是由于当饲料中AV值不断增加即使(EPA+DHA)也不断增加,氧化鱼油对鱼体的损害作用将大于(EPA+DHA)对鱼体的营养作用,导致最后MGST1的表达量不断增加以应对氧化产物对鱼体的氧化损伤。当AV增加1.28 g/kg时,可能出现超出MGST1的作用范围,其表达量会出现下降,使草鱼肠道受到进一步的氧化损伤。因此,饲料中的(EPA+DHA)的含量对于鱼体抗氧化损伤具有一定抵消作用,然而当氧化鱼油导致的氧化损伤超出(EPA+DHA)营养物质的作用范围,草鱼肠道GSH/GSTs基因通路就会发生作用,使鱼体免受氧化损伤,但鱼油中有害物质过高,鱼体自身的抗氧化系统也无法修复,导致鱼体健康受到严重的损伤。
4 结论
饲料中氧化鱼油影响草鱼肠道以GSH/GSTs为标志的抗氧化能力,引起GSH/GSTs通路基因的表达活性上调。当饲料中含有较低浓度氧化鱼油,草鱼肠道通过吸收其他组织的GSH,以及通过还原反应获得GSH以应对氧化损伤。当饲料中氧化鱼油的浓度较高,草鱼肠道主要通过以Glu、Cys及Gly为原料合成GSH的方式获得GSH。MGST1为草鱼肠道谷胱甘肽巯基转移酶中主要的作用类型,受到AV与(EPA+DHA)共同作用。
[1]李爱杰.水产动物营养与饲料学[M].北京:中国农业出版社,1996:44-82
Lin A J.Aquatic animal nutrition and feed science[M].Beijing:China Agriculturen Press,1996:44-82
[2]王煜恒,王爱民,刘文斌,等.不同脂肪源对异育银鲫鱼种生长、消化率及体成分的影响[J].水产学报,2010,34(9):1439-1446
Wang Y H,Wang A M,Liu W B,et al.Effects of dietary oil sources on growth performance,apparent digestibility and body composition of Carassius auratus gibelio[J].Journal of Fisheries of China,2010,34(9):1439-1446
[3]姚仕彬,叶元土,李洁,等.鱼油在氧化过程中氧化指标及其脂肪酸组成的变化[J].饲料研究,2012,(6):74-76
Yao SB,Ye Y T,Li J,et al.The change of oxildation index and fatty acid during oxidation of fish oil[J].Feed Research,2012,(6):74-76
[4]Armstrong R N.Structure,catalytic mechanism,and evolution of the glutathione transferases[J].Chemical Research in Toxicology,1997,10(1):2-18
[5]刘进.还原型谷胱甘肽结合三联疗法提高十二指肠球部溃疡愈合质量初探[J].实用医学杂志,2005,21(16):1844-1845
Liu J.Glutathione combined triple therapy to improve the quality of duodenal ulcer healing[J].The Journal of Practical Medicine,2005,21(16):1844-1845
[6]Banki K,Hutter E,Colombo E,et al.Glutathione levels and sensitivity to apoptosis are regulated by changes in transaldolase expression[J].Journal of Biological Chemistry,1996,271(51):32994-33001
[7]赵红霞,曹俊明,朱选,等.日粮添加谷胱甘肽对草鱼生长性能、血清生化指标和体组成的影响[J].动物营养学报,2008,20(5):540-546
Zhao H X,Cao J M,Zhu X,et al.Effects of dietary glutathione on growth performance,serum biochemical indices and body composition of juvenile grass carp(Ctenopharyngodon idella)[J].Chinese Journal of Animal Nutrition,2008,20(5):540-546
[8]周婷婷,曹俊明,黄燕华,等.饲料中添加谷胱甘肽对吉富罗非鱼生长、组织生化指标和非特异性免疫相关酶的影响[J]. 水产学报,2013,37(5):742-750
Zhou T T,Cao JM,Huang Y H,et al.Effects of dietary glutathione on growth performance,tissue biochemical indexes and non-specific immune related enzymes of GIFT Oreochromis niloticus[J].Joural of fisheries of China,2013,37(5):742-750
[9]张国良,赵会宏,周志伟,等.还原型谷胱甘肽对罗非鱼生长和抗氧化性能的影响[J].华南农业大学学报,2007,28(3):90-93
Zhang G L,Zhao H H,Zhou Z W,et al.The Effects of reduced glutathione on growth rate and antioxidation capacity of Tilapia[J].Journal of South China Agricultural University,2007,28(3):90-93
[10]Habig W H,Pabst M J,Jakoby W B.Glutathione S-transferases the first enzymatic step in mercapturic acid formation[J].Journal of Biological Chemistry,1974,249(22):7130-7139
[11]殷永风,叶元土,蔡春芳,等.在自制氧化装置中氧化时间对豆油氧化指标的影响.安徽农业科学,2011,39(7):4052-4054
Yin Y F,Ye Y T,Cai CF,et al.Variation or the oxidation index or soybean oil in home-made oxidation device at different time[J].Journal of Anhui Agricultural Sciences,2011,39(7):4052-4054
[12]叶元土,蔡春芳,吴萍,等.氧化油脂对草鱼生长和健康的损伤作用[M].北京:中国农业科技出版社,2015
Ye Y T,Cai C F,Wu P,et al.Lnjury of oxidized dietary oil on growth and health of grass carp[M].Beijing:China Agricultural Science and Technology Press,2015
[13]Brian K,Brian C,David JM.The role of glutathione in detoxication[J].Environmental Health Perspectives,1983,49:59-69
[14]Lantomasi T,Favilli F,Marraccini P,et al.Glutathione transport system in humans mall intestine epithelial cells.Bioehem Biophys Acta,1997,1330(2):272-283
[15]Vincenzini M T,Favilli F,Iantomasi T.Intestinal uptake and transmembrane transport systems of intact GSH;characteristics and possible biological role[J].Biochimica et Biophysica Acta (BBA)-Reviews on Biomembranes,1992,1113(1):13-23
[16]Linder M,Burlet G D,Sudaka P.Transport of glutathione by intestinal brush border membrane vesicles[J].Biochemical and Biophysical Research Communications,1984,123(3):929-936
[17]刘伟,张桂兰,陈海燕.饲料添加氧化油脂对鲤体内脂质过氧化及血液指标的影响[J].中国水产科学,1997,4 (1):94-96
Liu W,Zhang G L,Chen H Y.Effects of add oxidative oil in diet on lipid peroxidation and hematological values for common carps[J].Journal of Fishery Sciences of China,1997,4 (1):94-96
[18]John D H,Jack U F,Ian R.Glutathione transferases[J].Toxicology.2005,45:51-88
[19]Pearson WR.Phylogenies of glutathione transferase families[J].Methods in Enzymology,2005,401:186-204
[20]Schuliga,Michael C,Salem S,et al.Upregulation of glutathione-related genes and enzyme activities in cultured human cells by sublethal concentrations of inorganic arsenic[J].Toxicological Sciences,2002,70(2):183-192
[21]史强,楼宜嘉.活性氮对肝脏微粒体谷胱甘肽转移酶1修饰激活的研究进展[J].中国药理学与毒理学杂志,2007,21(4):297-300
Shi Q,Lou Y J.Advances in reactive nitrogen species mediated activation of hepatic microsomal glutathione transferase 1[J].Chinese Journal of Pharmacology and Toxicology,2007,21(4):297-300.
The Effect of Glutathione/Glutathione Transferase Gene Pathway in Intestinal of Grass Carp (Ctenopharyngodon idellus)by Feeding Oxidized Fish Oil
Lin Xiuxiu Ye Yuantu Cai Chunfang Wu Ping Huang Yuwei Chen Kequan Peng Kan Xu Denghui Luo Qigang
(School of Biology&Basic Medical Science,Soochow University,Suzhou 215123)
The effect of dietary oxidized fish oil on oxidative stress pathway was studied by measuring the intestinal of grass carp GSH/GSTs pathway gene expression.The fish,with an initial weight of(74.8 ±1)g,was fed 72 d with a basal diet and 5 diets added with soybean oil(6S),fish oil(6F),2%oxidized fish oil(2OF),4%oxidized fish oil(4OF)and 6%oxidized fish oil(6OF).Using RT-QPCR method,determinethe GSH/GSTs pathway gene expression and the GSH content in grass carp intestinal.The results showed that,2OF,4OF and 6OF grass carp intestinal GSH/GSTs gene pathway genes were increased,which 6F group MSGT1 expression was significantly increased (P <0.05)in the intestinal,4OF group GSR and MGST1 expression significantly increased (P <0.05)in the intestinal,6OF group GCLC and MGST1 expression was significantly increased (P < 0.05)in the intestinal;MDA content in dietary with the relative expression of GCLC was polynomial relations,AV and(EPA+DHA)content in dietary with the relative expression of GCLC was polynomial relations.In conclusion,oxidized fish oil had an influence on GSH/GSTs gene pathway had the intestinal and when oxidized fish oil different concentrations,GSH/GSTs gene pathway in different ways to deal with.
Grass carp (ctenopharyngodon idellus),intestinal,oxidized fish oil,GSH,gene
S965
A
1003-0174(2016)09-0106-08
国家自然科学基金(31172417)
2015-01-13
林秀秀,女,1990年出生,硕士,水产动物营养与饲料
叶元土,男,1964年出生,教授,水产动物营养与饲料
