三裂鼠尾草素在CIK 细胞增殖及其胃癌细胞杀伤中的作用
2015-12-31王军生吴克俭刘军权陈复兴陈永强颜学兵
王军生,吴克俭,刘军权,陈复兴,陈永强,周 燏,颜学兵
徐州医学院附属医院消化内科,江苏 徐州221006
胃癌是目前最常见的恶性肿瘤之一,严重威胁人类健康,肿瘤过继细胞免疫治疗成为治疗胃癌的新途径之一,其主要是利用肿瘤患者的自身免疫细胞达到治疗的目的[1]。细胞因子诱导的杀伤细胞(cytokineinduced killer cells,CIK)是一种重要的免疫效应细胞,具有抗肿瘤活性。但如何获得足够数量并具有高活性的CIK 细胞已成为治疗有效与否的关键[2]。三裂鼠尾草素(Salvigenin)有促进细胞凋亡、免疫调节功能,具有抗炎、抗氧化、抗肿瘤等多种药理活性[3]。本实验通过观察三裂鼠尾草素对CIK 细胞增殖及对胃癌细胞SGC-7901 杀伤活性的影响,进而探讨其可能的机理。
1 材料与方法
1.1 材料 主要试剂:人胃癌SGC-7901 细胞株(上海细胞研究所);PerCP-Cy 5.5 标记的CD3 抗体和FITC 标记的CD56 抗体、PE 标记的穿孔素(Perforin,PFP)、颗粒酶B(GranzymeB,GraB)和APC 标记的CD107a 抗体(杭州联科生物公司);IL-15 和IL-21(R&D 公司);CD3 mAb(上海免疫研究所);CD28 mAb(苏州大学生物技术研究所);鼠抗人β-catetin、PERK1/2,兔抗人Bcl-2 和P-AKT 抗体(CST 公司)。
1.2 方法
1.2.1 CIK 细胞的培养:取健康者外周抗凝血100 ml,分离得到单个核细胞,调整细胞数为5 ×108/L,加入PPMI 1640 培养液,接种于6 孔细胞培养板,每孔5 μl,置37 ℃、5% CO2培养箱中培养24 h 后收集细胞,调整细胞数为5 ×108/L,用PPMI 1640 完全培养液接种于6 孔板,于37 ℃、5% CO2培养箱中培养,每2 d 换培养基(含IL-15、IL-21、CD28)1 次,采用FCM检测CIK 细胞表型CD3+CD56+表达。
1.2.2 CCK8 法检测三裂鼠尾草素对CIK 细胞生长的影响:收集培养10 d 的CIK 细胞,1 ×108/L 细胞数接种于96 孔板,200 μl/孔,加入三裂鼠尾草素[终浓度为0(空白对照组)、0.1、0.2、0.4、0.8、1.6、3、6、12.8、25.6、51.2、102.4、204.8、409.6、819.2、1 638.4 pmol/L],孵育24、48、72 h 后,加入CCK8,孵育后,于酶标仪450 nm处检测各孔吸光值(OD)。
1.2. 3 FCM 检测三裂鼠尾草素对CIK 细胞中CD107a、GraB 和PFP 表达的影响:收集培养10 d CIK细胞分别接种于6 孔板,加入三裂鼠尾草素[终浓度分别为0(空白对照组)、0.4、1.6、6.4、25.6、102.4 pmol/L],FCM 检测CD107a、GraB 和PFP 的含量。
1.2.4 LDH 释放法检测CIK 细胞杀伤活性:按已建立的LDH 释放法[4]进行检测。收集培养10 d 的CIK细胞,加入三裂鼠尾草素(终浓度分别为0、0.4、1.6、6.4、25.6、102.4 pmol/L),同时设FCM 检测CIK 细胞表型CD3+CD56+表达FCM 检测CIK 细胞表型CD3+CD56+表达,取胃癌SGC-7901 细胞株,使效应细胞和靶细胞比例为10∶1,按LDH 试剂盒说明书要求操作,在生化分析仪340 nm 处测定吸光度值(A)。
1.2.5 Western blotting:Western blotting 检测三裂鼠尾草素作用前后CIK 细胞β-catetin、P-ERK1/2 和PAKT 的表达。
1.3 统计学方法 采用SPSS 13.0 软件进行单因素方差分析,P <0.05 为差异有统计学意义。
2 结果
2.1 CIK 细胞的培养 培养前,外调血单位核细胞(peripheral blood monouclear cells,PBMC)中CD3+CD56+T 细胞比例<4%,培养10 d 后CD3+CD56+T细胞比例增至45.20%,与培养前比较,显微镜观察可见培养第10 天的CIK 细胞,细胞体积增大,呈圆形或椭圆形,包膜光滑,细胞数量增多,部分形成集落,FCM检测CIK 细胞表型CD3+CD56+表达如图1 所示。
2.2 CCK8 检测结果 相同浓度的三裂鼠尾草素作用后,48 h 时CIK 细胞增殖达最高峰,与24 h、72 h 组比较,差异有统计学意义(P <0.05);与对照组比较,浓度为1.6 ~204.8 pmol/L 的三裂鼠尾草素诱导CIK细胞24 h、48 h、72 h 后,CIK 细胞增殖明显(P <0.05);三裂鼠尾草素浓度为409.2 ~1 638.4 pmol/L时,CIK 细胞增殖率为负值,与对照组相比,差异有统计学意义(P <0.05,见图2)。
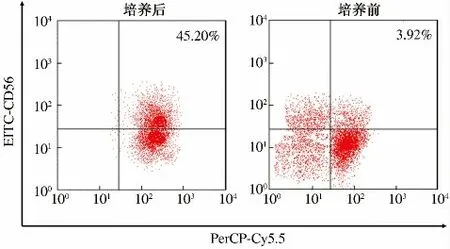
图1 CIK 细胞的培养:扩增前和扩增第10 天CIK 细胞FCM分析Fig 1 The cultivation of CIK cells:before the amplification and the FCM analysis of CIK cells on the tenth day
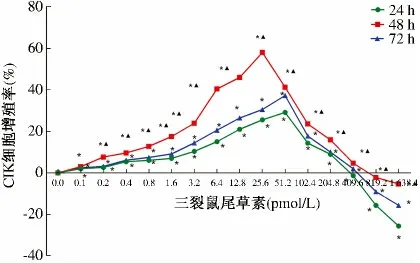
图2 三裂鼠尾草素对CIK 细胞增殖率的影响Fig 2 The effect of Salvigenin on the proliferation rate of CIK cells
2.3 FCM 检测结果 三裂鼠尾草素作用CIK 细胞48 h 后,CIK 细胞GraB、PFP 和CD107a 的表达不同程度升高,25.6 pmol/L 浓度组与对照组比较,差异均有统计学意义(P <0.05);各实验组中,25.6 pmol/L 组GraB、PFP 和CD107a 的表达最高,与其他浓度组相比,差异有统计学意义(P <0.05,见图3)。
2.4 杀伤活性检测结果 三裂鼠尾草素的浓度在1.6 ~25.6 pmol/L 作用CIK 细胞48 h 后,对胃癌细胞株的杀伤活性显著高于对照组,差异有统计学意义(P <0.05);浓度在25.6 pmol/L 时杀伤活性达最高峰,为96.75%,与对照组比较,差异有统计学意义(P <0.05,见图4)。
2.5 Western blotting 检测结果 三裂鼠尾草素作用CIK 细胞48 h 后,CIK 细胞β-catetin、P-ERK1/2、Bcl-2和P-AKT 的表达不同程度升高,在浓度为25.6 pmol/L时,β-catetin、P-ERK1/2、Bcl-2 和P-AKT 的表达均高于对照组(P <0.05,见图5 ~6)。

图3 三裂鼠尾草素作用48 h 后,CIK 细胞GraB、PFP、CD107a 表达的FCM 结果Fig 3 Expressions of Gra B,PFP,CD107a of CIK cells in FCM after 48 hours with Salvigenin effect

图4 三裂鼠尾草素作用CIK 细胞48 h 后,CIK 细胞对胃癌细胞株杀伤活性的影响;图5 三裂鼠尾草素作用CIK 细胞48 h 后的蛋白表达;图6 三裂鼠尾草素作用后CIK 细胞β-catenin、P-ERK1/2、Bcl-2 和P-AKT 灰度值比较Fig 4 Effect of CIK cells on the activity of gastric cnacer cell lines after 48 hours with Salvigenin effect;Fig 5 Expression of protein of CIK cells after 48 hours with Salvigenin effect;Fig 6 Comparsion of β-catenin,P-ERK1/2,Bcl-2 and P-AKT grey value after Salvigenin effect
3 讨论
CIK 细胞是同时表达CD3 和CD56 两种膜蛋白分子的免疫细胞,具有T 淋巴细胞的抗肿瘤活性和非主要组织相容性复合性(major histocompatibility complex,MHC)限制性杀瘤特点,是肿瘤过继细胞免疫治疗中的一种免疫效应细胞[5]。CIK 细胞增殖速度快,具有杀瘤活性与杀瘤谱广特点,目前CIK 细胞已应用于多种肿瘤的治疗[6]。三裂鼠尾草是天然多酚类化合物,属于黄酮类类似物,Noori 等[3]研究发现三裂鼠尾草素对荷瘤小鼠作用后抑制肿瘤生长速率,肿瘤体积变小,调节免疫反应,提高抗肿瘤效力。Rafatian 等[7]研究发现在氧化应激诱导人成神经细胞瘤SH-SY5Y 细胞的细胞凋亡和自噬过程中,三裂鼠尾草素可通过细胞凋亡蛋白酶途径的独立抗氧化活性,促进细胞凋亡和自噬活动的增强。本研究通过不同浓度三裂鼠尾草素在体外诱导人CIK 细胞,发现在三裂鼠尾草素浓度为1.6 ~204.8 pmol/L 时,可明显促进CIK 细胞增殖,浓度为25.6 pmol/L 时,CIK 细胞增殖率达最大值,当三裂鼠尾草素浓度超过819.2 ~1 638.4 pmol/L,CIK 细胞增殖出现明显抑制,这一效应呈现较明显剂量依赖关系,提示三裂鼠尾草素对CIK 细胞的增殖作用有浓度窗现象。
PFP 和GraB 均可存在于活化的CTL 和NK 细胞胞质颗粒中,其介导的细胞毒途径是CTL 和NK 细胞抗肿瘤的主要方式之一[8]。PFP 释放后当Ca2+存在时,在靶细胞上聚合形成活性孔道,在靶细胞膜内外形成明显的渗透压反差,导致靶细胞胀裂而死,GraB 也可以通过此PFP 形成孔道进入靶细胞,诱导靶细胞凋亡[9-10]。T 细胞表面的CD107a 分子,与T 细胞活化以后脱颗粒过程相关,其比值可以直接反应该效应细胞具有的特异性杀伤活性[11-12]。本实验中发现三裂鼠尾草素能够促进CIK 细胞GraB、PFP 和CD107a 的表达,从而增强了CIK 细胞对胃癌细胞的杀伤活性。
β-catenin 的活化可激活Erk 分子,进而上调Bcl-2的表达,促进免疫细胞的存活,从而控制自身免疫应答反应[13]。Bcl-2 蛋白家族直接调节线粒体膜的渗透性从而调节细胞色素C,发挥抗凋亡和促凋亡的作用[14]。本实验发现三裂鼠尾草素可促进CIK 细胞βcatetin、ERK1/2、Bcl-2 和P-AKT 的表达,三裂鼠尾草素在浓度为1.6 ~25.6 pmol/L 时随着浓度的提高而增强CIK 细胞Bcl-2 的表达,且对CIK 细胞的增殖及杀伤活性均有明显的促进作用。因此可以推断,三裂鼠尾草素对CIK 细胞的增殖及对肿瘤细胞的杀伤作用与激活β-catetin、ERK1/2 和Bcl-2 信号通路的表达密切相关,在上述各信号通路中是否具有共同的调节靶点亟待进一步研究。本实验中CIK 细胞的AKT 表达也上调,三裂鼠尾草素可能还通过PI3K/AKT 信号传导通路进一步影响T 细胞的增殖、分化,从而增强对肿瘤细胞的杀伤作用。
综上所述,三裂鼠尾草素能够促进CIK 细胞的增殖,从而有效提高CIK 细胞对胃癌细胞的杀伤活性,其机制可能与三裂鼠尾草素激活β-catetin、ERK1/2、Bcl-2、P-AKT 信号通路,上调CIK 细胞中GraB、PFP、CD107a 的表达有关。以上实验结果为三裂鼠尾草素用于肿瘤的免疫治疗提供了实验依据,也为草药单体在免疫细胞的培养应用中提供实例。
[1] Ma Y,Xu YC,Tang L,et al. Cytokine-induced killer(CIK)cell therapy for patients with hepatocellular carcinoma:efficacy and safety[J]. Exp Hematol Oncol,2012,1(1):11.
[2] Tumeh PC,Koya RC,Chodon T,et al. The impact of ex vivo clinical grade activation protocols on human T-cell phenotype and function for the generation of genetically modified cells for adoptive cell transfer therapy[J]. J Immunother,2010,33(8):759-768.
[3] Noori S,Hassan ZM,Yaghmaei B,et al. Antitumor and immunomodulatory effects of salvigenin on tumor bearing mice[J]. Cell Immunol,2013,286(1-2):16-21.
[4] Liu JQ,Han HM,Chen FX. LAK cell activity was detected by lactate dehydrogenase kit[J]. Journal of Clinical Laboratory Science,1995,13(2):83.刘军权,韩慧敏,陈复兴. 用乳酸脱氢酶试剂盒检测LAK 细胞活性[J]. 临床检验杂志,1995,13(2):83.
[5] Introna M,Franceschetti M,Ciocca A,et al. Rapid and massive expansion of cord blood-derived cytokine-induced killer cells:an innovative proposal for the treatment of leukemia relapse after cord blood transplantation [J]. Bone Marrow Transplant,2006,38 (9):621-627.
[6] Shu X,Li X,Whang ZY. The present research situation and progress of CIK cells in gastric cancer therapy[J]. Med J Chin PAPF,2013,24(6):526-528.舒心,李幸,汪治宇. 胃癌CIK 细胞治疗的研究现状及进展[J].武警医学,2013,24(6):526-528.
[7] Rafatian G,Khodagholi F,Farimani MM,et al. Increase of autophagy and attenuation of apoptosis by Salvigenin promote survival of SH-SY5Y cells following treatment with H2O2[J]. Mol Cell Biochem,2012,371(1-2):9-22.
[8] Ma J,Li XH,Gao CJ,et al. The variety of the mRNA expression of perforin,granzyme B by expanded NK cells with different cytokines from human peripheral blood[J]. Chin J Microbiol Immunol,2009,29(4):336-339.马健,李晓红,高春记,等. 人外周血NK 细胞在细胞因子刺激下扩增后穿孔素、颗粒酶B 基因表达的变化[J]. 中华微生物学和免疫学杂志,2009,29(4):336-339.
[9] Liu CC,Walsh CM,Young JD. Perforin:structure and function[J].Immunol Today,1995,16(4):194-201.
[10] Smyth MJ,Trapani JA. Granzymes:exogenous proteinases that induce target cell apoptosis[J]. Immunol Today,1995,16(4):202-206.
[11] Parkinson-Lawrence EJ,Dean CJ,Chang M,et al. Immunochemical analysis of CD107a (LAMP-1)[J]. Cell Immunol,2005,236(1-2):161-166.
[12] Aktas E,Kucuksezer UC,Bilgic S,et al. Relationship between CD107a expression and cytotoxic activity[J]. Cell Immunol,2009,254(2):149-154.
[13] Charo J,Finkelstein SE,Grewal N,et al. Bcl-2 overexpression enhances tumor-specific T-cell survival [J]. Cancer Res,2005,65(5):2001-2008.
[14] Borner C. The Bcl-2 protein family:sensors and checkpoints for lifeor-death decisions[J]. Mol Immunol,2003,39(11):615-647.
