RASSF10 在肿瘤中的作用及机制研究
2015-12-31董腾慧郭明洲
董腾慧,郭明洲
解放军总医院消化内科,北京100853
RAS 蛋 白(the RAS-association domain family,RASSF)包含10 个家族成员,均含有一个RA 结构域(RAS-association domain),根据RA 结构域的位置将RASSF 分为两大类,位于羧基端的称为经典RASSF 家族(classical RASSF),位于氨基端的称为氨基端RASSF 家族(N-terminal RASSF)[1]。经典RASSF 家族包括RASSF1A、RASSF1C、RASSF2、RASSF3、RASSF4、RASSF5A、RASSF5C 和RASSF6[2],除RA 结构域外,其羧基端还有一个SARAH 结构域,可与其他蛋白相互 作 用[3]。氨 基 端 RASSF 家 族 包 含 RASSF7、RASSF8、RASSF9、RASSF10 4 种蛋白,除RA 结构域的位置与经典RASSF 家族不同外,还缺乏SARAH 结构域,根据SMART 数据库预测结果提示RASSF7、RASSF8和RASSF10 有一个卷曲螺旋(coiled-coil)结构域,此结构域可由疏水基介导形成二聚体,结构学研究证实卷曲螺旋结构域与SARAH 结构域没有相似性[1,4]。经典RASSF 家族与氨基端RASSF 家族在结构上的差异提示是两个完全不同的亚家族[1]。尽管在NRASSF 家族中RASSF7 ~10 的结构类似但其表观遗传调控及生物学功能却各有不同(见表1)。
RASSF7 及RASSF8 虽然在启动子区分别含有一个范围约1 015 bp 和1 201 bp 的CpG 岛,但很少在肿瘤中发生甲基化[1,7,10]。RASSF9 的启动子区无CpG岛,RASSF10 启动子区有一个2 254 bp 的富含CpG 的区域,在多种肿瘤中频繁发生甲基化且其表达受到启动子区甲基化调控[1]。RASSF7 结合在中心体上通过影响微管的功能,促进有丝分裂进而促进肿瘤的生长[7]。RASSF8 作为抑癌基因,通过抑制Wnt 和NFκB 信号通路抑制肿瘤细胞生长和迁移[9]。RASSF9诱导上皮细胞的分化并抑制其生长[11,13]。本文讨论RASSF10 基因在肿瘤中的表达、调控及肿瘤发生中的作用及机制。

表1 N-RASSF 成员的基本特征Tab 1 The characteristic of N-RASSF members
1 RASSF10 的分离和鉴定
RASSF10 位于人染色体11p15.2 上,是通过结构预测获得的与RASSF9 同源的基因,与其他氨基端RASSF 家族成员一样,其氨基端在人、非洲爪蟾和果蝇中具有一个保守的结构域,能够抑制细胞有丝分裂[4]。RASSF10 在人甲状腺、胰腺、胎盘、心脏、肺脏、肾脏、脑及骨骼肌等组织中均有表达[17]。RASSF10 基因含有一个外显子,一个能编码507 个氨基酸的开放阅读框[10],RASSF10 的启动子区有一个范围约2 254 bp的富含CpG 二核苷酸的区域[1]。
2 RASSF10 与人类肿瘤
2.1 RASSF10 在不同肿瘤中频繁发生甲基化 目前已经发现RASSF10 基因在多种肿瘤组织中存在启动子区甲基化(见表2),且其表达受启动子区甲基化调控。
在儿童白血病细胞及正常人骨髓细胞中利用结合亚硫酸氢钠处理和酶解分析(COBRA)法及硫化测序方法(Bisulfite sequencing,BSSQ)检测RASSF10 启动子区甲基化状态,发现RASSF10 在儿童T 细胞白血病中甲基化率为88.5%(23/26),在儿童B 细胞白血病中甲基化率为15.7%(8/51),而在正常骨髓细胞中无甲基化,此外RASSF10 在7 个白血病细胞株(THP-1、U937、JKT、DND-41、SUP-T1、NALM1 及NALM6)中均呈甲基化状态,其中白血病细胞系THP-1 及SUP-T1细胞在接受去甲基化药物(5-Aza)及去乙酰化药物(TSA)共同处理后RASSF10 的表达明显上调[10]。
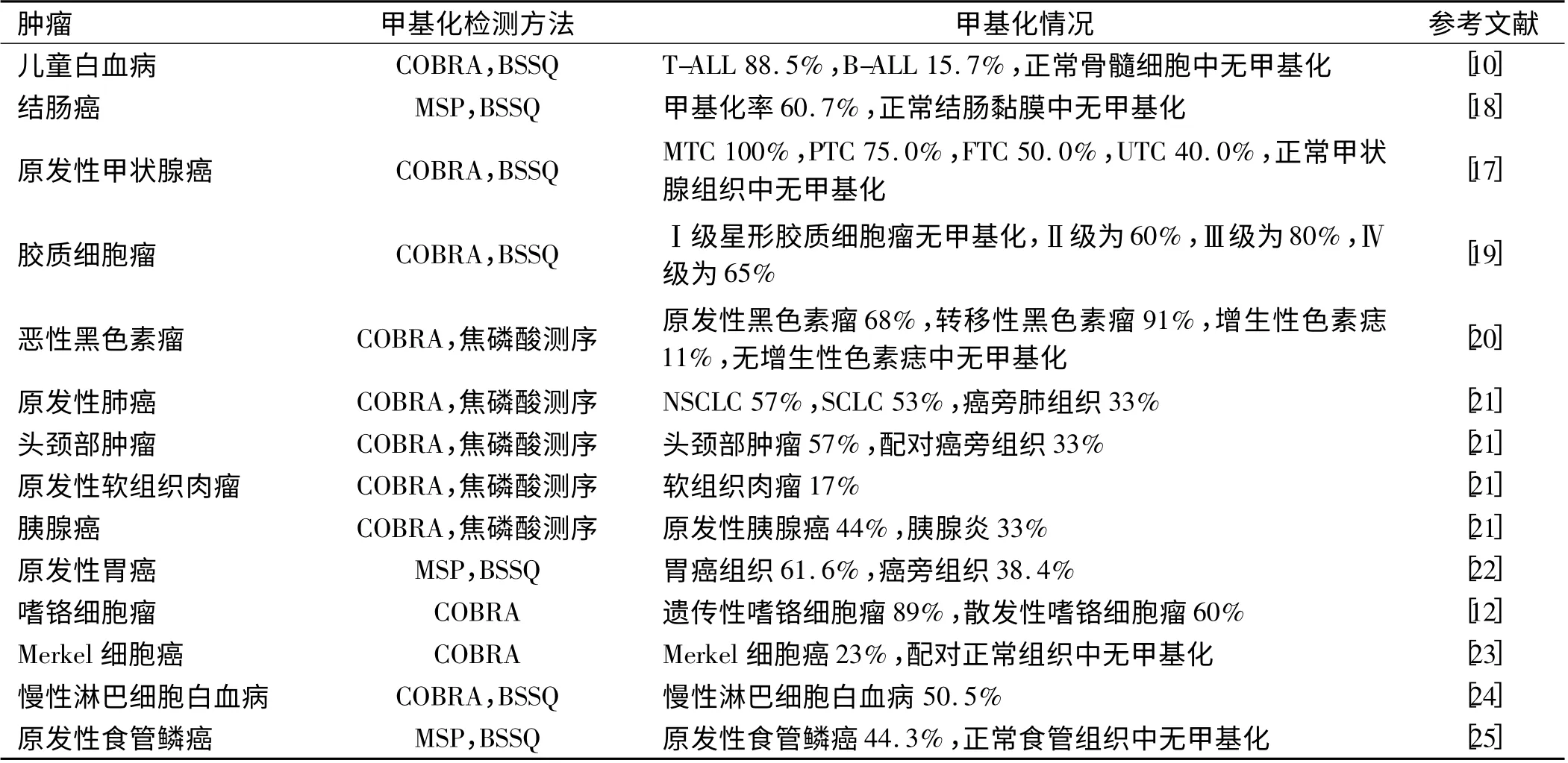
表2 RASSF10 在不同肿瘤中的甲基化情况Tab 2 The RASSF10 methylation status in different cancers
利用甲基化特异性 PCR (MSP)方法检测RASSF10 在结肠癌组织中的甲基化状态,发现RASSF10 在结肠癌中的甲基化率为60.7%(54/89),提示RASSF10 在结肠癌组织中频繁发生甲基化[18];另发现,在RASSF10 完全甲基化的结肠癌细胞系LOVO、RKO 及HCT116 中RASSF10 的表达缺失,加入5-Aza 处理后恢复表达,在RASSF10 部分甲基化的结肠癌细胞系LS180、DLD1、HT29、SW480 及SW620 中RASF10 有微弱表达,经5-Aza 处理后表达上调,提示RASSF10 在结肠癌细胞中的表达受启动子区高甲基化调控[18]。
RASSF10 在原发性甲状腺癌中甲基化率为65.6%(21/32),在滤泡状腺瘤中甲基化率为10.0%(1/10),在甲状腺肿大患者中甲基化率为33.3%(4/12),而在13 例正常甲状腺组织中均未发现甲基化,RASSF10 在原发性甲状腺癌中的甲基化率明显高于其在滤泡状腺瘤及正常甲状腺中的甲基化率(P 均<0.05)[17]。RASSF10 甲基化存在于神经内分泌细胞及上皮细胞起源的原发性甲状腺癌,且甲基化率有所不同。
RASSF10 甲基化可用于原发性黑色素瘤的诊断及鉴别诊断中,如RASSF10 在原发性黑色素瘤及转移性黑色素瘤中的甲基化率分别为68%和91%,在增生性色素痣中的甲基化率为11%,而在无增生性色素痣中无启动子区甲基化,提示RASSF10 的甲基化状态可以作为区分黑色素瘤与色素痣的一个新的肿瘤标志物[20]。
RASSF10 在原发性胃癌中的甲基化率明显高于癌旁组织(61.6% vs 38.4%,P <0.01),且在胃癌中RASSF10 的甲基化状态与胃癌的浸润深度、淋巴结转移及Borrmann 分型相关,RASSF10 的甲基化率随着浸润深度的增加而增加,T3 及T4 组RASSF10 甲基化率明显高于T1 和T2 组(67.1% vs 37.5%,P <0.05),淋巴结转移组RASSF10 甲基化率明显高于无淋巴结转移组(68.8% vs 40.9%,P <0.05),Borrmann Ⅳ组RASSF10 甲基化率明显高于早期胃癌组(85. 7% vs 57.0%,P <0.05)[22]。另有报道显示RASSF10 在胃癌中的甲基化率与胃癌预后密切相关,对300 个胃癌患者进行多因素生存分析显示RASSF10 甲基化是胃癌患者总生存期的一个独立预测因素(危险比为1.687,P <0.001)[26]。
2.2 RASSF10 在肿瘤发生、发展中的作用 在肺癌细胞系A549 中利用免疫荧光技术发现内源性RASSF10 蛋白可在有丝分裂间期定位于胞质,当有丝分裂期开始时RASSF10 蛋白入核,与α-微管蛋白共定位于正在生成的纺锤体两极及微管上,这种共定位从分裂前期一直持续到分裂末期。提示RASSF10 在细胞有丝分裂过程中可能具有一定的调控作用[19]。这一功能在原发性食管鳞癌细胞系及结肠癌细胞系中得到验证,在食管鳞癌细胞系KYSE150 中恢复RASSF10表达,G2/M 期细胞明显增加,RASSF10 使原发性食管鳞癌细胞系阻滞在G2/M 期[25];在结肠癌细胞系RKO及HCT116 细胞中恢复RASSF10 表达,G2/M 期细胞也明显增加,证明RASSF10 可使细胞周期阻滞在G2/M期[18]。
此外,在多种肿瘤中证实RASSF10 可促进细胞凋亡,如在结肠癌细胞系RKO 及HCT116 中恢复RASSF10 表达可促进细胞凋亡[18];在食管癌细胞系KYSE150 中恢复表达RASSF10,明显促进细胞的凋亡[25];在前列腺癌细胞LNCaP 细胞中恢复RASSF10表达,细胞凋亡比例增加2 倍[27];在肺癌细胞系SPCA-1 细胞中siRNA 敲降RASSF10 可抑制细胞凋亡[28]。在胃癌细胞系JRST 及BGC823 细胞系中过表达RASSF10 可诱导细胞凋亡[16]。
RASSF10 在调节细胞周期及细胞凋亡中的作用提示RASSF10 可能在肿瘤的发生、发展过程中发挥抑癌作用。目前发现RASSF10 可抑制胶质细胞瘤、原发性食管鳞癌、结肠癌、肺癌等肿瘤细胞系的生长。在U87 胶质细胞瘤细胞系中RASSF10 表达沉默可促进细胞增殖,反之,在H4 及U343 胶质细胞瘤细胞系中利用克隆形成实验及软琼脂集落形成实验发现恢复RASSF10 表达可抑制细胞增殖及细胞的锚定非依赖性生长[19]。RASSF10 抑制胃癌细胞的克隆形成及胃癌细胞在裸鼠体内的成瘤作用,表明RASSF10 抑制胃癌的生成[16]。
RASSF10 对化疗药物治疗敏感性也有一定的影响,多西他赛化疗药是一种有丝分裂抑制剂,在有丝分裂期特异性靶向作用于微管[29],而RASSF10 在有丝分裂期可共定位于纺锤体两极及微管中,且使细胞阻滞在G2/M 期,药物敏感性实验证明RASSF10 可提高结肠癌细胞系RKO 及HCT116 细胞对多西他赛的敏感性,提示RASSF10 甲基化可成为结肠癌细胞对多西他赛耐药的标志物[18]。
2.3 RASSF10 在肿瘤中的作用机制 肿瘤相关基因可通过参与多种信号通路对肿瘤的发生、发展发挥作用,RASSF10 通过参与Hedgehog、Wnt/β-catenin、P53等信号通路而影响肿瘤的发生、发展。
在黑腹果蝇细胞中采用全基因组RNA 干扰筛选技术发现RASSF10 表达可正调控Hedgehog 信号通路[30]。在胃癌细胞中RASSF10 可促进β-catenin 核定位,下调c-Myc、cyclin D1、cyclin E1、TCF-1、TCF-4 及CD44 的表达,抑制Wnt/β-catenin 信号通路[16]。
利用结肠癌细胞系RKO 稳定表达RASSF10 前后的mRNA 进行基因表达谱芯片分析,发现在RASSF10稳定表达的细胞系中MDM2 表达下调,而MDM2 是P53 信号通路中的关键成分,可催化P53 泛素化使其降解,提示RASSF10 可通过下调MDM2 激活P53 信号通路。进一步通过紫外照射诱导DNA 损伤模型,检测各细胞株中P53、bax、活化型Caspase-3、MDM2 及bcl-2的表达,发现只有稳定表达RASSF10 的细胞株P53、bax、活化型Caspase-3 的表达上调,MDM2 及bcl-2 的表达下调,表明RASSF10 在结肠癌中通过稳定P53 而活化P53 通路,抑制肿瘤的生长[18]。
综上所述,RASSF10 在多种肿瘤中频繁发生甲基化,且其表达受到启动子区甲基化调控,RASSF10 甲基化可能成为肿瘤诊断、预后及化疗敏感性的标志物。RASSF10 通过Wnt、P53、Hedgehog 等信号通路影响肿瘤的发生和发展。
[1] Underhill-Day N,Hill V,Latif F. N-terminal RASSF family:RASSF7-RASSF10[J]. Epigenetics,2011,6(3):284-292.
[2] Richter AM,Pfeifer GP,Dammann RH. The RASSF proteins in cancer;from epigenetic silencing to functional characterization[J]. Biochim Biophys Acta,2009,1796(2):114-128.
[3] Sherwood V,Recino A,Jeffries A,et al. The N-terminal RASSF family:a new group of Ras-association-domain-containing proteins,with emerging links to cancer formation[J]. Biochem J,2009,425(2):303-311.
[4] Sherwood V,Manbodh R,Sheppard C,et al. RASSF7 is a member of a new family of RAS association domain-containing proteins and is required for completing mitosis [J]. Mol Biol Cell,2008,19(4):1772-1782.
[5] Weitzel JN,Kasperczyk A,Mohan C,et al. The HRAS1 gene cluster:two upstream regions recognizing transcripts and a third encoding a gene with a leucine zipper domain [J]. Genomics,1992,14 (2):309-319.
[6] Djos A,Martinsson T,Kogner P,et al. The RASSF gene family members RASSF5,RASSF6 and RASSF7 show frequent DNA methylation in neuroblastoma[J]. Mol Cancer,2012,11:40.
[7] Recino A,Sherwood V,Flaxman A,et al. Human RASSF7 regulates the microtubule cytoskeleton and is required for spindle formation,Aurora B activation and chromosomal congression during mitosis[J]. Biochem J,2010,430(2):207-213.
[8] Falvella FS,Manenti G,Spinola M,et al. Identification of RASSF8 as a candidate lung tumor suppressor gene [J]. Oncogene,2006,25(28):3934-3938.
[9] Lock FE,Underhill-Day N,Dunwell T,et al. The RASSF8 candidate tumor suppressor inhibits cell growth and regulates the Wnt and NFkappaB signaling pathways [J]. Oncogene,2010,29 (30):4307-4316.
[10] Hesson LB,Dunwell TL,Cooper WN,et al. The novel RASSF6 and RASSF10 candidate tumour suppressor genes are frequently epigenetically inactivated in childhood leukaemias[J]. Mol Cancer,2009,8:42.
[11] Chen L,Johnson RC,Milgram SL. P-CIP1,a novel protein that interacts with the cytosolic domain of peptidylglycine alpha-amidating monooxygenase,is associated with endosomes [J]. J Biol Chem,1998,273(50):33524-33532.
[12] Richter AM,Zimmermann T,Haag T,et al. Promoter methylation status of Ras-association domain family members in pheochromocytoma [J].Front Endocrinol (Lausanne),2015,6:21.
[13] Lee CM,Yang P,Chen LC,et al. A novel role of RASSF9 in maintaining epidermal homeostasis[J]. PLoS One,2011,6(3):e17867.
[14] Underhill-Day N,Hill V,Latif F. N-terminal RASSF family[J].Epigenetics,2014,6(3):284-292.
[15] Guo J,Yang Y,Yang Y,et al. RASSF10 suppresses colorectal cancer growth by activating P53 signaling and sensitizes colorectal cancer cell to docetaxel[J]. Oncotarget,2015,6(6):4202-4213.
[16] Wei Z,Chen X,Chen J,et al. RASSF10 is epigenetically silenced and functions as a tumor suppressor in gastric cancer[J]. Biochem Biophys Res Commun,2013,432(4):632-637.
[17] Schagdarsurengin U,Richter AM,Wohler C,et al. Frequent epigenetic inactivation of RASSF10 in thyroid cancer[J]. Epigenetics,2009,4(8):571-576.
[18] Guo J,Yang Y,Yang Y,et al. RASSF10 suppresses colorectal cancer growth by activating P53 signaling and sensitizes colorectal cancer cell to docetaxel[J]. Oncotarget,2015,6(6):4202-4213.
[19] Hill VK,Underhill-Day N,Krex D,et al. Epigenetic inactivation of the RASSF10 candidate tumor suppressor gene is a frequent and an early event in gliomagenesis [J]. Oncogene,2011,30 (8):978-989.
[20] Helmbold P,Richter AM,Walesch S,et al. RASSF10 promoter hypermethylation is frequent in malignant melanoma of the skin but uncommon in nevus cell nevi[J]. J Invest Dermatol,2012,132(3 Pt 1):687-694.
[21] Richter AM,Walesch SK,Wurl P,et al. The tumor suppressor RASSF10 is upregulated upon contact inhibition and frequently epigenetically silenced in cancer[J]. Oncogenesis,2012,1:e18.
[22] F a。hraeus R,Olivares-Illana V. MDM2’s social network[J]. Oncogene,2014,33(35):4365-4376.
[23] Richter AM,Haag T,Walesch S,et al. Aberrant promoter hypermethylation of RASSF family members in merkel cell carcinoma[J].Cancers (Basel),2013,5(4):1566-1576.
[24] Shinawi T,Hill V,Dagklis A,et al. KIBRA gene methylation is associated with unfavorable biological prognostic parameters in chronic lymphocytic leukemia[J]. Epigenetics,2012,7(3):211-215.
[25] Lu D,Ma J,Zhan Q,et al. Epigenetic silencing of RASSF10 promotes tumor growth in esophageal squamous cell carcinoma[J]. Discov Med,2014,17(94):169-178.
[26] Deng J,Liang H,Ying G,et al. Methylation of ras association domain protein 10 (RASSF10)promoter negative association with the survival of gastric cancer[J]. Am J Cancer Res,2014,4(6):916-923.
[27] Dansranjavin T,Wagenlehner F,Gattenloehner S,et al. Epigenetic down regulation of RASSF10 and its possible clinical implication in prostate carcinoma[J]. Prostate,2012,72(14):1550-1558.
[28] Wang Y,Ma T,Bi J,et al. RASSF10 is epigenetically inactivated and induces apoptosis in lung cancer cell lines[J]. Biomed Pharmacother,2014,68(3):321-326.
[29] Murray S,Briasoulis E,Linardou H,et al. Taxane resistance in breast cancer:mechanisms,predictive biomarkers and circumvention strategies[J]. Cancer Treat Rev,2012,38(7):890-903.
[30] Nybakken K,Vokes SA,Lin TY,et al. A genome-wide RNA interference screen in Drosophila melanogaster cells for new components of the Hh signaling pathway [J]. Nat Genet,2005,37 (12):1323-1332.
