血脂康胶囊对LPS 诱导大鼠肝脏Kupffer 细胞NF- κB表达的影响
2015-12-31郝志强曾繁荣曹海燕张云雁
郝志强,曾繁荣,曹海燕,张云雁
连云港市第一人民医院1. 药学部;2. 感染科;3. 检验科,江苏 连云港222002
Kupffer 细胞主要是指位于肝窦内表面的吞噬细胞[1],是全身单核-吞噬细胞系统的重要组成部分[2],可影响肝细胞、星状细胞、内皮细胞等肝内主要组成细胞的生物学功能[3]。脂多糖(lipopolysaccharide,LPS)是革兰氏阴性细菌细胞壁中的一种重要成分[4],作为一种强有力炎症反应诱导剂,能够诱导Kupffer 细胞活化[5],参与非酒精性脂肪性肝病(nonalcoholic fattyliver disease,NAFLD)的发病。血脂康胶囊主要化学成分为红曲[6],具有治疗脂肪肝的疗效[7],并能显著降低患者血脂,改善肝功能,从而防止肝纤维化和肝硬化。本研究探讨了血脂康胶囊对LPS 诱导大鼠肝脏Kupffer 细胞核转录因子-κB(nuclear factor-κB,NFκB)活化的影响。现报道如下。
1 材料与方法
1.1 实验动物及主要试剂 血脂康胶囊购自北京北大维信生物科技有限公司。LPS 购自Sigma 公司。ELISA 试剂盒购自西塘生物技术有限公司。NF-κB p65 兔抗大鼠多克隆抗体购自英国Abcam 公司。二抗FITC 标记的山羊抗兔多克隆抗体和山羊血清封闭工作液均购自北京中衫金桥生物技术有限公司。
1.2 方法
1.2.1 SD 大鼠Kupffer 细胞分离、培养:健康雄性SD 大鼠(清洁级),体质量200 ~300 g,由中国医学科学院医学实验动物研究所提供。SD 大鼠肝脏Kupffer细胞的分离培养参照文献[8]。将分离的Kupffer 细胞按1 ×105个/ml 接种于24 孔板,培养48 h 后,对照组:常规培养。LPS 组:给予终浓度为100 ng/ml 的LPS 培养8 h。血脂康胶囊组:血脂康胶囊用生理盐水溶解,90 mg·kg-1·d-1,其余处理同LPS 组。
1.2.2 ELISA 法检测细胞炎症因子:ELISA 法测定收集的各组Kupffer 细胞上清肿瘤坏死因子-α(TNFα)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6 )水平,按试剂盒说明书操作。具体参照文献[9],根据所设标准品稀释梯度设定标准曲线,求出各样本的浓度。1.2.3 HE 染色:HE 染色观察对照组、LPS 组及血脂康胶囊组肝组织炎症变化和脂肪变性程度。
1.2.4 Western blotting 检测NF-κB p65 蛋白水平:收集Kupffer 细胞,提取不同组别Kupffer 细胞胞浆和胞核蛋白。BCA 法蛋白定量后,Western blotting 法参照文献[9],应用ECL 发光液、化学发光成像系统自动曝光采集图像。采用Image J 图像分析软件测定条带灰度值,以目的条带灰度值与β-actin 灰度值的比值反映各组胞浆IκBα、p-IκBα 及胞核NF-κB p65 蛋白表达情况。
1.3 统计学分析 采用SPSS 13.0 统计学软件进行分析。计量资料用±s 表示,采用配对t 检验。P <0.05 为差异有统计学意义。
2 结果
2.1 炎症因子 LPS 组细胞上清TNF-α、IL-1β 和IL-6 表达高于对照组(P <0.05)。血脂康胶囊组细胞上清TNF-α、IL-1β 和IL-6 低于LPS 组(P <0.05),但高于对照组(P <0.05,见表1)。
表1 血脂康胶囊对LPS 诱导Kupffer 细胞炎症因子的影响(±s)Tab 1 The effect of Fat Kang Capsule on inflammatory factors in LPS induced Kupffer cells
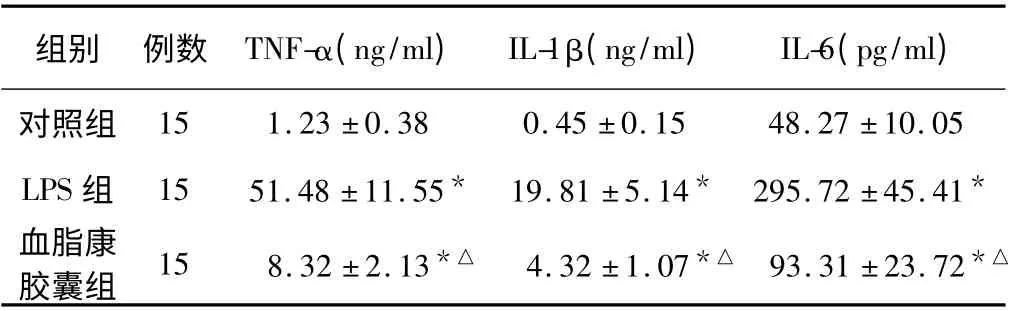
表1 血脂康胶囊对LPS 诱导Kupffer 细胞炎症因子的影响(±s)Tab 1 The effect of Fat Kang Capsule on inflammatory factors in LPS induced Kupffer cells
注:与对照组比较,*P <0.05;与LPS 组比较,△P <0.05。
组别 例数 TNF-α(ng/ml) IL-1β(ng/ml) IL-6(pg/ml)对照组15 1.23 ±0.38 0.45 ±0.15 48.27 ±10.05 LPS 组 15 51.48 ±11.55* 19.81 ±5.14* 295.72 ±45.41*血脂康胶囊组 15 8.32 ±2.13*△ 4.32 ±1.07*△ 93.31 ±23.72*△
2.2 肝脏病理变化 对照组:大鼠肝细胞偶见有散在小泡状脂肪滴。LPS 组:视野内1/3 以上的大鼠肝细胞出现脂肪变性,以肝腺泡3 带为中心,其余的大部分肝细胞变性、肿胀,胞浆内充满小的空泡。血脂康胶囊组:大鼠肝细胞脂肪变性程度明显减轻,脂滴数量减少(见图1)。

图1 各组大鼠肝组织HE 染色(200 × )A:对照组;B:LPS 组;C:血脂康胶囊组Fig 1 HE staining of liver tissue of rats in each group (200 × )A:control group;B:LPS group;C:Fat Kang Capsule group
2.3 血脂康胶囊对LPS 诱导Kupffer 细胞NF-κB水平表达影响 对照组胞浆蛋白IκBα 表达显著高于LPS 组和血脂康胶囊组(P <0.05),但LPS 组明显低于血脂康胶囊组(P <0.05,见图2)。LPS 组胞核NFκB p65 和p-IκBα 表达高于对照组和血脂康胶囊组(P <0.05),但血脂康胶囊组表达低于LPS 组(P <0.05,见图2)。
3 讨论
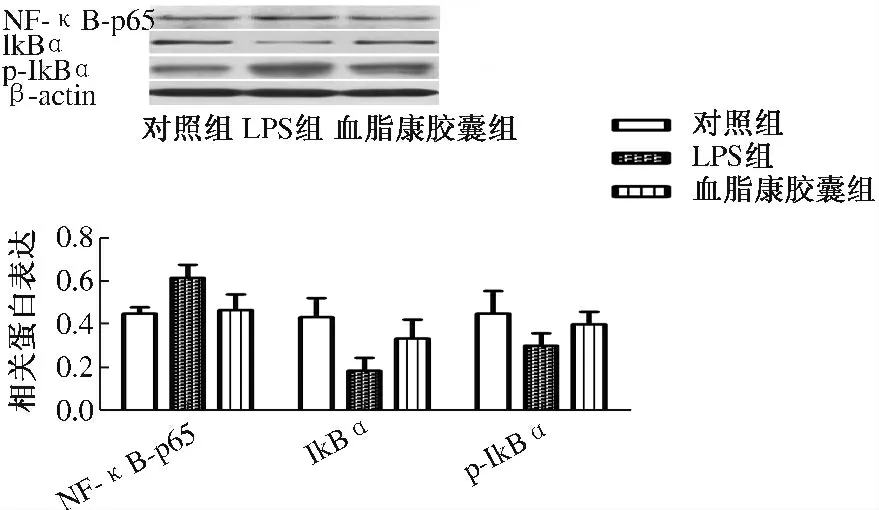
图2 血脂康胶囊对LPS 诱导Kupffer 细胞NF-κB 水平表达影响Fig 2 Effects of Fat Kang Capsule on the expression of NFκB in Kupffer cells induced by LPS
Kupffer 细胞的生物功能之一是具有清除细菌及毒素发挥抗感染作用[10],另一方面是可通过释放各种炎症介质放大炎症反应而造成组织损伤[11]。此外,Kupffer 细胞还可影响肝细胞、星状细胞、内皮细胞等肝内主要组成细胞的生物学功能[12]。因此,Kupffer 细胞在慢性炎性肝损伤过程中发挥重要作用。LPS 是革兰阴性菌细胞膜的主要脂质成分[13],LPS 可激活肝内Kupffer 细胞[14],产生炎症因子,并进一步造成肠道黏膜及远隔器官损伤。在本实验中发现,LPS 组细胞上清TNF-α、IL-1β 和IL-6 表达高于对照组。血脂康胶囊组细胞上清TNF-α、IL-1β 和IL-6 低于LPS 组,但高于对照组。血脂康胶囊可减轻这些炎症因子的合成。大鼠肝脏组织病理学观察结果也显示血脂康胶囊能够有效地抑制LPS 诱导的大鼠肝脏的肝损伤。
NF-κB 是属于Rel 家族的转录因子[15],参与调节与机体免疫、炎症反应、细胞分化有关的基因转录[16]。Kupffer 细胞的NF-κB 等是介导内毒素等多种致炎因子所致肝损害的重要分子通路[17-18],而阻断NF-κB 信号通路可抑制IL-1、TNF-α 等促炎因子介导的炎症正反馈环,减轻炎症程度。因此,以NF-κB 通路为潜在的治疗位点,可能是解决失控性炎症反应的重要方向之一。本实验观察到对照组胞浆蛋白IκBα 表达显著高于LPS 组和血脂康胶囊组,但LPS 组明显低于血脂康胶囊组。LPS 组胞核NF-κB p65 和p-IκBα 表达显著高于对照组和血脂康胶囊组,但血脂康胶囊组表达显著低于LPS 组,提示血脂康胶囊能够抑制LPS 诱导的大鼠肝脏Kupffer 细胞NF-κB 活化。
[1] Wenfeng Z,Yakun W,Di M,et al. Kupffer cells:increasingly significant role in nonalcoholic fatty liver disease[J]. Ann Hepatol,2014,13(5):489-495.
[2] Boltjes A,Movita D,Boonstra A,et al. The role of Kupffer cells in hepatitis B and hepatitis C virus infections[J]. J Hepatol,2014,61(3):660-671.
[3] Aron-Wisnewsky J,Gaborit B,Dutour A,et al. Gut microbiota and non-alcoholic fatty liver disease:new insights[J]. Clin Microbiol Infect,2013,19(4):338-348.
[4] Roth J,Blatteis CM. Mechanisms of fever production and lysis:lessons from experimental LPS fever[J]. Compr Physiol,2014,4(4):1563-1604.
[5] Al-Anati L,Essid E,Stenius U,et al. Differential cell sensitivity between OTA and LPS upon releasing TNF-α [J]. Toxins (Basel),2010,2(6):1279-1299.
[6] Su SJ,Liu CS,Yin QL,et al. The effects of Xuezhikang on the functions of endothelial progenitor cells isolated from experimental hyperlipidemic rats[J]. Progress in Modern Biomedicine,2014,14(36):7037-7041.苏绍娟,刘长山,尹青令,等. 血脂康胶囊对高脂模型大鼠EPCs功能的影响[J].现代生物医学进展,2014,14(36):7037-7041.
[7] Fan CW,He XY,Luo SY. Efficacy observation on Xuezhikang Capsule in treating fatty liver[J]. Word Chinese Medicine,2012,7(4):318-320.范才文,贺小英,罗树云. 血脂康胶囊治疗脂肪肝的疗效观察[J].世界中医药,2012,7(4):318-320.
[8] Zhang Z,Zhao SG,Ni Z,et al. An improved method for isolation rat liver Kupffer cells[J]. Chin J Gastroentrol Hepatol,2012,21(11):1060-1064.张哲,赵曙光,倪阵,等. 一种改良大鼠肝脏Kupffer 细胞分离方法[J]. 胃肠病学和肝病学杂志,2012,21(11):1060-1064.
[9] Zhang Z,Wen QS,Ni Z,et al. The effect of curcumin on expression of NF-κB and TNF-α,IL-1β and IL-6 in rat liver Kupffer cells induced by lipopolysaccharides[J]. Chin J Gastroentrol Hepatol,2013,22(10):1030-1033.张哲,闻勤生,倪阵,等. 姜黄素对脂多糖诱导大鼠肝脏Kupffer细胞NF-κB 及下游炎症因子的影响[J].胃肠病学和肝病学杂志,2013,22(10):1030-1033.
[10] Seki S,Nakashima H,Nakashima M,et al. Antitumor immunity produced by the liver Kupffer cells,NK cells,NKT cells,and CD8 CD122 T cells[J]. Clin Dev Immunol,2011,2011:868345.
[11] Yue S,Hu B,Wang Z,et al. Salvia miltiorrhiza compounds protect the liver from acute injury by regulation of p38 and NFκB signaling in Kupffer cells[J]. Pharm Biol,2014,52(10):1278-85.
[12] Li H,Zheng HW,Chen H,et al. Hepatitis B virus particles preferably induce Kupffer cells to produce TGF-β1 over pro-inflammatory cytokines[J]. Dig Liver Dis,2012,44(4):328-333.
[13] Tsutsui H,Nishiguchi S. Importance of Kupffer cells in the development of acute liver injuries in mice[J]. Int J Mol Sci,2014,15(5):7711-7730.
[14] Liu LM,Liang DY,Ye CG,et al. The UII/UT system mediates upregulation of proinflammatory cytokines through p38 MAPK and NFκB pathways in LPS-stimulated Kupffer cells[J]. PLoS One,2015,10(3):e0121383.
[15] Xiong S,She H,Sung CK,et al. Iron-dependent activation of NFkappaB in Kupffer cells:a priming mechanism for alcoholic liver disease[J]. Alcohol,2003,30(2):107-113.
[16] Wang H,Wang L,Li NL,et al. Subanesthetic isoflurane reduces zymosan-induced inflammation in murine Kupffer cells by inhibiting ROS-activated p38 MAPK/NF-κB signaling[J]. Oxid Med Cell Longev,2014,2014:851692.
[17] Kishore R,Hill JR,McMullen MR,et al. ERK1/2 and Egr-1 contribute to increased TNF-alpha production in rat Kupffer cells after chronic ethanol feeding[J]. Am J Physiol Gastrointest Liver Physiol,2002,282(1):G6-G15.
[18] Videla LA,Tapia G,Varela P,et al. Effects of acute gamma-hexachlorocyclohexane intoxication in relation to the redox regulation of nuclear factor-kappaB,cytokine gene expression,and liver injury in the rat[J]. Antioxid Redox Signal,2004,6(2):471-480.
