双环醇对二甲双胍、非诺贝特、环孢素A、他克莫司药物体外代谢的影响
2015-12-31赵曼曼扈金萍
杨 树,赵曼曼,扈金萍,盛 莉
中国医学科学院药物研究所 创新药物非临床药物代谢及药代/药效研究北京市重点实验室,北京100055
双环醇(百赛诺)是我国首个具有自主知识产权的治疗慢性肝炎的化学药。双环醇还可预防和治疗降脂药[1-2]及肾移植术后抗排斥药物引起的肝损伤[3],此外,双环醇与二甲双胍的联合应用可有效地改善合并空腹血糖调节受损(IFG)的非酒精性脂肪性肝病患者的肝功能异常及肝组织学病变[4]。应用双环醇进行上述保肝抗炎治疗是否会影响合用药物的代谢,是临床联合用药需要关注的重要问题。本研究选择了4种临床可能与双环醇合用的药物,旨在了解双环醇对这些药物体外代谢的影响,为临床合理用药提供依据。
1 材料与方法
1.1 材料 (1)药物和试剂:双环醇(Bicyclol)、盐酸二甲双胍(Metforminhydrochloride)由北京协和药厂提供,他克莫司(Tacrolimus)由华北制药集团新药研究开发中心提供,非诺贝特(Fenofibrate,批号为100733-200401)购自中国食品药品检定研究院,环孢素A(CAS:59865-13-3)购自Sigma 公司。甲醇、乙腈均为HPLC 级(美国Fisher 公司);(2)人肝微粒体购自上海瑞德肝脏疾病研究有限公司,产品编号LM-H-010M,批号FZTO;(3)实验动物:雄性SD 大鼠,200 ~220 g,购自北京维通利华实验动物技术有限公司。动物许可证编号:SCXK(京)2012-0001;(4)仪器与设备:GL-88B 漩涡混合器(江苏海门麒麟医用仪器厂),HZS-H水浴振荡器(哈尔滨市东明医疗仪器厂制造),AR1140/C 精密天平(美国OHAUS 公司),Thermo Biofuge Prime R 低温离心机(美国Thermo Scientific 公司),20PR-52D 型低温高速离心机(日本HITACHI 公司),SCP7OH 型低温超速离心机(日本HITACHI 公司),液相色谱质谱联用仪包括:Surveyor 色谱仪和TSQ Quantum Access 三重四级杆质谱仪(美国Thermo Scientific 公司)。
1.2 方法
1.2.1 大鼠肝微粒体制备:大鼠禁食过夜后断头处死,迅速取出肝脏,用冷生理盐水漂洗后称重,加冰浴TMS(含 Tris 50 mmol/L,MgCl23 mmol/L,蔗 糖200 mmol/L,pH=7.4)缓冲液制成25%匀浆(W/V),4 ℃离心10 000 g ×20 min。取上清液于4 ℃离心105 000 g×60 min,上清液为胞浆,沉淀即为微粒体。将沉淀按每克肝重加1 ml TMS 制成匀浆,分装存于-80 ℃备用。按照Lowery 法测定肝微粒体蛋白浓度,以差示分光光度法测定CYP450 酶含量。
1.2.2 大鼠和人肝微粒体体外温孵条件:实验分为对照组(无双环醇组)、同时加药组(双环醇与受试药物同时加入,预温孵5 min 后加NADPH 启动反应)及后加药组(双环醇在NADPH 存在的情况下温孵10 min后再加入受试药物)。温孵体系中含大鼠肝微粒体蛋白(0.75 mg/ml)或人肝微粒体蛋白(1 mg/ml)、NADPH 发生系统和Tris-Hcl 缓冲液(50 mmol/L,pH =7.4),反应总体积为200 μl。大鼠和人肝微粒体温孵体系中各药物浓度为双环醇4 μg/ml,他克莫司分别为60 ng/ml 和900 ng/ml[5],非诺贝特360 ng/ml,盐酸二甲双胍200 ng/ml,环孢素A 1 200 ng/ml[6-7]。温孵时间:他克莫司与大鼠和人肝微粒体分别温孵20 min、8 min,非诺贝特/二甲双胍/环孢素A 与大鼠和人肝微粒体均温孵30 min。测定他克莫司和二甲双胍原型药含量及环孢素A 和非诺贝特代谢产物含量。
1.2.3 标准曲线制备:(1)他克莫司:空白肝微粒体温孵液(200 μl)中分别加入不同浓度他克莫司工作液(10、25、100、250 ng/ml、1、2.5、5 μg/ml)40 μl,再加入360 μl 乙腈,振荡混匀,14 000 ×5 min 离心2 次,取上清液5 μl 进行LC/MS 分析。(2)二甲双胍:空白肝微粒体温孵液(200 μl)中分别加入不同浓度二甲双胍工作液(25、100、250 ng/ml,1、2.5、4、5 μg/ml)40 μl,再加入360 μl 乙腈,振荡混匀,14 000 ×5 min 离心2 次,取上清液5 μl 进行LC/MS 分析。(3)环孢素A:空白肝微粒体温孵液(200 μl)中分别加入不同浓度环孢素A 工作液(50、250 ng/ml,1、2.5、5、6、8 μg/ml)40 μl,再加入360 μl 乙腈,振荡混匀,14 000 ×5 min 离心2次,取上清液5 μl 进行LC/MS 分析。
1.2.4 LC-MS 检测条件:(1)他克莫司:CAPCELL PAK色谱柱(2.1 mm ×100 mm,5 μm),流动相为乙腈:10 mmol/L醋酸铵水溶液(95∶5),流速为0.2 ml/min,SRM 检测m/z 826.4→616.0。(2)二甲双胍:CAPCELL PAK 色谱柱(2.1 mm×100 mm,5 μm),流动相为乙腈:10 mmol/L 醋酸铵水溶液(75 ∶25),流速为0.3 ml/min,SRM 检测m/z 130 →71. 2。(3)环孢素A:CAPCELL PAK 色谱柱(2.1 mm×100 mm,5 μm),流动相为甲醇:10 mmol/L 醋酸铵水溶液(97∶3),流速为0.3 ml/min,SRM 检测m/z 1202.8→425.1(环孢素A);m/z 1218.8→425.1(环孢素A 单加氧化代谢产物)。(4)非诺贝特酸:Zorbax SB-C18 色谱柱(2.1 mm×100 mm,3.5 μm),流动相为甲醇:10 mmol/L 醋酸铵水溶液(90∶10,含0.1%甲酸),流速0.2 ml/min,SRM 检测m/z 319.1→232.9。
1.3 统计学处理 将加药温孵组与加药0 时组比较,计算原型药代谢速率或代谢产物生成速率。由下列公式计算双环醇对合用药物体外代谢抑制率:抑制率(%)=(对照组代谢速率-加药组代谢速率)/对照组代谢速率×100%。组间原型药含量或代谢产物含量采用Student’s test 分析,P <0. 05 为差异有统计学意义。
2 结果
2.1 肝微粒体温孵液中药物标准曲线 肝微粒体温孵液中各药物峰面积和浓度线性关系良好,相关系数为0.9907 ~0.9987(见图1 ~2)。
2.2 双环醇对二甲双胍、非诺贝特、环孢素A、他克莫司在大鼠肝微粒体中代谢的影响 他克莫司(60 ng/ml)与大鼠肝微粒体(0. 75 mg/ml)温孵20 min 后减少77.5%,代谢速率为3.58 pmol·min-1·mg-1)。双环醇(10 μmol/L)与他克莫司同时和预先温孵后,他克莫司含量与对照组相比差异无统计学意义(P >0.05),提示双环醇对他克莫司在大鼠肝微粒体中的代谢无明显影响。二甲双胍(200 ng/ml)与大鼠肝微粒体温孵30 min 含量无明显减少,提示二甲双胍在大鼠肝微粒体中稳定。双环醇同时和预温孵对二甲双胍在大鼠肝微粒体中的稳定性无明显影响(见表3)。如表4 所示,非诺贝特(360 ng/ml)与大鼠肝微粒体温孵30 min 后可检测到代谢产物非诺贝特酸,双环醇同时和预温孵组非诺贝特酸生成量与对照组相比差异无统计学意义(P >0.05),提示双环醇对非诺贝特在大鼠肝微粒体中的代谢无明显影响。环孢素A(1 200 ng/ml)与大鼠肝微粒体温孵30 min 后可检测到环孢素A 单加氧代谢物,双环醇同时和预温孵组环孢素A 单加氧代谢物生成量与对照组相比差异无统计学意义(P >0.05),提示双环醇对环孢素A 在大鼠肝微粒体中的代谢无明显影响(见表5)。

图1 大鼠肝微粒体温孵液中他克莫司(A)和二甲双胍(B)标准曲线Fig 1 Calibration curve of Tacrolimus and Metformin in rat liver microsomes

图2 人肝微粒体温孵液中他克莫司(A)、二甲双胍(B)和环孢素A(C)标准曲线Fig 2 Calibration curve of Tacrolimus,Metformin and Cyclosporine A in human liver microsomes
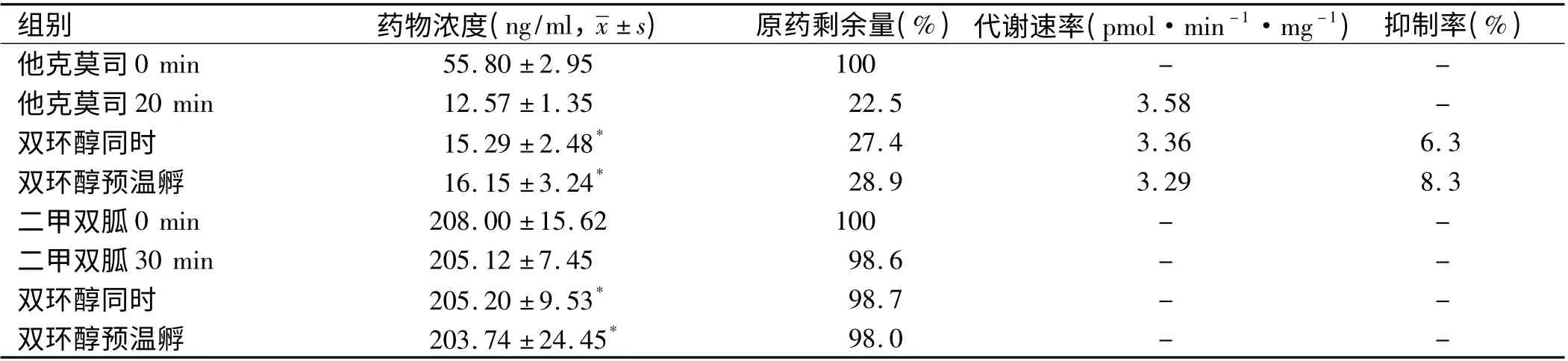
表3 双环醇对他克莫司和二甲双胍在大鼠肝微粒体中代谢的影响Tab 3 Effect of Bicyclol on tacrolimus and Metformin metabolism in rat liver microsomes
2.3 双环醇对二甲双胍、非诺贝特、环孢素A、他克莫司在人肝微粒体中代谢的影响 他克莫司(900 ng/ml)与人肝微粒体温孵8 min 后减少64. 4%,双环醇(10 μmol/L)同时和预温孵组他克莫司剩余含量与对照组相比差异无统计学意义(P >0. 05);环孢素A(1 200 ng/ml)与人肝微粒体温孵30 min 后剩余66.7%,双环醇同时和预温孵组对环孢素A 剩余量无明显影响。此外,双环醇同时和预温孵组二甲双胍含量与对照组相比差异无统计学意义(P >0.05),提示双环醇对他克莫司、环孢素A 和二甲双胍在人肝微粒体中的代谢均无明显影响(见表6)。非诺贝特(360 ng/ml)与人肝微粒体温孵30 min 可以检测到代谢产物非诺贝特酸,双环醇同时和预温孵组非诺贝特酸生成量与对照组相比差异无统计学意义(P >0.05),提示双环醇对非诺贝特在人肝微粒体中的代谢也无明显影响(见表7)。
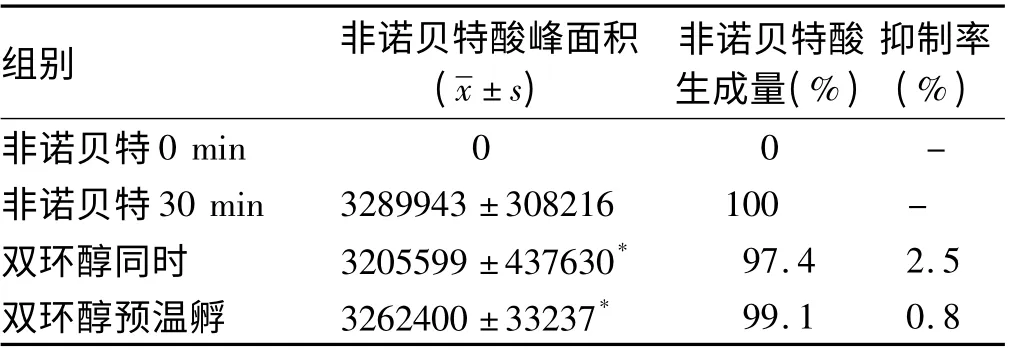
表4 双环醇对非诺贝特在大鼠肝微粒体中代谢的影响Tab 4 Effect of Bicyclol on Fenofibrate metabolism in rat liver microsomes

表5 双环醇对环孢素A 在大鼠肝微粒体中代谢的影响Tab 5 Effect of Bicyclol on Cyclosporine A metabolism in rat liver microsomes

表6 双环醇对他克莫司、环孢素A 和二甲双胍在人肝微粒体中代谢的影响Tab 6 Effect of Bicyclol on Tacrolimus,Cyclosporine A and Metformin metabolism in human liver microsomes
注:与对照组(无双环醇组)比较,* P >0.05。

表7 双环醇对非诺贝特在人肝微粒体中代谢的影响Tab 7 Effect of Bicyclol on Fenofibrate metabolism in human liver microsomes
3 讨论
以往研究显示,双环醇主要经大鼠和人肝微粒体CYP3A 代谢[8],对CYP3A 无明显抑制作用,仅有轻微的诱导作用,对其自身代谢无影响。二甲双胍是目前应用最为广泛的抗糖尿病药物[9]。二甲双胍主要经肾脏排泄,在肝内不代谢。环孢素A 和他克莫司均为强效免疫抑制剂,其中他克莫司具有急性排斥反应发生率和严重程度较低的特点[10],已逐渐取代环孢素A成为器官移植术后的首选药物。非诺贝特为第二代苯氧芳酸类降血脂药,用于治疗成人饮食控制疗法效果不理想的高脂血症。已知环孢素A、他克莫司、非诺贝特都是通过CYP3A 代谢[11]的临床药物,因此,本研究选择上述临床常用且主要经CYP3A 代谢的药物观察双环醇对上述药物体外代谢的影响。
研究结果表明,他克莫司与大鼠和人肝微粒体温孵分别减少77.5%、64.4%,环孢素A 和非诺贝特温孵后检测到代谢产物生成,提示本研究使用的体外代谢温孵体系可靠。二甲双胍与大鼠和人肝微粒体温孵30 min 无明显减少,提示二甲双胍不经肝脏CYP450代谢。在大鼠肝微粒体温孵体系中,双环醇(10 μmol/L)同时加入和预温孵后对环孢素A 和非诺贝特代谢产物生成的抑制率均<10%,对他克莫司代谢及二甲双胍含量也无明显影响。在人肝微粒体温孵体系中,双环醇(10 μmol/L)同时加入和预温孵后对他克莫司和环孢素A 代谢的抑制率均<10%,对非诺贝特酸的生成及二甲双胍含量均无明显影响。
本研究选择的双环醇浓度明显高于临床最高血药浓度[12],各受试临床合用药物浓度均在临床可达到的血药浓度范围内,因此推测双环醇对临床合用药药物代谢影响的可能性较小。鉴于联合用药后药物在体内吸收、分布、代谢、排泄等过程较为复杂,且存在个体差异,因此,双环醇对人体内临床联合用药的影响程度有待进一步研究。
[1] Xu BR.The analysis of the efficacy on hepatic injury induced by statins treated withbicycle[J].Capital Medicine,2012,16(8):42-43.徐宝荣. 双环醇片治疗他汀类降脂药所致肝损害的临床疗效分析[J].首都医药,2012,16(8):42-43.
[2] Wang YF,Shi HJ,Yin BY,et al. Therapeutic efficacy of bicyclol on the hepatic injuryinduced by Statins[J]. PJCCPVD,2013,21(6):132-133.王艳飞,石红娟,尹博英,等.双环醇预防他汀类药物肝损害的临床疗效观察[J].实用心脑肺血管病杂志,2013,21(6):132-133.
[3] Hu XP,Yin H,Wang W,et al. Therapeutic efficacy of bicyclol for the drug induced hepatic injury after renal transplantation[J].Chin J Gastroenterol Hepatol,2012,21(4):342-344.胡小鹏,尹航,王玮,等.双环醇片治疗肾移植术后药物性肝损伤的疗效观察[J].胃肠病学和肝病学杂志,2012,21(4):342-344.
[4] Han Y,Shi JP,Ma AL,et al. Randomized,Vitamin E-controlled trial of Bicyclol plus Metformin in non-alcoholic fatty liver disease patients with impaired fasting glucose[J]. Clin Drug Investig,2014,34(1):1-7.
[5] Venkataramanan R,Zang S,Gayowski T,et al. Voriconazole inhibition of the metabolism of tacrolimus in a liver transplant recipient and in human liver microsomes[J]. Antimicrob Agents Chemother,2002,46(9):3091-3093.
[6] Pichard L,Fabre I,Fabre G,et al. Cyclosporin A drug interactions.Screening for inducers and inhibitors of cytochrome P-450 (cyclosporin A oxidase)in primary cultures of human hepatocytes and in liver microsomes[J]. Drug Metab Dispos,1990,18(5):595-606.
[7] Vickers AE,Fischer V,Connors S,et al. Cyclosporin A metabolism in human liver,kidney,and intestine slices. Comparison to rat and dog slices and human cell lines[J]. Drug Metab Dispos,1992,20(6):802-809.
[8] Ju MH,Li Y.Metabolism of bicyclol in rat and human liver microsomes in vitro[J]. Acta Pharmaceutica Sinica,2005,40(2):111-116.鞠美华,李燕.双环醇在大鼠和人肝微粒体的代谢[J]. 药学学报,2005,40(2):111-116.
[9] American Diabetes Association. Standards of medical care in diabetes-2011[J]. Diabetes Care,2011,34(Suppl 1):S11-S61.
[10] Guo YT,Tan ZG. Immunosuppressant medicines for renal transplantation:A literature analysis based on Science Citation Index database from 2001 to 2010 [J]. Chinese Journal of Tissue Engineering Research January,2012,16(5):885-894.郭奕彤,谭志刚. 肾移植与免疫抑制剂的应用研究:SCI 数据库2001/2010 年收录文献检索分析[J]. 中国组织工程研究,2012,16(5):885-894.
[11] Sun ZS,Zhu Z. Progress of metabolic drug interactions[J]. ADRJ,2000,(1):6-14.孙忠实,朱珠.药物代谢性相互作用研究进展[J]. 药物不良反应杂志,2000,(1):6-14.
[12] Ji YY,Cheng NN,Yao GB.Pharmacokinetic study of bicyclol in thirty health volunteers[J]. Chin J Pharmacol Ther,2001,6(3):219-223.计焱焱,程能能,姚光弼. 30 例健康志愿者口服双环醇片剂的药代动力学研究[J]. 中国临床药理学与治疗学,2001,6(3):219-223.
