辛伐他汀对大鼠门脉高压性胃病的作用
2015-12-31王华侨李天明罗宏武
王华侨,李天明,罗宏武
中南大学湘雅三医院普通外科,湖南 长沙410013
门脉高压性胃病(portal hypertensive gastropathy,PHG)是指门脉高压症伴发的胃黏膜非炎症病变,是上消化道出血的重要原因之一,严重时危及生命。PHG 的发病机制十分复杂,目前认为是多因素、多种作用机制共同参与并相互作用形成的。NO 在PHG的发生、发展中发挥了关键作用[1]。有研究表明,PHG大鼠模型中胃黏膜组织内NO 含量明显增高[2]。NO由一氧化氮合酶合成,包括组织型一氧化氮合酶(constitutive nitric oxide synthase,cNOS)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)。参与致病的NO 则主要由iNOS 合成[3]。他汀类药物是3-羟-3-甲基戊二酸单酰辅酶A 还原酶抑制剂,除了其降脂作用外,近年研究发现他汀类药物能够抑制iNOS,减少NO 的产生[4-5]。目前国内外尚未见他汀类药物治疗PHG 的相关报道,本文拟通过动物实验研究辛伐他汀对大鼠PHG 的作用并探讨其可能机制,为药物治疗PHG 提供一种新方法。
1 材料与方法
1.1 主要试剂、仪器和实验对象 辛伐他汀购自山东鲁抗医药集团赛特有限责任公司(产品批号:130101);BCA 蛋白浓度测定试剂盒,购自上海碧云天生物技术有限公司;一氧化氮合成酶试剂盒(分型)、一氧化氮测定试剂盒(硝酸还原法)购自南京建成生物工程研究所;健康雄性Wistar 大鼠40 只,SPF 级,体质量220 ~250 g,购自中南大学湘雅医学院实验动物学部;组织匀浆机、MIAS-2000 图像分析系统、TV-1901双光束紫外可见光分光光度计、奥林巴斯BX51 光学显微镜、日立7600 全自动生化分析仪由中南大学湘雅医学院实验中心提供。
1.2 方法
1.2.1 动物分组和模型制备:健康雄性Wistar 大鼠40 只,随机分为假手术组(SO 组,n =14)、结扎组(LIG 组,n=14)、辛伐他汀治疗组(SVS 组,n =12)。LIG 组和SVS 组造模方法采用门静脉主干部分结扎+左肾上腺静脉结扎法,2 周后即可形成PHG 大鼠模型[6]。SO 组仅分离门静脉和左侧肾上腺静脉及周围血管而不结扎,余操作同结扎组。各实验组大鼠关腹术后5 d 内常规肌注青霉素注射液200 000 U/d。
1.2.2 给药方法和标本采集:造模2 周后对SVS 组大鼠予以辛伐他汀(20 mg/kg)溶于水后灌胃,同时SO组和LIG 组给予等量生理盐水,1 次/d,持续4 周。于造模后2 周从SO 组和LIG 组大鼠中随机抽取3 只,测定门静脉压力(portal pressure,PP)值。PP 值测定后,处死大鼠完整摘除胃,经10%甲醛固定30 min 后,沿胃大弯剪开胃,生理盐水清洗胃黏膜黏液及血迹,肉眼下观察胃黏膜损伤程度。
1.2.3 PP 值测定:大鼠经乙醚麻醉后沿腹中线进腹,切口长约5 cm,找到肠系膜上静脉与脾静脉汇合点上方,将一充满肝素钠生理盐水的5 号静脉输液套管针逆行穿刺刺入门静脉,然后拔出针芯。固定套管针后,以大鼠右心房为“0”点测量门静脉压力,PP 值>16 cm H2O 可诊断为大鼠门脉高压症[7]。
1.2.4 胃黏膜形态学观察:给药4 周后,处死并采集各组大鼠胃黏膜,采集方法同前,分别在肉眼和光学显微镜下观察胃黏膜损伤程度。另外取部分胃底组织于甲醛液中固定,常规石蜡包埋,连续4 μm 切片行HE染色,其余标本液氮冻存。
1.2.5 黏膜下层毛细血管面积和最大直径测定:光学显微镜下对胃底组织HE 染色切片,应用计算机辅助图像分析系统检测和统计黏膜下毛细血管面积和最大直径[8]。每张切片各随机选择5 个视野(100)测定胃底黏膜下血管最大直径和面积,结果取其平均值。
1.2.6 胃黏膜组织iNOS、cNOS 活性及NO 含量测定:取出液氮冻存标本并复温,分析天平称取0.2 g胃底组织,于冰盐水洗净血迹。加入生理盐水制备重量体积比为10%组织匀浆,高速冷冻离心机4 000 r/min离心10 min,保留上清液弃去沉淀,取部分上清液用BCA 法测定蛋白质含量。其余部分用于cNOS、iNOS活性和NO 浓度的测定。测定方法依据一氧化氮合成酶试剂盒(分型)及一氧化氮测定试剂盒(硝酸还原法)说明书操作。
1.3 统计学处理 采用SPSS 16.0 软件包进行统计分析,数据以±s 表示,符合正态分布资料采用单因素方差分析(ANOVA)检验;若为非正态分布资料则采用Games-Howell 检验。P <0. 05 为差异有统计学意义。
2 结果
2.1 造模情况 大鼠经造模或假手术后,术后前2 d状态欠佳,活动量及进食量较少,3 d 后恢复正常活动和饮食。LIG 组大鼠造模术后死亡1 只,考虑为手术操作时间较长,麻醉过深所致。SVS 组大鼠在辛伐他汀灌胃期间死亡1 只,为灌胃数分钟内死亡,考虑为药物误入气管窒息所致。造模后第2 周测定结果SO 组大鼠PP 值分别为10. 4 cmH2O、10. 7 cmH2O 和11.2 cmH2O,LIG 组大鼠PP 值分别为23.3 cmH2O、23.1 cmH2O 和24.2 cmH2O。胃大体标本可见SO 组大鼠胃黏膜皱襞光滑,无黏膜充血水肿及出血点、糜烂及坏死;LIG 组大鼠胃黏膜充血水肿及广泛糜烂、出血点(见图1),提示造模成功。
2.2 PP 值 LIG 组大鼠平均PP 值(24.26 ± 2.14)cmH2O 较SO 组(10.35 ± 1.32)cmH2O 显著增加(P <0.01),SVS 组的平均PP 值(18.33 ± 2.11)cmH2O 较LIG 组明显下降(P <0. 01),但仍高于SO 组(P <0.01)。
2.3 胃黏膜形态学观察 大鼠处死后,胃大体形态观察可见SO 组大鼠胃黏膜光滑,未见散在出血点、黏膜下充血水肿及毛细血管扩张;LIG 组大鼠可见广泛胃黏膜充血、糜烂,局部小溃疡形成伴点状出血;SVS组以上病变较LIG 组减轻(见图2);HE 染色可见LIG组黏膜上皮细胞脱落,毛细血管迂曲扩张,充血明显,黏膜下层水肿增厚;SVS 组病变较LIG 组缓解(见图3)。

图1 造模2 周胃大体标本 A:SO 组;B:LIG 组Fig 1 Gross morphology of gastric mucosa of rats after modeling for 2 weeks A:SO group;B:LIG group
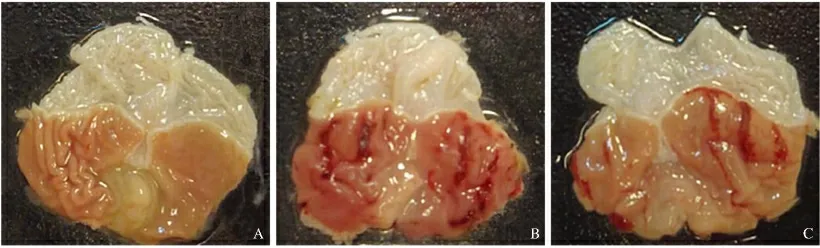
图2 各组大鼠胃黏膜大体形态 A:SO 组;B:LIG 组;C:SVS 组Fig 2 Gross morphology of gastric mucosa of rats in different groups A:SO group;B:LIG group;C:SVS group
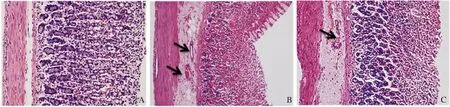
注:箭头所示为黏膜下血管。图3 各组大鼠胃黏膜HE 染色(100 ×) A:SO 组;B:LIG 组;C:SVS 组Fig 3 HE stain of gastric mucosa of rats in different groups (100 ×) A:SO group;B:LIG group;C:SVS group
2.4 药物对胃黏膜下血管的影响 LIG 组黏膜下毛细血管面积和最大直径较SO 组明显增多(P <0.01),SVS 组黏膜下毛细血管面积和最大直径较LIG 组减少(P <0.01),但仍高于SO 组(P <0.01,见表1)。
表1 各组大鼠胃黏膜下层血管面积、最大直径比较(±s)Tab 1 Comparison of the area and maximum diameter of gastric mucosal capillaries of rats in each group (±s)

表1 各组大鼠胃黏膜下层血管面积、最大直径比较(±s)Tab 1 Comparison of the area and maximum diameter of gastric mucosal capillaries of rats in each group (±s)
注:与SO 组比较,★P <0.01;与LIG 组比较,▲P <0.01 。
SO 组★▲
2.5 胃黏膜组织的iNOS、cNOS 活性测定及NO 含量测定 LIG 组胃壁组织中iNOS 的活性和NO 的含量显著高于SO 组(P <0.01);SVS 组iNOS 的活性和NO 含量明显低于LIG 组,但仍高于SO 组(P <0.01,见表2)。
表2 各组大鼠胃黏膜组织iNOS、cNOS 活性及NO 含量(±s)Tab 2 Constitutive nitric oxide synthase activity,inducible nitric oxide synthase activity and NO content of the gastric mucosal tissue of rats in each group (±s)

表2 各组大鼠胃黏膜组织iNOS、cNOS 活性及NO 含量(±s)Tab 2 Constitutive nitric oxide synthase activity,inducible nitric oxide synthase activity and NO content of the gastric mucosal tissue of rats in each group (±s)
注:与SO 组比较,★P <0.01;与LIG 组比较,▲P <0.01。
组别 只数cNOS 活性(U/mg)iNOS 活性(U/mg)NO 含量(μmol/g)11 0.568 ± 0.104 0.106 ± 0.025 0.612 ± 0.106 LIG 组10 0.895 ± 0.113★ 0.712 ± 0.108★ 2.660 ± 0.431★SVS 组11 0.706 ± 0.116★▲0.332 ± 0.084★▲1.686 ± 0.145 SO 组★▲
3 讨论
PHG 表现为胃黏膜淤血、水肿和糜烂,呈马赛克或蛇皮样改变。目前研究认为NO 参与了PHG 的形成[1]。NO 的强力扩张血管作用引起胃黏膜微循环障碍并作为自由基引发脂质过氧化损伤胃黏膜。cNOS合成生理状态的NO,调节各种生理功能;iNOS 在生理状态不表达,受到如TNF-α、内毒素等刺激时大量合成非生理浓度的NO,对细胞产生损害作用。门静脉高压所致门-体分流引起内毒素血症,刺激TNF-α、IFNγ、ET-1 等细胞因子大量产生,可刺激胃黏膜iNOS 的表达及活性明显增强[3],使局部NO 合成增加,形成恶性循环。另外,过量NO 还可破坏胃黏膜的防御机制[9]。
他汀类药物具有诸多非降脂作用。研究发现他汀类药物可抑制iNOS,减少NO 生成[4-5],明显降低TNF-α 和IFN-γ 诱导的iNOS 的水平[10];抑制血小板的黏附与聚集,预防心血管血栓形成,其机制可能与其上调cNOS mRNA 表达,增加NO 含量有关[11];保持内皮细胞表面光滑完整,调节微循环及白细胞相互作用[12];显著降低内毒素休克大鼠血浆过量的NO,恢复血管反应性[13]。本研究表明,与SO 组相比,LIG 组大鼠PP 值、胃黏膜病变、胃黏膜组织内iNOS 活性及NO含量均出现明显的增高,提示iNOS 过度激活,NO 大量产生,并对胃黏膜产生了明显的损伤作用,与以往报道一致[14-15]。SVS 组与LIG 组比较,各项指标均有不同程度改善,胃黏膜组织iNOS 活性及NO 的含量均下降明显,表明辛伐他汀对大鼠PHG 有治疗作用,其机制与降低胃黏膜iNOS 活性、减少NO 的过量产生有关。同时,实验还发现,LIG 组cNOS 活性较SO 组明显增加,这是机体对损伤因素的一种自我保护机制。SVS 组iNOS 活性及NO 的含量下降后,cNOS 活性也伴有不同程度降低,提示机体可根据损伤因素强弱程度自主调节cNOS 活性,使其在新的状态下达到平衡。在本研究中,与SO 组相比,LIG 组的iNOS 活性增高约6 倍,cNOS 仅增高约50%,LIG 组cNOS 和iNOS 活性相对比例失衡,使破坏因素相对增强,加重了胃黏膜损伤;而给予辛伐他汀治疗后,则在一定程度上纠正了这种失衡。另外,iNOS 催化合成NO 的能力较cNOS大,但当cNOS 催化合成的微量NO 上调,则有利于内皮功能的恢复[16],由此推测cNOS 和iNOS 及其相应产物可能通过不同的代谢途径和作用机制参与细胞病理生理过程。SVS 组各测量指标尚未完全恢复正常,一方面提示PHG 病变是由多因素、多种发病机制共同作用形成的,NO 含量、iNOS 活性的增加及cNOS 和iNOS 活性相对比例的失衡在PHG 发病中发挥了重要作用,但并非唯一因素;另一方面可能与辛伐他汀给药时间过短有关,有待进一步研究。
总之,本研究表明辛伐他汀对PHG 模型大鼠胃黏膜具有一定保护作用,其机制可能是通过降低胃黏膜iNOS 活性、减少NO 的过量产生及恢复iNOS 与cNOS活性的相对平衡有关。
[1] Ohta M,Yamaguchi S,Gotoh N,et al. Pathogenesis of portal hypertensive gastropathy:a clinical and experimental review[J]. Surgery,2002,131(1 Suppl):S165-S170.
[2] Marques C,Mauriz JL,Simonetto D,et al. Glutamine prevents gastric oxidative stress in an animal model of portal hypertension gastropathy[J].Ann Hepatol,2011,10(4):531-539.
[3] Helmer KS,West SD,Chang L,et al. Gastric nitric oxide synthase expression during endotoxemia:implications in mucosal defense in rats[J].Gastroenterology,2002,123(1):173-186.
[4] Madonna R,Di Napoli P,Massaro M,et al. Simvastatin attenuates expression of cytokine-inducible nitric-oxide synthase in embryonic cardiac myoblasts[J]. J Biol Chem,2005,280(14):13503-13511.
[5] Dobashi K,Araki S,Kubo K,et al. Hydroxymethylglutaryl-CoA reductase inhibitor inhibits induction of nitric oxide synthase in 3T3-L1 preadipocytes[J]. Life Sci,2008,82(1-2):85-90.
[6] Zhang R,Liu XY. Effect of losartan on portal hypertensive gastropathy in rats[J]. J Cent Couth Univ (Med Sci),2007,32(3):494-497.张瑞,刘浔阳. 洛沙坦在大鼠门脉高压性胃病中的作用[J]. 中南大学学报(医学版),2007,32(3):494-497.
[7] Schneider AR,Benz C,Adamek HE,et al. Minilaparoscopy versus conventional laparoscopy in the diagnosis of hepatic diseases[J]. Gastrointest Endosc,2001,53(7):771-775.
[8] Huo LJ,Xu DY. Histological and ultrastructual studies on colonic mucosa of patients and rats with cirrhotic portal hypertension[J]. Chin J Dig,1996,16(6):336-338.霍丽娟,徐大毅. 肝硬化门脉高压病人及大鼠结肠粘膜的光电镜观察[J]. 中华消化杂志,1996,16(6):336-338.
[9] Baatar D,Kitano S,Yoshida T,et al. The role of nitric oxide in the inhibition of gastric epithelial proliferation in portal hypertensive rats[J].J Hepatol,1999,30(6):1099-1104.
[10] Wagner AH,Schwabe O,Hecker M. Atorvastatin inhibition of cytokine-inducible nitric oxide synthase expression in native endothelial cells in situ[J]. Br J Pharmacol,2002,136(1):143-149.
[11] Yokoyama S,Ikeda H,Haramaki N,et al. HMG-CoA reductase inhibitor protects against in vivo arterial thrombosis by augmenting platelet-derived nitric oxide release in rats[J]. J Cardiovasc Pharmacol,2005,45(4):375-381.
[12] Scalia R,Stalker TJ. Microcirculation as a target for the anti-inflammatory properties of statins[J]. Microcirculation,2002,9(6):431-442.
[13] Giusti-Paiva A,Martinez MR,Felix JV,et al. Simvastatin decreases nitric oxide overproduction and reverts the impaired vascular responsiveness induced by endotoxic shock in rats[J]. Shock,2004,21(3):271-275.
[14] Kawanaka H,Kinjo N,Anegawa G,et al. Abnormality of the hepatic vein waveforms in cirrhotic patients with portal hypertension and its prognostic implications[J]. J Gastroenterol Hepatol,2008,23(7 Pt 2):e129-e136.
[15] Ei-Newihi HM,Kanji VK,Mihas AA. Activity of gastric mucosal nitric oxide synthase in portal hypertensive gastropathy[J]. Am J Gastroenterol,1996,91(3):535-538.
[16] Xian HT,Yao HG,Zhang YL. Effects of statins on the nitric oxide synthase during sepsis[J]. China Tropical Medicine,2008,8(3):487-489.冼海涛,姚华国,张媛莉. 他汀类药物对脓毒症一氧化氮合酶的影响[J]. 中国热带医学,2008,8(3):487-489.
