慢性肾衰竭大鼠血清和尿液血管紧张素原与肾功能指标及病理改变的相关性
2015-12-31胡天晓,牛凯,刘冰
慢性肾衰竭大鼠血清和尿液血管紧张素原与肾功能指标及病理改变的相关性
胡天晓牛凯刘冰
(河北省人民医院肾内科,河北石家庄050051)
摘要〔〕目的研究慢性肾衰竭大鼠血清及尿液血管紧张素原(AGT)与肾功能指标及肾脏病理损伤程度之间的关系。 方法采用5/6肾切除法建立慢性肾衰竭的大鼠模型,测定慢性肾衰进展过程中不同阶段的血清肌酐、尿素氮、尿液肌酐、尿蛋白定量情况,并计算肌酐清除率,对肾脏行病理观察并利用肾小球硬化指数(GSI)、肾小管间质损伤指数(TIS)两项指标评价损伤程度,同时采用酶联免疫吸附(ELISA)方法测定血清、尿液的血管紧张素Ⅱ(AngⅡ)和AGT水平,分析AGT与各指标之间的相关性。结果血AGT与各项指标均无显著相关性。尿AGT与Ccr呈显著负相关(r=-0.667,P<0.01),与尿AngⅡ呈显著正相关(r=0.497,P<0.01),与GSI呈正相关(r=0.545,P<0.05),与其他指标无显著相关性。结论尿AGT在一定程度上能够反映肾功能的情况,并可作为评价肾小球硬化程度的一项无创性指标。
关键词〔〕慢性肾衰竭;血管紧张素原;血管紧张素Ⅱ;病理损伤评价
中图分类号〔〕R692.5〔文献标识码〕A〔
基金项目:河北省科技支撑计划项目(12276104D85)
通讯作者:刘冰(1964-),男,教授,主任医师,硕士生导师,主要从事慢性肾脏病的基础及临床研究。
第一作者:胡天晓(1987-),女,在读硕士,主要从事慢性肾脏病的基础及临床研究。
血管紧张素原(AGT)作为肾素-血管紧张素系统的主要组分之一,是肾素的唯一底物,其水平可能能够反映RAS系统激活的状态,AGT主要在肝脏合成,肝外组织也有AGT mRNA表达,由于其分子量约为50~60 kD,循环中的AGT不能通过肾小球的滤过膜,肾脏局部的AGT主要是由近端肾小管分泌产生的〔1〕,进一步形成血管紧张素Ⅱ(AngⅡ),未转化的AGT随尿液排出体外,肾内血管紧张素原水平与循环中的水平关系不大。尿液AGT与肾脏疾病状态的关系如何尚未见报道。本研究通过建立慢性肾衰竭的大鼠模型研究了血清及尿液AGT与肾功能指标及病理改变的相关性。
1材料与方法
1.1动物模型建立选取5~6周龄、体重150~170 g清洁级雄性SD大鼠84只,购自河北省实验动物中心。大鼠自由饮水,常规饲养。适应性喂养1 w后,随机分组:假手术组(n=42)和模型组(n=42)。模型组采用经典的Platt法〔2〕进行5/6肾切除术制作慢性肾衰竭模型,手术分Ⅰ、Ⅱ两期进行。假手术组同期进行手术,均采取同样步骤,但两次手术均仅分离肾周脂肪囊及肾蒂,剥离左、右肾筋膜,不做肾切除。
1.2动物分组及取材以Ⅱ期手术结束作为观察周期的起点,分别于第4、6、8、10、12、14周末的前1 d随机抽取假手术组、模型组大鼠各6只,禁食,自由饮水,分别置于代谢笼中,收集24 h尿液,记录总尿量,留存尿液约5 ml,3 000 r/min离心10 min,取上清置于-70℃保存,余尿液立即送检24 h尿蛋白定量(UP)。于上述各周末以3%水合氯醛腹腔注射麻醉动物后,腹主动脉穿刺取血,收集全血标本约6 ml,3 000 r/min离心10 min,取上层血清置于-70℃保存。假手术组摘取左侧肾脏、模型组摘取左侧残肾,沿标本长轴适当切分后,立即投入4%甲醛缓冲液中固定,待行病理切片染色。
1.3观察指标观察大鼠精神状态、活动度、毛发光泽度、摄食及死亡情况。每两周称量1次体重,观察体重变化情况。
1.3.1生化测定采用日本HITACHI 7600-110型全自动生化分析仪测定血清肌酐(Scr)、尿素氮(BUN)及尿液肌酐(Ucr)。酸沉淀比浊法测定24 h尿蛋白定量。参照文献〔3〕计算肌酐清除率(Ccr)。
1.3.2肾脏病理检查对已固定的肾脏组织进行石蜡包埋,行HE、PAS及Masson染色。采用Raij等〔4〕的半定量评分系统评价肾小球的损伤程度,每张PAS染色切片于高倍镜下观察40个肾小球,按肾小球受损情况分为0~4级病变。0级:肾小球无硬化;1级:肾小球硬化面积≤25%;2级:25%<肾小球硬化面积≤50%;3级:50%<肾小球硬化面积≤75%;4级:75%<肾小球硬化面积≤100%。计算肾小球硬化指数(GSI):(1×N1+2×N2+3×N3+4×N4)/N×100(N1为评分1级的肾小球个数,N2为评分2级的肾小球个数,N3为评分3级的肾小球个数,N4为评分3级的肾小球个数,N为计数肾小球的总数,即40)。采用Taal等〔5〕的半定量评分系统评价肾小管间质的病变情况。每张Masson染色切片于200倍光镜下随机选择10个不含肾小球的视野。肾小管间质病变由3个参数判定(蛋白管型和小管扩张、间质炎细胞浸润、间质纤维化程度),每个参数分别按0~3分评定:无病变0分,轻度受损(受累面积<25%)1分,中度受损(受累面积25%~50%)2分,重度受损(受累面积>50%)3分。每个视野的观察结果为3个参数评分的总和,10个视野的平均值为肾小管间质损伤指数(TIS)。
1.3.3血清、尿液的AngⅡ和AGT检测采用酶联免疫吸附(ELISA)试剂盒(Bio-Swamp,中国上海)测定。
2结果
2.1一般情况假手术组大鼠表现机警、反应敏捷,行为正常,皮毛致密整齐有光泽,饮食正常,尿道口无血性分泌物,体重逐渐增加。模型组大鼠精神萎靡、活动迟缓,甚至弓背蜷体,皮毛疏松枯槁无光泽,食量减少,部分动物尿道口可见血性分泌物,大便色质正常,部分大鼠出现大便量减少,体重增加缓慢。随着观察周期延长,与假手术组相比,大鼠耳、鼻、足背、尾部皮肤略显苍白。处死大鼠时剖腹探查可见个别存在小至中等量腹腔积液。在模型制作过程中,没有大鼠死亡。术后的观察周期中,假手术组有2只大鼠死亡,死亡率4.8%。模型组有5只大鼠死亡,死亡率11.9%。经观察及尸检,死亡原因为腹腔感染、同伴撕咬、肠管粘连致肠梗阻等。
2.2生化指标及血清、尿液AngⅡ、AGT变化情况模型组UP水平呈逐渐上升趋势,而假手术组变化不大。Scr、BUN水平自第4周开始较假手术组出现明显升高,后一度出现回落,大约第10周开始出现逐渐上升趋势。Ccr在第6周出现明显下降,第8周时出现轻度上升,之后为逐渐下降趋势。见表1。血清及尿液AngⅡ水平第4周后出现短暂的下降趋势,分别自第8周、第10周出现进行性上升。血清AGT水平没有观察到明显的趋势性变化,尿液AGT自第4周开始逐渐下降,自第8周出现上升趋势。见表2。
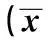
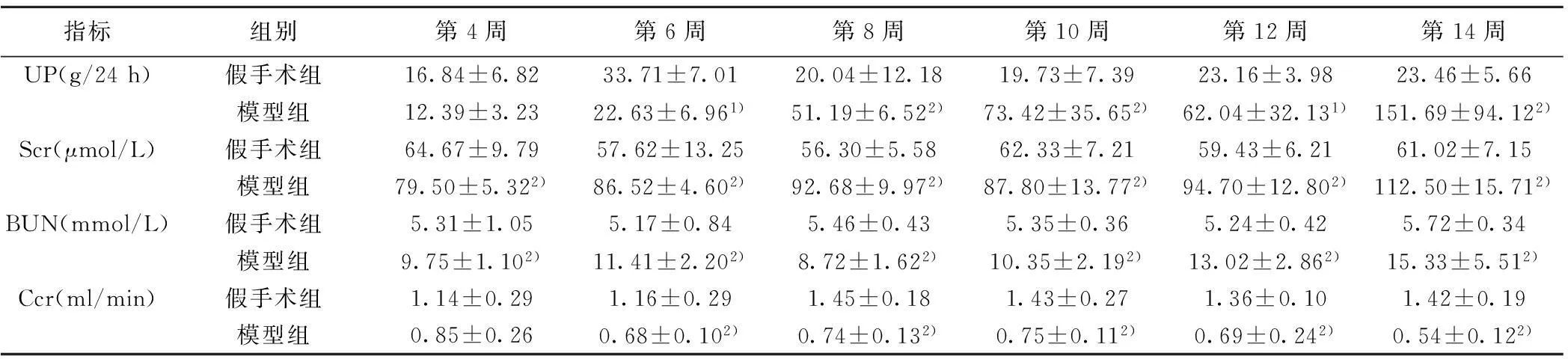
指标组别第4周第6周第8周第10周第12周第14周UP(g/24h)假手术组16.84±6.8233.71±7.0120.04±12.1819.73±7.3923.16±3.9823.46±5.66模型组12.39±3.2322.63±6.961)51.19±6.522)73.42±35.652)62.04±32.131)151.69±94.122)Scr(μmol/L)假手术组64.67±9.7957.62±13.2556.30±5.5862.33±7.2159.43±6.2161.02±7.15模型组79.50±5.322)86.52±4.602)92.68±9.972)87.80±13.772)94.70±12.802)112.50±15.712)BUN(mmol/L)假手术组5.31±1.055.17±0.845.46±0.435.35±0.365.24±0.425.72±0.34模型组9.75±1.102)11.41±2.202)8.72±1.622)10.35±2.192)13.02±2.862)15.33±5.512)Ccr(ml/min)假手术组1.14±0.291.16±0.291.45±0.181.43±0.271.36±0.101.42±0.19模型组0.85±0.260.68±0.102)0.74±0.132)0.75±0.112)0.69±0.242)0.54±0.122)
与假手术组比较:1)P<0.05,2)P<0.01,下表同
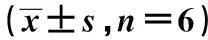
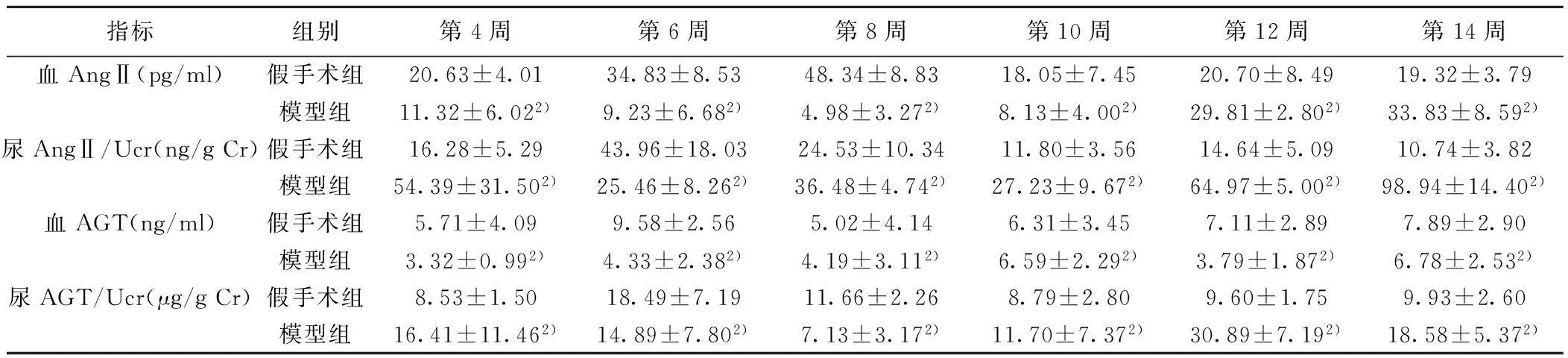
指标组别第4周第6周第8周第10周第12周第14周血AngⅡ(pg/ml)假手术组20.63±4.0134.83±8.5348.34±8.8318.05±7.4520.70±8.4919.32±3.79模型组11.32±6.022)9.23±6.682)4.98±3.272)8.13±4.002)29.81±2.802)33.83±8.592)尿AngⅡ/Ucr(ng/gCr)假手术组16.28±5.2943.96±18.0324.53±10.3411.80±3.5614.64±5.0910.74±3.82模型组54.39±31.502)25.46±8.262)36.48±4.742)27.23±9.672)64.97±5.002)98.94±14.402)血AGT(ng/ml)假手术组5.71±4.099.58±2.565.02±4.146.31±3.457.11±2.897.89±2.90模型组3.32±0.992)4.33±2.382)4.19±3.112)6.59±2.292)3.79±1.872)6.78±2.532)尿AGT/Ucr(μg/gCr)假手术组8.53±1.5018.49±7.1911.66±2.268.79±2.809.60±1.759.93±2.60模型组16.41±11.462)14.89±7.802)7.13±3.172)11.70±7.372)30.89±7.192)18.58±5.372)
2.3病理损伤观察假手术组大体观察:各肾外观及切面正常,离体肾脏呈均匀暗红色,大小正常,有肾脏质感。光镜观察:肾小球结构正常,毛细血管袢开放,基底膜呈线性,无增厚,鲍曼囊囊腔清晰无扩张,球囊无粘连,未见明显的细胞增殖以及系膜增生;肾小管结构清晰,无萎缩,管腔无扩张,未见蛋白管型,肾间质偶见少量炎细胞浸润。模型组大体:各期大鼠肾脏均呈淡粉色或灰白色,体积有所增大,有水泡样光泽,随观察周期的延长质地渐硬,无肾脏质感,个别残肾切面与脾脏或周围肠管粘连,残肾剖面偶可见局部血栓形成。光镜观察:早期(第6周):肾小球体积轻度增大,毛细血管袢开放,偶可见基底膜轻度增厚,鲍曼囊囊腔清晰无扩张,球囊无粘连,部分肾小球可见轻度系膜细胞增生;肾小管结构清晰,部分可见肾小管上皮细胞空泡样变性,局部管腔稍有扩张,未见蛋白管型,肾间质偶可见灶状炎细胞浸润。中期(第10周):肾小球体积增大,毛细血管袢开放,可见基底膜弥漫增厚,鲍曼囊囊腔清晰,可见轻度扩张,部分可见球囊粘连,肾小球可见中重度系膜细胞增生;肾小管结构清楚,部分可见肾小管上皮细胞空泡样变性及刷毛缘脱落,管腔广泛明显扩张,可见大量蛋白管型,肾间质可见大量炎细胞浸润及广泛纤维组织增生。后期(第14周):肾小球体积缩小,可见局灶节段性肾小球硬化,部分小球出现球性硬化,硬化区系膜基质增生,细胞数减少,基底膜广泛增厚,失去正常线性形态,鲍曼囊囊腔缩小或消失,部分可见球囊局部或广泛粘连;肾小管多灶状萎缩,部分囊腔缩小至消失,肾小管上皮细胞空泡样变性明显,部分管腔代偿性扩张,可见蛋白管型。肾间质可见大量炎细胞浸润及广泛重度纤维组织增生。部分小动脉内膜增厚玻璃样变性,内径狭窄。见图1。
2.4肾脏病理损伤评价情况随着观察周期的延长,GSI、TIS均大致呈现上升趋势。GSI在早期为逐渐上升,在第12、14周出现显著上升;TIS在第8周时出现明显升高,10 w时稍有下降,后呈逐渐上升趋势。见表3。
2.5相关性分析以第8周作为慢性肾衰竭的观察起点,分析血清及尿液AGT与各常规生化检测指标、血清、尿液AngⅡ及病理损伤指标的相关性,见表4。血AGT与各项指标均无显著相关性。尿AGT与Ccr呈显著负相关(r=-0.667,P<0.01);与尿AngⅡ呈显著正相关(r=0.497,P<0.01);与GSI呈正相关(r=0.545,P<0.05);与其他指标无显著相关性。
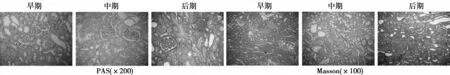
图1 不同时期模型组大鼠肾小球及小管间质病变情况
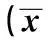
指标组别第4周第6周第8周第10周第12周第14周GSI假手术组0.42±1.020.42±1.020.00±0.000.83±1.291.67±1.291.25±0.07模型组2.00±1.001)3.00±2.927.92±6.791)8.75±7.201)18.75±16.111)121.67±62.722)TIS假手术组0.00±0.000.05±0.050.10±0.090.13±0.180.10±0.150.07±0.10模型组0.10±0.130.43±0.381)1.95±1.302)1.27±0.742)2.40±0.862)3.67±1.142)
表4各检测指标与AGT的相关性分析
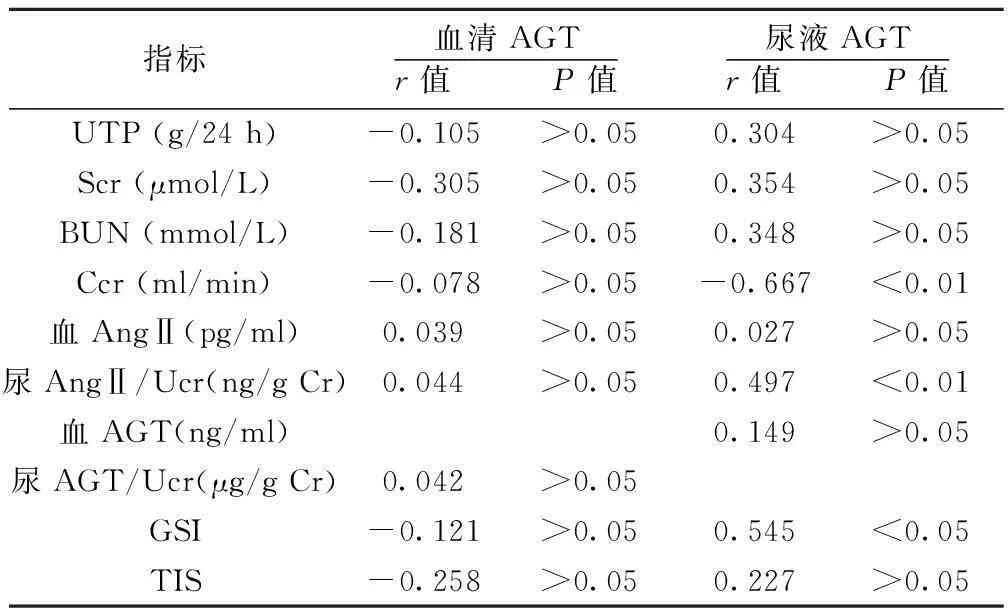
指标血清AGTr值 P值尿液AGTr值 P值UTP(g/24h)-0.105>0.050.304>0.05Scr(μmol/L)-0.305>0.050.354>0.05BUN(mmol/L)-0.181>0.050.348>0.05Ccr(ml/min)-0.078>0.05-0.667<0.01血AngⅡ(pg/ml)0.039>0.050.027>0.05尿AngⅡ/Ucr(ng/gCr)0.044>0.050.497<0.01血AGT(ng/ml)0.149>0.05尿AGT/Ucr(μg/gCr)0.042>0.05GSI-0.121>0.050.545<0.05TIS-0.258>0.050.227>0.05
3讨论
肾素-血管紧张素-醛固酮系统(RAS)是人体内重要的体液调节系统。近年来,大量的研究证据提示肾脏具有不依赖于循环RAS的局部RAS。AngⅡ作为RAS的主要效应分子,参与了一系列生理及病理生理过程,如肾小球灌注压的增加、肾小球细胞的增殖以及细胞外基质的堆积等,肾脏局部RAS的激活在肾脏疾病的进展过程中发挥了重要的作用。AGT是合成所有血管紧张素多肽所必需的底物,是一种糖基化的球蛋白,主要由肝脏合成〔6〕,由于AGT分子量大,循环中的AGT不能通过肾小球滤过屏障,所以尿AGT主要来源于肾脏,由近端肾小管合成分泌〔7〕,而与循环AGT无关〔8,9〕。其在肾素、ACE等的作用下形成AngⅡ,成为肾内AngⅡ的主要来源,未转化的AGT随尿液排出体外。基于AGT的这一代谢特点,近年来引起了人们的关注。Kobori等〔9~11〕研究提示尿AGT与肾内AngⅡ的活性相关,可能是肾内RAS活性的评价指标。章晓燕等〔12〕研究发现慢性肾脏病患者尿AGT水平与肾内AGT、AngⅡ和AngⅡ1型受体的免疫组化染色面积呈正相关,认为尿AGT能较好地反映肾内AngⅡ的活性,可作为肾内AngⅡ活性的无创指标。
临床上,部分肾脏病人就诊时已经不具备肾穿刺活检的条件,是否存在一种无创的手段或指标来了解和判断病人肾脏病理变化情况,尤其是对于判断肾脏病是原发还是继发于其他疾病的损害时显得非常重要。本研究显示血清AGT与各指标间均无显著相关性,尿AGT与尿AngⅡ呈显著正相关,这与临床研究〔12〕的结果相似,结果提示这两者之间可能存在一定的联系,由于尿中AngⅡ不仅来源与肾脏局部,还有部分来自于循环中经肾小球滤过后自尿液排出,两者之间的关系还有待于进一步研究。本研究还发现尿AGT与Ccr呈负相关,这与以往的研究结果〔12〕是一致的,提示尿AGT作为无创性指标,能够在一定程度上反映肾功能的情况;本研究提示传统评价肾功能指标对于肾功能预测准确性较差。尿AGT与病理损伤指数的相关性分析发现,尿AGT与GSI呈正相关,与TIS之间并无明显相关性。关于病理损伤方面,有研究〔12〕发现慢性肾脏病患者尿AGT与尿Ⅳ型胶原呈正相关,由于尿Ⅳ型胶原的水平能够反映肾脏纤维化的程度,进而推断尿AGT的水平能够反映肾脏纤维化的情况,即可能作为肾脏损伤尤其是慢性损伤程度的指标。本研究通过肾脏病理切片直接观察病变情况,可能较其具有较高的准确性,但结果发现尿AGT与TIS并无明显的相关性,可能由于TIS本身包含3个方面内容,并不单一反映肾间质纤维化的情况。尿AGT与GSI呈正相关,由于局部RAS系统的激活会导致肾小球血流动力学的改变以及AngⅡ介导的细胞表型改变和细胞增殖,进而调节多种生物活性物质基因表达,这些过程可能都参与肾小球硬化的病理生理进程〔13〕。尿AGT可以作为一个无创性指标反映肾小球硬化的程度,具体的机制以及在人类是否具有类似的相关关系,还值得进一步研究。
4参考文献
1Singh R.Mechanism of increased angiotensin Ⅱ levels in glomerular mesangial cells cultured in high glucose〔J〕.J Am Soc Nephrol,2003;14(4):873-80.
2Sanchez-Lozada LG,Tapia E,Soto V,etal.Effect of febuxostat on the progression of renal disease in 5/6 nephrectomy rats with and without hyperuricemia〔J〕.Nephron Physiol,2008;108:69-78.
3王海燕.肾脏病学〔M〕.第3版.北京:人民卫生出版社,2008:443-4.
4Raij L,Azar S,Keane W.Mesangial immune injury,hypertension,and progressive glomerular damage in Dahl rats〔J〕.Kidney Int,1984;26:137-43.
5Taal MW,Zandi-Nejad K,Weening B,etal.Proinflammatory gene expression and macrophage recruitment in the rat remnant kidney〔J〕.Kidney Int,2000;58:1664-76.
6Brasier AR,Li J.Mechanisms for inducible control of angiotensinogen gene transcription〔J〕.Hypertension,1996;27(3pt2):465-75.
7Davisson RL,Ding Y,Stec DE,etal.Novel mechanism of hypertension revealed by cell-specific targeting of human angiotensinogen in transgenic mice〔J〕.Physiol Genomics,1999;1(1):3-9.
8Rohrwasser A,Morgan T,Dillon HF,etal.Elements of a paracrine tubular renin-angiotensin system along the entire nephron〔J〕.Hypertension,1999;34(6):1265-74.
9Kobori H,Nishiyama A,Harrison-Bernard LM,etal.Urinary angiotensinogen as an indicator of intrarenal angiotensin status in hypertension〔J〕.Hypertension,2003;41(1):42-9.
10Kobori H,Harrison-Bernard LM,Navar LG.Urinary excretion of angiotensinogen reflects intrarenal angiotensinogen production〔J〕.Kidney Int,2002;61(2):579-85.
11Kobori H,Nishiyama A.Effects of tempol on renal angiotensinogen production in Dahl salt-sensitive rats〔J〕.Biochem Biophys Res Commun,2004;315(3):746-50.
12章晓燕,吕文律,滕杰,等.慢性肾脏病患者尿血管紧张素原与肾脏肾素血管紧张素系统活性的相关性〔J〕.中华肾脏病杂志,2011;27(5):327-32.
13Kim S,Iwao H.Molecular and cellular mechanisms of angiotensin Ⅱ-mediated cardiovascular and renal diseases〔J〕.Pharmacol Rev,2000;52(1):11-34.
〔2013-11-11修回〕
(编辑赵慧玲/曹梦园)
