丹参酮ⅡA诱导人肝癌HepG2细胞凋亡的机制
2015-12-31陈阳,赵秋宇,宋囡等
丹参酮ⅡA诱导人肝癌HepG2细胞凋亡的机制
陈阳1赵秋宇宋囡贾连群
(辽宁中医药大学省部共建教育部重点实验室,辽宁沈阳110847)
摘要〔〕目的探讨中药活性单体丹参酮ⅡA对人肝癌HepG2细胞株增殖抑制和诱导凋亡的可能机制。方法用5、10、20、30、40、50 μmol/L丹参酮ⅡA处理HepG2细胞,应用MTT法分析细胞活力,MUSE细胞分析仪、PI染色等检测细胞增殖抑制、细胞周期以及凋亡情况。免疫蛋白印迹技术检测p53、Bax及Bcl-2等凋亡相关蛋白的表达。结果5~50 μmol/L丹参酮ⅡA显著降低细胞存活率(P<0.01),形态学观察可见细胞凋亡改变,细胞发生G2/M期周期阻滞。免疫印迹结果显示丹参酮ⅡA上调p53、Bax蛋白的表达,下调Bcl-2蛋白的表达。结论丹参酮ⅡA对HepG2细胞的增殖抑制作用可能部分通过诱导细胞G2/M周期阻滞和线粒体途径凋亡实现。
关键词〔〕丹参酮ⅡA;HepG2细胞;细胞周期;细胞凋亡
中图分类号〔〕R392.11〔文献标识码〕A〔
基金项目:国家自然科学基金青年
通讯作者:贾连群(1975-),女,副教授,博士后,硕士生导师,主要从事中医药防治肝病研究。
The mechanisms of apoptosis induced by TanshinoneⅡA in human hepatoma HepG2 cells
CHEN Yang, ZHAO Qiu-Yu, SONG Nan,etal.
Liaoning University of Traditional Chinese Medicine,Shenyang 110847,Liaoning, China
Abstract【】ObjectiveTo examine the effects of tanshinoneⅡA on growth and apoptosis in HepG2 cells.MethodsHepG2 cells were treated with various concentrations of tanshinoneⅡA. Assays were performed to determine cell viability; cell cycle arrest, apoptosis and protein expression were measured by MTT, MUSE cytoanalyze, PI staining and Western blotting.ResultsAfter HepG2 cells were treated with different concentrations of tanshinoneⅡA ( 5~50 μmol/L) , the growth of HepG2 cells were significantly inhibited compared with those of control group(P<0.01), the HepG2 cells displayed typical morphological changes and induced G2/M-phase arrest of the cell cycle and apoptosis. TanshinoneⅡA increased expressions of p53 and Bax as well as caused down-regulation of Bcl-2 expression.ConclusionsTanshinoneⅡA could inhibit the growth of HepG2 cells via inducing G2/M arrest followed by the mitochondrial pathway of apoptosis.
【Key words】TanshinoneⅡA; HepG2 cells; Cell cycle; Apoptosis
1沈阳市第六人民医院
第一作者:陈阳(1976-),男,硕士,主要从事中药护肝作用分子机制研究。
丹参为唇形科植物丹参SalviamiltiorrhizaBge的干燥根及根茎,是我国传统医学中应用最广泛的药物之一,其化学成分主要分为脂溶性和水溶性两类。丹参酮ⅡA是丹参的脂溶性有效单体,具有抗氧化、抑制血小板聚集和抗凝血、抑制平滑肌细胞增殖、扩张冠状动脉及抗炎、抗肿瘤等作用〔1〕。近年研究表明,丹参酮ⅡA对多种肿瘤细胞具有细胞毒性作用,可诱导肿瘤细胞分化和凋亡,抑制肿瘤细胞侵袭和转移,其机制可能与抑制合成调节细胞周期影响凋亡和原癌基因的表达等有关〔2〕。本研究拟讨论丹参酮ⅡA在体外对人肝癌细胞HepG2的凋亡作用及其机制。
1材料和方法
1.1材料人肝癌HepG2细胞株购自中国科学院上海细胞库,体外培养传代。丹参酮ⅡA购自中国药品生物制品检定所。DMEM高糖培养液、胎牛血清(FBS)、硫酸链霉素、青霉素、0.25%胰酶购自美国Hyclone公司。MTT为美国Sigma分装。p53、Bax、Bcl-2及β-actin抗体、二抗羊抗兔IgG购自美国Santa Cruz公司。ECL化学发光试剂购自碧云天公司。其余试剂均为分析纯。
1.2方法
1.2.1细胞培养人肝癌HepG2接种于10%FBS、100 U/ml青霉素、100 μg/ml链霉素、0.2% NaHCO3的DMEM高糖培养液中,于37 ℃、5%CO2、饱和湿度的培养箱中传代培养至对数生长期备用。
1.2.2MTT法测定细胞活性用0.25%胰蛋白酶消化取得对数生长期受试细胞,用含10% FBS的DMEM高糖培养液配成单细胞悬液,以5×104/ml的密度接种于96孔板中,每孔加入100 μl细胞悬液,在CO2培养箱中培养24 h,待细胞充分贴壁后,除去培养液,分为空白对照组和给药组。给药组每孔加入用培养液配制的不同浓度的丹参酮ⅡA溶液(5、10、20、30、40、50 μmol/L)100 μl。对照组加入含0.1% DMSO的培养液,37℃培养12、24、48 h。培养结束后每孔加入15 mg/ml MTT 工作液20 μl,37 ℃继续培养4 h。吸弃上清液,每孔加入150 μl DMSO,振荡10 min以充分溶解结晶物,酶标仪490 nm检测吸光度值(A),按下列公式计算给药物后肿瘤细胞的存活率,计算半数(IC50)。每个实验重复3次。细胞生长抑制率:抑制率(%)=〔A490( 阴性对照) -A490(丹参酮ⅡA)〕/A490( 阴性对照)×100%。
1.2.3细胞形态学变化观察将HepG2细胞以每孔1×105个/ml密度接种于6孔细胞培养板中,培养12 h后,对照孔仅加入新鲜的含10% FBS培养液,给药孔分别加入20、30、40 μmol/L丹参酮ⅡA,作用24 h后,置于倒置相差显微镜下观察细胞形态并拍照。
1.2.4检测HepG2细胞周期HepG2细胞4瓶(25 cm2培养瓶),细胞同步化24 h后弃旧饥饿液,给药组20、30、40 μmol/L丹参酮ⅡA 4 ml,作用24 h,每瓶细胞分别消化后,用1 ml PBS重悬于1.5 ml EP管中,1 000 r/min离心5 min,先分别加入150 μl PBS再次重悬,缓慢加入350 μl无水乙醇进行细胞固定,4℃过夜,次日,PBS洗2次后,加入200 μl的周期试剂重悬细胞,避光孵育30 min,Muse细胞分析仪检测。
1.2.5检测HepG2细胞凋亡细胞消化后,用10%FBS的DMEM培养液1 ml重悬细胞于1.5 ml EP管中,再分别从上述各管中取出100 μl,然后每100 μl细胞中均加入100 μl细胞凋亡检测试剂,室温孵育20 min,Muse细胞分析仪检测。
1.2.6碘化丙啶(PI)染色将HepG2细胞以每孔1×105个/ml密度接种于6孔细胞培养板中培养12 h后,对照孔加入完全培养液(10%FBS),给药组加丹参酮ⅡA作用24 h。向细胞中加入1 ml PI染液,4℃避光染色30 min后,荧光显微镜观察被染色细胞核数量的改变。
1.2.7Western印迹法检测蛋白表达提取细胞总蛋白,经Bio-Rad法定量蛋白,取40 μg总蛋白上样,经十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE) 后,转移到醋酸纤维素膜上,5%脱脂奶粉室温封闭3~ 4 h,与抗p53、Bax、Bcl-2的抗体4 ℃孵育过夜,用含有0.1%Tween-20的TBST漂洗PVDF膜,3×5 min。二抗37 ℃水浴摇床温孵2 h。TBST漂洗3×5 min。按试剂盒说明书混合发光液A和B,与膜作用5 min后进行X光片曝光。X光片显影和定影后观察结果。
2结果
2.1丹参酮ⅡA对人肝癌HepG2细胞的生长抑制作用MTT结果表明,5~50 μmol/L的丹参酮ⅡA对HepG2细胞的增殖均有一定的抑制作用,并呈现出较好的量效和时效关系,随着药物处理时间延长和作用浓度加大,其生长抑制作用逐渐增强。12 h的理论IC50是50.65 μmol/L,24 h是32.17 μmol/L,48 h为 14.17 μmol/L。见图1。
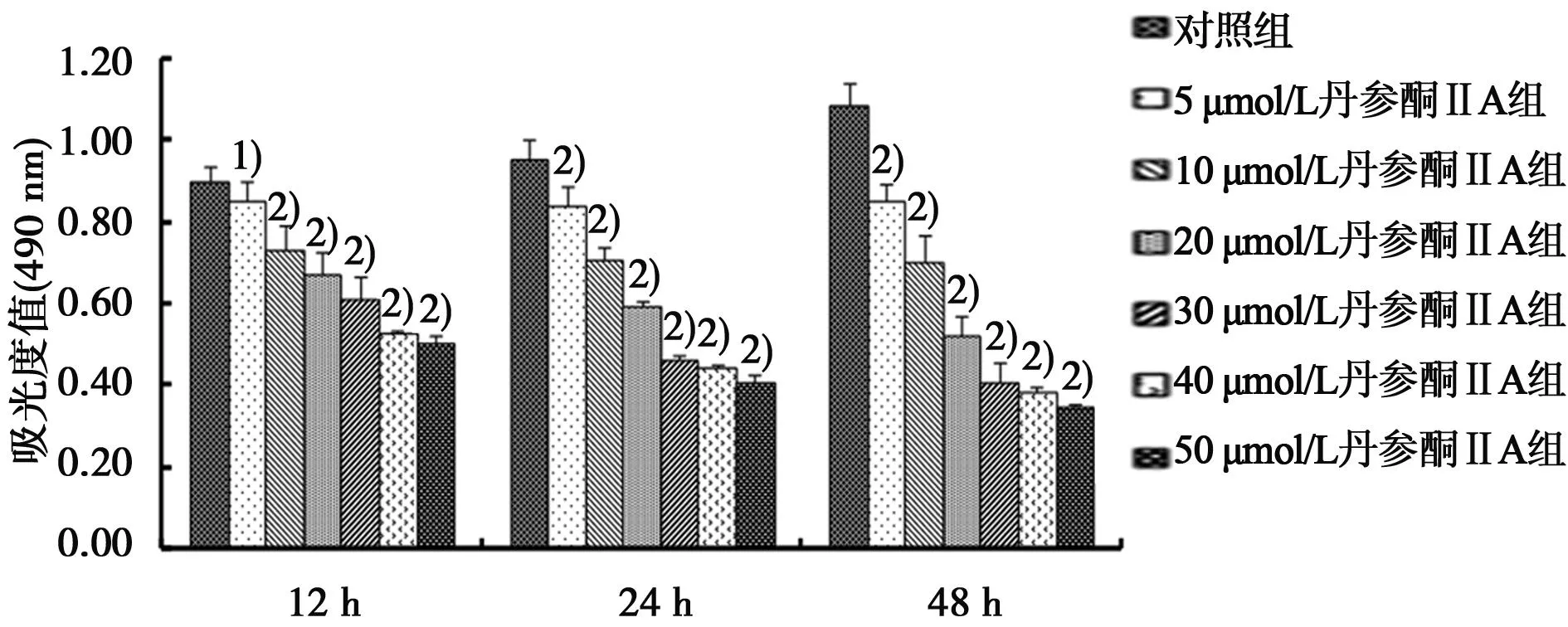
与对照组比较:1)P<0.05,2)P<0.01 图1 各组HepG2细胞生长抑制情况
2.2丹参酮ⅡA诱导人肝癌HepG2细胞凋亡的形态学变化对照组细胞的细胞核形状规则,染色质均一,而丹参酮ⅡA处理组细胞的细胞核形状发生了明显改变,出现染色质浓缩、断裂、边缘化等明显的凋亡改变。见图2。
2.3丹参酮ⅡA 对HepG2细胞G2/M期影响的量效关系20、30、40 μmol/L丹参酮ⅡA 处理HepG2细胞24 h后,细胞处于G2/M期的数目明显增多,而处于G0/G1期和S期的细胞数目明显减少,HepG2细胞生长阻滞于G2/M期。随着作用浓度的增加,G2/M期的比例都有所升高,呈现出较一定的剂量依赖性。见图3。
2.4丹参酮ⅡA 对HepG2细胞凋亡影响的量效关系丹参酮ⅡA(0、20、30及40 μmol/L)作用于HepG2细胞24 h后,细胞早期凋亡率分别为1.13%、8.11%、8.91%和10.84%。随着药物浓度的提高,细胞凋亡率逐渐增加。

图2 不同浓度丹参酮ⅡA作用24 h后 HepG2细胞形态学变化(×200)
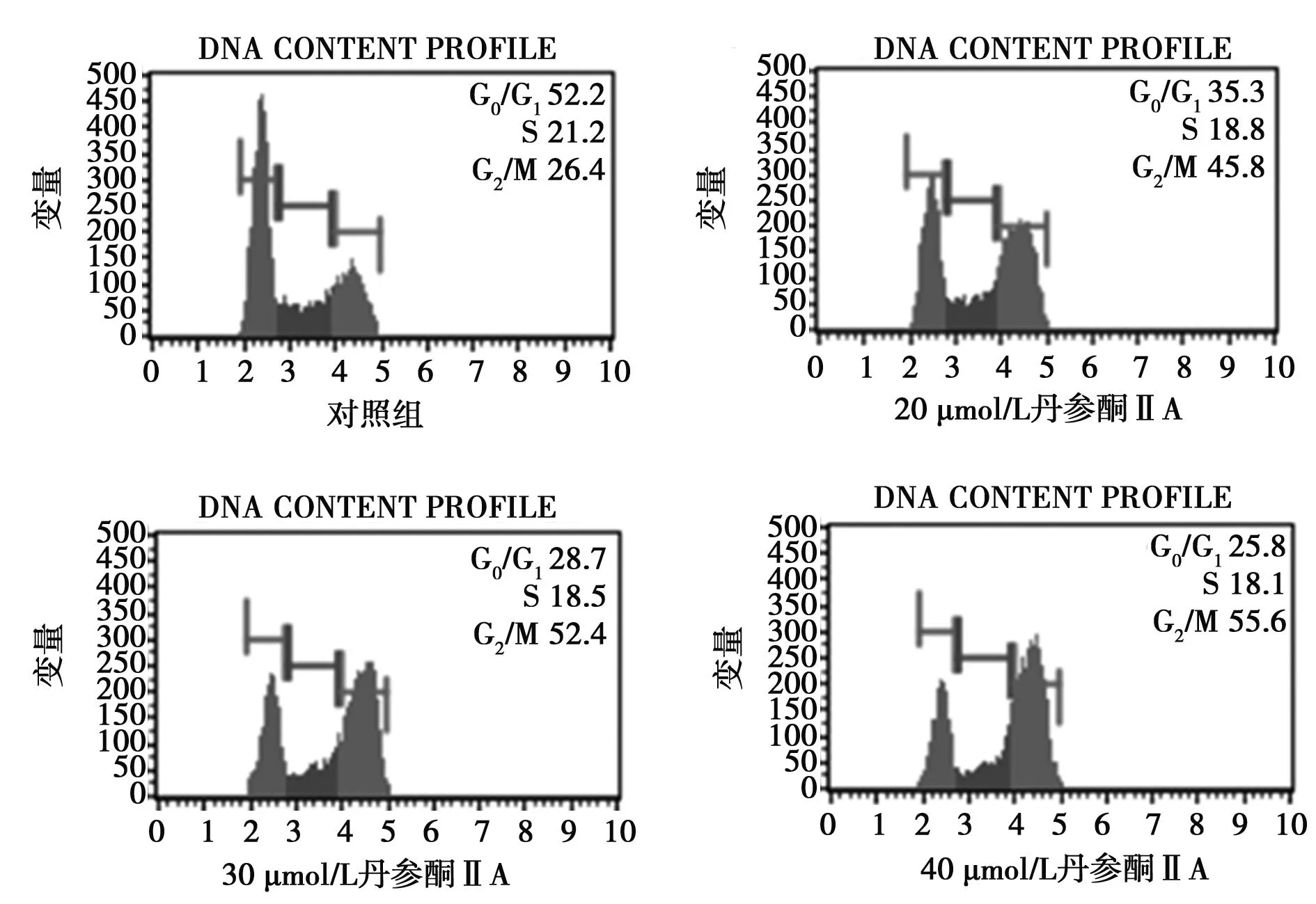
图3 不同浓度丹参酮ⅡA处理24 h诱导 HepG2细胞发生G 2/M期周期阻滞
2.5PI染色与对照组相比,丹参酮ⅡA处理过的HepG2细胞核红染明显增加,且有剂量依赖性。见图4。
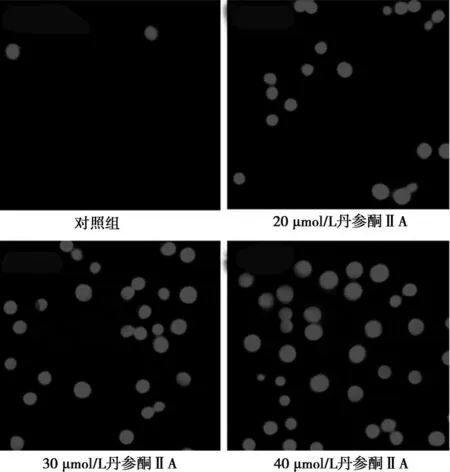
图4 PI染色丹参酮ⅡA 处理24 h的HepG2细胞
2.6丹参酮ⅡA 对HepG2细胞凋亡相关蛋白表达的影响不同浓度丹参酮ⅡA处理24 h的HepG2细胞与对照组比较,p53和Bax蛋白表达上调,Bcl-2蛋白表达下调。见图5。
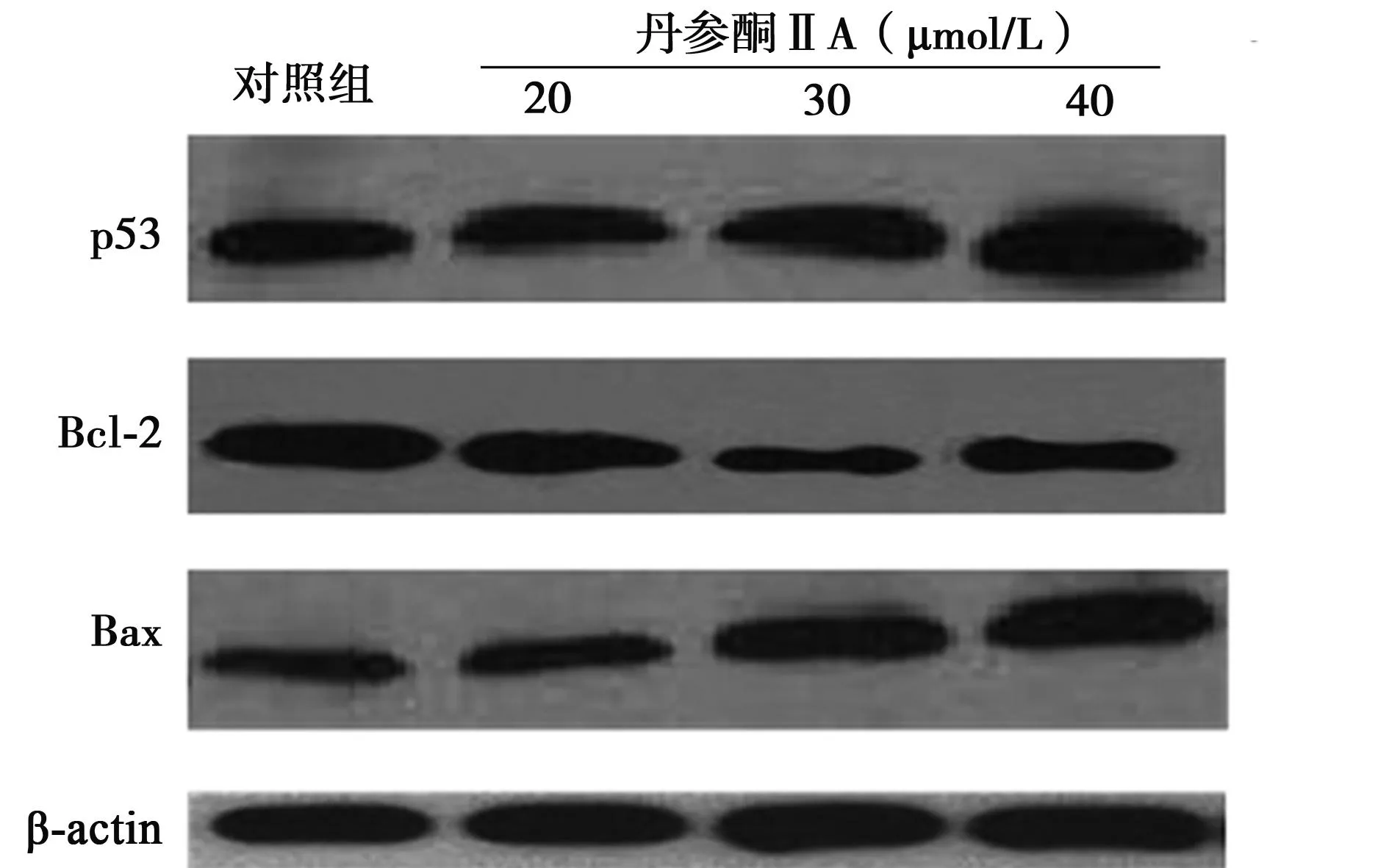
图5 不同浓度丹参酮ⅡA 处理HepG2细胞24 h后, p53、Bcl-2、Bax蛋白表达的变化
3讨论
目前,肝癌的治疗方法以手术、放疗和化疗为主,但这些方法大部分毒副作用较大,因此,新型高效低毒抗癌药物的研制开发已经成为优化肿瘤治疗策略以及最终攻克癌症的希望〔2〕。丹参酮为丹参的乙醚或乙醇提取物,是丹参的主要有效成分。现代药理和临床实践证明丹参酮具有保护心肌、扩张冠脉、改善心肌缺血、抗动脉粥样硬化、抗血栓形成、改善微循环、抗氧化、抗菌消炎、抗肿瘤等多种药理作用。丹参酮ⅡA是丹参重要的脂溶性成分之一,在白血病、肝癌、肺癌等的治疗中已得到应用〔3,4〕。
细胞周期中的G1/S、S、G2、G2/M几个检测点在调控细胞周期有序进展中发挥重要作用。与正常细胞不同的是,多数肿瘤细胞往往缺失G1/S检测点,所以肿瘤细胞比正常细胞增殖更加旺盛。由于肿瘤细胞与正常细胞的这种差别,G2/M检测点在肿瘤细胞中尤为重要,并已经成为选择性高和安全性好的肿瘤药物治疗的新靶点。丹参酮ⅡA能使HepG2细胞周期阻滞在G2/M检测点,并最终诱导凋亡。
p53是细胞应激的关键性调控分子之一,通过转录或非转录途径对细胞危急事件信号做出包括细胞生长抑制或凋亡在内的不同反应,同时可调控多种基因表达,对细胞增殖分化具有重要影响〔5〕。本研究中各浓度组p53蛋白高水平表达可能与丹参酮ⅡA导致的DNA损伤有关。P53蛋白是转录激活因子,在DNA损伤后其稳定性增加而得到激活,转而去调节下游基因的表达。在正常条件下,p53是一个极不稳定的蛋白,与DNA的结合能力也相对较低。而在DNA损伤后,有一系列的蛋白翻译后加工生化修饰过程,可增强p53蛋白的稳定性,并激活其与特异序列的结合活性,因而DNA损伤后伴有细胞内p53蛋白水平升高〔6〕。
Bcl-2家族蛋白在线粒体介导的凋亡途径中发挥重要作用〔7〕。Bcl-2蛋白可稳定线粒体膜的通透性,抑制细胞色素c释放和caspase-9活化。Bax与线粒体膜上的孔蛋白相互作用,使线粒体膜的通透性增加,导致细胞色素C释放至胞质、caspase-9活化及效应caspase激活,最终诱导细胞凋亡〔8〕。丹参酮ⅡA作用HepG2细胞后,Bcl-2蛋白表达下调,Bax蛋白表达上调。文献报道,上游调控分子可调节Bcl-2和(或)Bax蛋白表达,如p53通过上调Bax蛋白表达,调节Bcl-2与Bax的分子比率〔9,10〕。
综上所述,丹参酮ⅡA通过诱导G2/M周期阻滞和细胞凋亡抑制人肝癌HepG2细胞增殖,为丹参酮ⅡA开发为潜在的抗癌药物提供了理论依据。
4参考文献
1贾连群,冯峻屹,杨关林,等.丹参酮ⅡA对EA.hy926细胞TLR4/NF-κB炎症信号通路的影响〔J〕.中国生化药物杂志,2011;32(5):337-40.
2袁春意,谢琼.丹参酮ⅡA在肿瘤领域的实验研究进展〔J〕.中医药导报,2009;15(9):67-9.
3Jia LQ,Yang GL,Ren L,etal.TanshinoneⅡA reduces apoptosis induced by hydrogen peroxide in the human endothelium-derived EA.hy926 cells〔J〕.J Ethnopharmacol,2012;143(1):100-8.
4宋囡,何文智,王智民,等.左、右归丸及其拆方对骨髓间充质干细胞成骨分化后细胞周期和凋亡的影响〔J〕.中华中医药杂志,2013;28(5):1520-4.
5褚启龙,哈建利,夏涛,等.氟对人胚肝细胞DNA损伤及p53蛋白表达影响〔J〕.中国公共卫生,2011;27(9):1154-5.
6Brito AF,Abrantes AM,Pinto-Costa C,etal.Hepatocellular carcinoma and chemotherapy:the role of p53〔J〕.Chemotherapy,2012;58(5):381-6.
7Zou H,Li Y,Liu X,etal.An APAF-1 cytochrome c multimeric complex is a functional apoptosome that activates procaspase-9〔J〕.J Biol Chem,1999;274(17):11549-56.
8Zhou J,Zhang S,Ong CN,etal.Critical role of pro-apoptotic Bcl-2 family members in andrographolide-induced apoptosis in human cancer cells〔J〕.Biochem Pharmacol,2006;72(2):132-44.
9董雅洁,高维娟.bcl-2、bax、caspase-3在细胞凋亡中的作用及其关系〔J〕.中国老年学杂志,2012;11(32):4828-30.
10Reed JC.Bcl-2 family proteins:regulators of apoptosis and chemoresistance in hematologic malignancies〔J〕.Semin Hematol,1997;34(4 Suppl 5):9-19.
〔2012-10-10修回〕
(编辑徐杰)
