红芪小分子提取物对MSCs体外增殖与染色体的影响
2015-12-30王倩,岳卫东,刘永琦
红芪小分子提取物对MSCs体外增殖与染色体的影响
王倩1岳卫东刘永琦1,2,3
(宝鸡市第二中医医院,陕西宝鸡721300)
摘要〔〕目的探讨红芪小分子提取物对骨髓间充质干细胞(MSCs)体外增殖及染色体的影响。方法利用水提法结合超滤法提取红芪中小分子物质,并筛选其促进MSCs增殖的最佳浓度。设单独培养的MSCs为对照组,红芪最佳浓度(20 mg/L)培养72 h后MSCs为实验组,于倒置相差显微镜下观察各组细胞形态学的改变;采用MTT法检测各组细胞生长曲线;流式细胞术检测细胞周期;染色体显色与计数分析细胞染色体;Western印迹检测各组细胞基质金属蛋白酶(MMP)-2、MMP-9蛋白表达水平的变化。结果红芪浓度20 mg/L为最佳促进MSCs增殖浓度(P<0.05)。倒置相差显微镜下观察对照组细胞呈成纤维细胞样;红芪组细胞呈长梭形,形态类似于对照组。与对照组比较,红芪组细胞生长速度显著增快(P<0.05);细胞周期G0/G1期细胞减少,S期和G2/M期细胞增多,但差异无统计学意义(P>0.05);染色体及MMP-2、MMP-9蛋白表达水平无异常改变(P>0.05)。结论红芪小分子提取物20 mg/L体外培养MSCs 72 h后,对其增殖有明显促进作用,且维持其遗传物质染色体的稳定性,其作用机制可能与调控MSCs的MMP-2、MMP-9等相关蛋白表达有关。
关键词〔〕红芪;骨髓间充质干细胞;增殖;染色体;基质金属蛋白酶
中图分类号〔〕R285〔文献标识码〕A〔
基金项目:国家自然科学基金(No.81060351/H2810)
通讯作者:刘永琦(1973-),男,博士生导师,主要从事中西医结合基础研究。
1甘肃中医学院系统生物学与中医药转化研究所
2甘肃省中药药理与毒理学重点实验室
3敦煌医学与转化省部共建教育部重点实验室
第一作者:王倩(1980-),女,硕士,主治医师,主要从事中西医结合治疗基础研究。
Effect of micromolecule-aqueous extracts of Hongqi (Radix Hedysari) on the proliferation and chromosome of MSCs in vitro
WANG Qian,YUE Wei-Dong,LIU Yong-Qi.
The Second Chinese Medicine Hospital of Baoji,Baoji 721300,Shaanxi,China
Abstract【】ObjectiveTo study the effects of micromolecule-aqueous extracts of Hongqi on proliferation and chromosome of mesenehymal stem cells (MSCs) in vitro.MethodsThe water-boiling method combined with ultrafiltration were used to extract the micromolecule-aqueous substances of Hongqi and the best concentration was screened for proliferative effect on MSCs.MSCs cultured alone was control group,and MSCs cultured with the best concentration of Hongqi (20 mg/L) for 72 h was experimental groups.The morphological changes in the cells were observed by phase-contrast microscopy.MTT assay was used to measure the cells changes in growth.The cell cycle of MSCs was determined by flow cytometry.Chromosome was examined by colored and counted.The expressions of MMP-2,MMP-9 proteins were determined by Western blot.Results20 mg/L micromolecule-aqueous extracts of Hongqi was best concentrations to promote the growth of MSCs (P<0.05).The cell morphologies were observed by phase-contrast microscopy,cells of MSCs were fibroblast-like,cells of Hongqi were long fusiform,closed to MSCs cells in morphology.Compared with MSCs,cells of Hongqi grow were faster (P<0.05),the proportion of G0/G1 phase cells was reduced,while the proportion of S phase and G2/M phase were increased,but there was no statistical significance(P>0.05),the chromosome and the proteins expressions of MMP-2,MMP-9 did not change abnormally(P>0.05).ConclusionsMicromolecule-aqueous extracts of Hongqi (20 mg/L) culturing MSCs for 72 h could improve proliferation of MSCs significantly,and preserve the genetic stability of MSCs'chromosome in vitro.The mechanism is related with the regulation of the expressions of MMP-2,MMP-9 proteins of MSCs.
【Key words】Hongqi (Radix Hedysari); Mesenhymal stem cells; Proliferation; Chromosome; Matrix metalloproteinase
目前研究表明,红芪中有效成分包括多糖、黄酮、皂苷;此外,还含有机体必需的微量元素和部分氨基酸,其中1-3-羟基-9-甲氧基紫檀烷是红芪的特有成分,是鉴别红芪与黄芪的物质基础〔1〕。现代药理学研究发现,红芪具有广泛的药理作用,包括调节机体免疫功能、抗氧化、抗炎、抗衰老、抗肿瘤、降血糖、镇痛、改善血流变及促进损伤神经再生等作用〔2〕。本研究通过观察骨髓间充质干细胞(MSCs)体外增殖及遗传物质染色体的变化,以期为红芪联合MSCs在细胞学治疗的临床应用提供科学依据。
1材料与方法
1.1仪器及试剂二氧化碳培养箱,日本三洋电机公司;双人单面垂直送风超净工作台,天津市泰斯特仪器有限公司;IX51型倒置式基础型显微镜,日本奥林巴斯株式会社;IX81型活细胞成像系统,日本奥林巴斯株式会社;酶联免疫检测仪、凝胶成像分析系统、核酸蛋白浓度测定仪,美国BIO-RAD公司;DV314C型精密电子天平,美国OHAUS公司;移液器research,德国eppendorf公司。DMEM/F-12、胎牛血清(美国Hyclone公司),胰蛋白酶(美国Gibco公司),噻唑蓝(MTT)、二甲基亚砜(DMSO)、碘化丙啶(PI)(美国Sigma公司),兔抗人基质金属蛋白酶(MMP)-2多克隆抗体、兔抗人MMP-9 多克隆抗体(美国Bioworlde公司),辣根过氧化物酶标记的山羊抗兔IgG(上海碧云天生物技术有限公司),增强化学发光法(ECL)超敏发光液(德国MILLIPORE 公司)。
1.2水提法结合陶瓷膜超滤法提取红芪小分子物质取红芪饮片(购自甘肃省安宁医药公司,经甘肃中医学院中药制药中医药科研二级实验室鉴定为正品)9.25 kg,加125 L去离子水煎煮2 h,得提取液,其药渣再加125 L去离子水煎煮2 h,将两次煎煮所得提取液经50 nm陶瓷膜超滤,得透过液。再经10 nm陶瓷膜超滤,得10 nm以下透过液(以上步骤在甘肃中医学院中药制药中医药科研二级实验室完成)。透过液经热回流抽提浓缩机浓缩、真空干燥箱干燥、粉碎机粉碎,得红芪小分子物质粉(由奇正藏药有限公司制药室完成)。称取3 g,溶解于100 ml磷酸盐缓冲液(PBS)中,0.22 μm微孔滤器过滤除菌。用细胞培养液稀释浓度分别为20、40、60、80 mg/L,4℃保存备用。
1.3细胞培养MSCs购自Cyagen Biosciences Inc.(Catalog Number:HUXMA-01001;Registration Number:08795844465781)。MSCs培养体系为含10%胎牛血清、1×105U/L青霉素和1×105U/L链霉素的DMEM/F-12培养液,置于5%CO2、37℃、饱和湿度的细胞培养箱中培养,每3 d换液1次。待贴壁细胞达到80%~90%融合时传代。细胞传代时首先弃掉原培养液,加入PBS清洗细胞2次,加入0.25%胰蛋白酶37℃消化,倒置相差显微镜下观察,待细胞变圆后,加入含有10%胎牛血清的DMEM/F-12培养液(与原培养液的比例为4∶1),吹散制成单细胞悬液并分装至新的培养瓶中,继续按照上述条件培养。取状态良好的细胞用于实验。
1.4红芪小分子提取物促进MSCs增殖最佳浓度的筛选取对数生长期MSCs细胞,加入0.25%胰蛋白酶37℃消化,倒置相差显微镜下观察,待细胞变圆后,用含有10%胎牛血清的DMEM/F-12培养液稀释成浓度约为5×104个/L的单细胞悬液,接种于96孔板中,每孔100 μl。每96孔板中设空白组(仅含有培养液,不接种细胞)、对照组(接种细胞和含有10%胎牛血清的DMEM/F-12培养液)、实验组(红芪小分子提取物浓度分别为20、40、60、80 mg/L)。培养24 h待细胞贴壁后,空白组和对照组每孔均加入100 μl含有10%胎牛血清的DMEM/F-12培养液,实验各组分别加入含有不同药物浓度的培养液,每组设6个复孔。在5%CO2、37℃、饱和湿度的细胞培养箱中分别培养24、48、72 h,每天固定时间每孔加20 μl MTT(5 g/L),培养箱中继续孵育4 h 后弃去液体,每孔加入150 μl DMSO,摇床上混匀10 min,用酶标仪于570 nm波长处测定各孔吸光度(A)值反映活细胞数量,其值越大则细胞数越多。
1.5实验分组取状态良好的MSCs细胞(30%~40%融合),弃掉原培养液,加入PBS清洗细胞2次,对照组加入含10%胎牛血清、1×105U/L青霉素和1×105U/L链霉素的DMEM/F-12培养液;实验组加入含最佳促进MSCs增殖红芪小分子提取物浓度、10%胎牛血清、1×105U/L青霉素和1×105U/L链霉素的DMEM/F-12培养液(简称红芪组),置于5%CO2、37℃、饱和湿度的细胞培养箱中培养72 h后用于实验。1.6形态学观察倒置相差显微镜下,每日观察各组细胞的形态变化,并照相记录。
1.7MTT比色试验绘制细胞生长曲线收集各组细胞,0.25%胰蛋白酶37℃消化,倒置相差显微镜下观察,待细胞变圆后,加入含有10%胎牛血清的DMEM/F-12培养液,吹散制成单细胞悬液,计数、调整细胞密度为1×107个/L,接种于96孔培养板中(各组细胞每个培养板中接种6孔,每孔200 μl,共7块培养板),在5%CO2、37℃、饱和湿度培养箱中培养,每隔48 h换液一次。分别于接种后第1、2、3、4、5、6、7天进行MTT法检测。每天固定时间每孔加20 μl MTT(5 g/L),培养箱中继续孵育4 h后弃去液体,加入150 μl DMSO,摇床上混匀10 min,用酶联免疫检测仪于570 nm波长处测定吸光度(A)值。以时间为横坐标,吸光度值为纵坐标,绘制细胞生长曲线图。
1.8流式细胞术(FCM)检测细胞周期收集各组细胞,0.25%胰蛋白酶37℃消化成单细胞悬液,1 000 r/min离心5 min后弃上清,PBS洗涤2次,缓慢加入-20℃预冷的70%乙醇4℃固定过夜,然后1 000 r/min离心5 min,收集固定的细胞,PBS洗涤2次后离心弃上清,加入500 μl的PBS重悬细胞,再加入2.5 μl(10 g/L)RNase A混匀,37℃反应30 min,过300目细胞筛,加入含1% Triton X-100的PI 50 μl(0.1 g/L)混匀,室温避光反应30 min,上流式细胞仪检测。每组实验重复3次。
1.9染色体显色实验分析染色体在各组细胞中加入秋水仙素(终浓度2 g/L),继续培养3 h后,0.25%胰蛋白酶消化,收集细胞于离心管中,1 000 r/min离心10 min。37℃的0.075 mol/L氯化钾低渗,甲醇-冰醋酸(比例3∶1)固定。冰玻片滴片,室温干燥,55℃干燥箱过夜。胰酶处理后Giemsa染色,油镜下观察拍照,各组细胞计数100分裂象的染色体,观察染色体形态、数目,分析结果。
1.10Western印迹检测MMP-2、MMP-9蛋白的表达水平在各组细胞分别加入裂解液提取细胞总蛋白,二喹啉甲酸(BCA)蛋白质定量,各组蛋白经10%十二烷基硫酸盐-聚丙烯酰胺(SDS-PAGE)凝胶进行电泳,电转至PVDF膜,5%脱脂奶粉室温封闭2 h,洗膜,加入兔抗人MMP-2多克隆抗体(1∶500)、兔抗人MMP-9多克隆抗体(1∶500稀释),室温孵育2 h,洗膜,加入辣根过氧化物酶标记的山羊抗兔IgG(1∶2 000稀释),室温孵育2 h,ECL化学发光法显色,Bio-Rad凝胶成像系统采集摄取图像,Quantity One软件分析处理图像。β-actin为内参,每组实验重复3次。
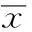
2结果
2.1不同浓度红芪小分子提取物对MSCs增殖的影响20 mg/L红芪小分子提取物作用不同时间后,能明显促进MSCs增殖(P<0.05),且随着培养时间的延长,作用越强,具有时间依赖效应;40 mg/L 红芪小分子提取物作用24 h后,能促进MSCs增殖(P<0.05);60 mg/L红芪小分子提取物作用72 h后,有促进MSCs增殖的作用(P<0.05);80 mg/L红芪小分子提取物作用48 h后,对MSCs的增殖有一定的抑制作用(P<0.05),而作用72 h后,有促进MSCs增殖的作用(P<0.05),提示红芪小分子提取物20 mg/L对MSCs增殖促进作用比较明显,为最佳药物作用浓度。见表1。
2.2细胞形态学观察倒置相差显微镜下观察,对照组细胞边界清晰,形态均一,为成纤维细胞样,扁平,呈长梭形或纺锤形,分布均匀,排列有序,呈漩涡样贴壁生长,折光性较强;红芪组细胞呈长梭形,排列有序,接近于对照组。见图1。
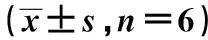
表1 各组细胞吸光度(A)值
与同一培养时间0 mg/ml组比较:1)P<0.05;与同一药物浓度培养24 h 比较:2)P<0.05;与同一药物浓度培养48 h比较:3)P<0.05

图1 各组细胞形态观察(×100)
2.3细胞生长曲线与对照组比较,红芪组在第1、2、3、4、5、6、7 天,细胞生长速度均显著增快(P<0.05)。见图2。
2.4FCM检测细胞周期红芪组G0/G1期细胞减少,S期和G2/M期细胞增多,但与对照组比较差异无统计学意义(P>0.05)。见表2。

表2 FCM分析细胞周期的结果
2.5细胞染色体分析在显微镜下选择分散良好且比较完整的中期分裂象进行观察,各组细胞染色体计数100分裂象的染色体数目,结果显示对照组染色体为46,正常二倍体,红芪组细胞染色体数目为46条,与对照组细胞比较未见染色体断裂、异倍体等异常改变。见图3。

图2 各组细胞生长曲线的变化
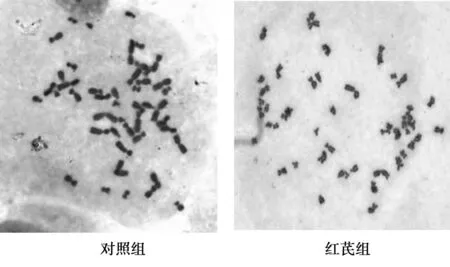
图3 各组细胞染色体检测结果(油镜,×1 000)
2.6MMP-2、MMP-9表达的变化与对照组(1 889.440±133.457,10 761.654±0.566)比较,红芪组细胞MMP-2、MMP-9表达量(1 972.785±241.872,11 074.660±596.044)差异无统计学意义(P>0.05)(图4)。
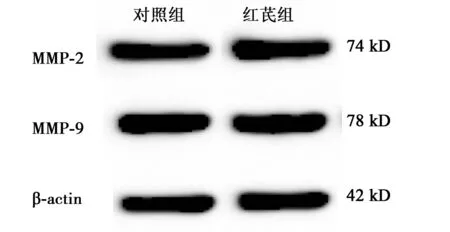
图4 Western印迹检测各组细胞MMP-2、MMP-9 蛋白的表达水平
3讨论
MSCs是来源于胚胎发育早期中胚层的成体干细胞,广泛存在于各种组织中,在骨髓中含量较多,具有较强的自我更新和多向分化潜能。由于MSCs可塑性高、取材方便、易于体外分离、培养、极好的迁移能力、低免疫源性和不涉及伦理问题等特点〔3,4〕,所以被认为是组织工程领域的理想种子细胞来源和基因治疗的重要靶细胞,已成为细胞学治疗的最佳干细胞之一〔5〕。但骨髓中MSCs的含量极少〔6〕,必须在体外培养扩增才能满足临床需求。还有研究发现,长期体外扩增MSCs,可致其出现永生化并显现肿瘤细胞特点〔7〕。所以,如何从中药中寻找促进MSCs增殖的有效组分,以及MSCs经体外大量扩增后如何能很好地保持其遗传稳定性是目前研究的热点。
MSCs具有较强的自我增殖和多向分化潜能,不仅可以定向诱导分化为中胚层细胞,而且还可跨胚层分化为内胚层及外胚层来源的细胞〔3〕;同时,MSCs具有易于从自体获取、体外分离、培养及外源基因的导入,极好的迁移能力和回植后不易发生免疫排斥反应等特点〔4〕,已成为众多领域临床细胞学治疗的最佳干细胞之一〔5〕。可见,MSCs对组织、器官的修复和替代具有重要的作用,且还是研究增殖与分化机制的模型。但MSCs 在骨髓中的含量极少,每1×106个骨髓单核细胞中仅有2~5个〔6〕,必须通过体外培养扩增才能满足临床需要。还有研究发现,长期体外扩增MSCs,可致其出现永生化并显现肿瘤细胞特点,如形态变小、致密,表面标志物表达异常,接触抑制减弱及端粒酶活性增强等,移植入动物体内,可形成肿瘤〔7〕。所以,MSCs经体外大量扩增后如何能很好地保持其遗传稳定性是目前研究的热点。
中药主要通过多靶点、多途径、多环节,在蛋白、基因水平调控细胞的增殖与分化,阻断正常细胞突变,从而在细胞水平上发挥“扶正”、“祛邪”的治疗作用,为中医的治则拓展了新的思路,为中医药理学理论带来新的诠释〔8〕。有研究认为,干细胞具先天之精属性,是先天之精在细胞层次的存在形式〔9〕,且中医理论认为“益气补血”、“精血同源”,补气生髓化血。黄芪为补中益气要药,红芪属于黄芪的一种,与黄芪同科异属。目前,国内外对黄芪研究较多,而对红芪及其有效成分的药效和药理学研究较少,且还处于初步阶段,许多分子生物学作用机制尚不清楚。
红芪有效成分黄酮、皂苷、氨基酸、低聚糖、寡糖及微量元素等均为小分子物质,含量较高,加强对其深入研究,将为红芪的进一步开发和广泛临床应用提供理论基础与实验依据。陶瓷膜超滤技术是以复合陶瓷膜为过滤介质,以压力差为推动力,利用陶瓷膜皮肤层上5~100 nm的微孔进行选择性筛分,实现对多组分混合物的物理分离、纯化、富集和浓缩的一种膜分离技术〔10〕。选择一定分子截留量的超滤膜,可实现有效成分与杂质的分离,保留中药原有的复方特色,使其在最大程度上发挥药效。研究表明红芪黄酮类、苷类等绝大多数相对分子质量在1 000以下。本研究选用陶瓷膜超滤技术对分子量不同物质进行切分,10 nm陶瓷膜超滤透过液中获得小分子物质。
干细胞的归巢是一个复杂的过程,与正常白细胞的归巢类似,MSCs与血管内皮细胞黏附并穿越胞外基质,此过程与MMP-2、MMP-9等有关。MMPs属于细胞内的蛋白水解酶家族,其主要功能是降解细胞外基质(ECM)和基底膜,在多种细胞中均有表达,如MSCs、成纤维细胞等〔11〕。近年来,越来越多的研究证实干细胞的分化行为高度依赖于其生存的微环境,干细胞微环境影响干细胞MMPs的表达变化,MMPs在MSCs自我更新、分化、运动等多种生物学行为中起着重要的调节作用〔12〕。MMP-2、MMP-9具有降解明胶,切割层黏连蛋白、弹性蛋白以及趋化因子能力。MMP-2主要功能为降解基底膜中的纤维连接蛋白和层黏连蛋白;而MMP-9主要功能为分解基底膜中的巢蛋白。
本实验中细胞生长曲线显示,红芪组细胞增殖迅速、生长活跃,具有接触抑制现象,表明红芪增强MSCs自我更新能力。细胞周期结果显示,红芪对MSC有明显促进增殖的作用,与细胞生长曲线结果一致。上述结果相互印证了红芪不仅可以促进MSCs增殖,且维持其遗传物质染色体的稳定性,其作用机制可能与调节MMP-2、MMP-9蛋白的表达有关,为红芪联合MSCs在细胞学治疗的临床应用提供了科学依据。
4参考文献
1Liu J,Hu X,Yang Q,etal.Comparison of the immunoregulatory function of different constituents in radix astragali and radix hedysari〔J〕.J Biomed Biotechnol,2010;2010:479426.
2郑海生,金智生,刘凯,等.红芪多糖对2型糖尿病胰岛素抵抗大鼠胰岛素敏感性影响的研究〔J〕.中华中医药学刊,2010;28(7):1516-8.
3Tian H,Bharadwaj S,Liu Y,etal.Myogenic differentiation of human bone marrow mesenchymal stem cells on a 3D nano fibrous scaffold for bladder tissue engineering〔J〕.Biomaterials,2010;31(5):870-7.
4Xu F,Shi J,Yu B,etal.Chemokines mediate mesenchymal stem cell migration toward gliomas in vitro〔J〕.Oncol Rep,2010;23(6):1561-7.
5Rota C,Morigi M.Use of mesenchymal stem cells of different origins in the treatment of acute renal failure〔J〕.G Ital Nefrol,2011;28(6):573-5.
6Pittenger MF,Mackay AM,Beck SC,etal.Multilineage potential of adult human mesenchymal stem cells〔J〕.Science,1999;284(5411):143-7.
7Rosland GV,Svendsen A,Torsvik A,etal.Long-term cultures of bone marrow-derived human mesenchymal stem cells frequently undergo spontaneous malignant transformation〔J〕.Cancer Res,2009;69(13):5331-9.
8陈赐慧,花宝金.中医药治疗肿瘤的优势〔J〕.中国中医药信息杂志,2013;20(1):6-7.
9张进,徐志伟,陈群,等.干细胞与中医基础理论中的先天之精学说〔J〕.中国临床康复,2006;10(7):189-92.
10陈余.膜分离技术在中药提取分离中的应用〔J〕.化学工程与装备,2013;2013(2):126-8.
11Mauro A,Buscemi M,Gerbino A.Immunohistochemical and transcriptional expression of matrix metalloproteinases in full-term human umbilical cord and human umbilical vein endothelial cells〔J〕.J Mol Histol,2010;41(6):367-77.
12Schneider RK,Puellen A,Kramann R,etal.The osteogenic differentiation of adult bone marrow and perinatal umbilical mesenchymal stem cells and matrix remodellng in three-dimensional collagen scaffolds〔J〕.Biomaterials,2010;31(3):467-80.
〔2015-02-04修回〕
(编辑袁左鸣)
