红皮土豆纯生清酒酿造工艺研究
2015-12-28刘林明杨平平张海涛孙自顶齐鲁工业大学食品与生物工程学院山东济南250300
刘林明,王 燕,杨平平,张海涛,孙自顶(齐鲁工业大学 食品与生物工程学院,山东 济南 250300)
红皮土豆纯生清酒酿造工艺研究
刘林明,王 燕,杨平平,张海涛,孙自顶
(齐鲁工业大学 食品与生物工程学院,山东 济南 250300)
以西藏红皮土豆为原料,通过单因素实验和正交试验,酿制纯生清酒,以膜过滤滤除菌体,得出土豆纯生清酒最佳酿造工艺条件为:酵母添加量0.2%,主发酵温度28℃,主发酵时间4 d,后发酵温度11~15℃,后发酵时间14 d。实验结果为红皮土豆进一步工业化生产提供了理论依据。
红皮土豆;纯生清酒;发酵工艺
随着健康消费观念的提高,低度酒在酒市场所占的份额逐年提高,开发研制新型低度保健酒成为酿酒行业的一个研究热点[1]。红皮土豆含淀粉和花青素,且富含多种微量元素,具有抗氧化作用,防癌抗癌、美容养颜、护心降血压、食疗效果极佳。西藏独特的气候地质条件,适合红皮土豆生长,每年产量很高,且红皮土豆钙、铁含量高,对人体补充钙、铁元素有很好的作用。目前国内外尚没有关于用红皮土豆做饮料酒的研究报道。本研究以西藏红皮土豆为原料,采用新型清酒工艺酿造红皮土豆清酒,研制的土豆清酒具有保健功能,营养丰富、色泽鲜亮、酒性醇和。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
红皮土豆:西藏合作企业提供;酿酒酵母 Y1、Y2、Y3:实验室保藏;耐高温 α-淀粉酶:诺维信公司;糖化酶:诺维信公司;其他试剂均为分析纯。
1.1.2 仪器
QUINTIX124-1CN电子天平:赛多利斯科学仪器(北京)有限公司;DZKW-C电子恒温水浴锅:黄骅市卸甲综合电器厂;SHP-150生化培养箱:上海精宏实验设备有限公司;LDZX-50KBS立式高压蒸汽灭菌锅:上海申安医疗器械厂;PB-10标准型 pH计:德国赛多利斯集团;TR501VATC酒精浓度计:深圳市同奥科技有限公司;SW-CJ-1FD洁净工作台:苏州安泰空气技术有限公司;L1523发酵罐:瑞士比欧生物工程公司;UV-5100B紫外可见分光光度计:上海精密仪器有限公司。
1.2 工艺流程及操作要点
1.2.1 工艺流程
土豆清酒酿造工艺流程见图1。
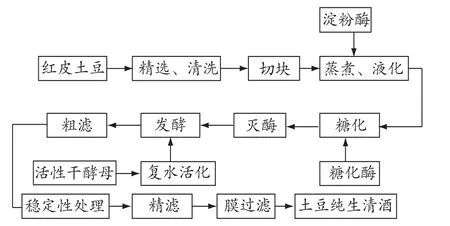
图1 发酵工艺流程
1.2.2 操作要点
蒸煮、液化:土豆和水的比例为1∶3,煮熟,采用边煮边液化方式,蒸煮 10 min后,调节pH值到6.0,加入耐高温 α-淀粉酶,继续蒸煮同时注意搅拌打碎成浆。
糖化:浆液冷却到60℃,调节pH值至4~5,加入糖化酶,每克土豆添加 100 U酶,60℃恒温处理2 h。
灭酶:浆液加热沸腾,维持10 min。
发酵:发酵分为主发酵和后发酵。
粗滤:6层纱布过滤除渣。
稳定性处理:混合添加单宁、明胶去除蛋白质,添加PVPP(交联聚乙烯吡咯烷酮)和硅藻土吸附酒中多酚物质[2]。
精滤:滤膜孔径0.8 μm。
膜过滤:滤膜的孔径最大不超过0.45 μm。
1.3 分析方法
土豆淀粉含量的测定参照国家标准GB/T 5514—2008《粮油检验 粮食、油料中淀粉含量测定》[3];发酵过程中定期取样检测,理化指标测定参照国家标准 GB/T 13662—2008[4];成品酒中甲醇含量测定参照国家标准 GB/T 5009.48—2003[5]。
2 结果与讨论
2.1 红皮土豆淀粉含量的测定
按照国标方法测定土豆淀粉含量X,平行测定4次,得到的数值分别为33.20%、33.61%、33.27%、33.51%,依次取两组数据 Xa和 Xb。 Xa-Xb/[(X1+X2)/2]×100%<5%数据有效,所以所测土豆淀粉含量:X=(X1+X2+X3+X4)/4≈33.40%。
2.2 液化工艺参数的确定
由于 α-淀粉酶添加量(每克土豆添加量)、液化时间、温度和 pH值四个因素共同影响土豆液化,实验本着节约能源、缩短周期的原则,采用边糊化边液化的方式,所用的酶为耐高温 α-淀粉酶,因此温度不在优化考虑范围,为全面考虑其他三个因素的影响,在预实验基础上,以酸碱调节 pH值,以水解度为指标设计 L9(33)正交试验,正交试验设计见表1,正交试验分析结果见表2。
由极差分析可知,各因素对液化效果的影响程度顺序为:pH值 >α-淀粉酶添加量 >温度,糖化的最优方案是 A2B3C2,即每克土豆原料添加 α-淀粉酶8 U,pH值控制在6,酶作用时间为0.5 h。

表1 α-淀粉酶液化条件正交试验设计
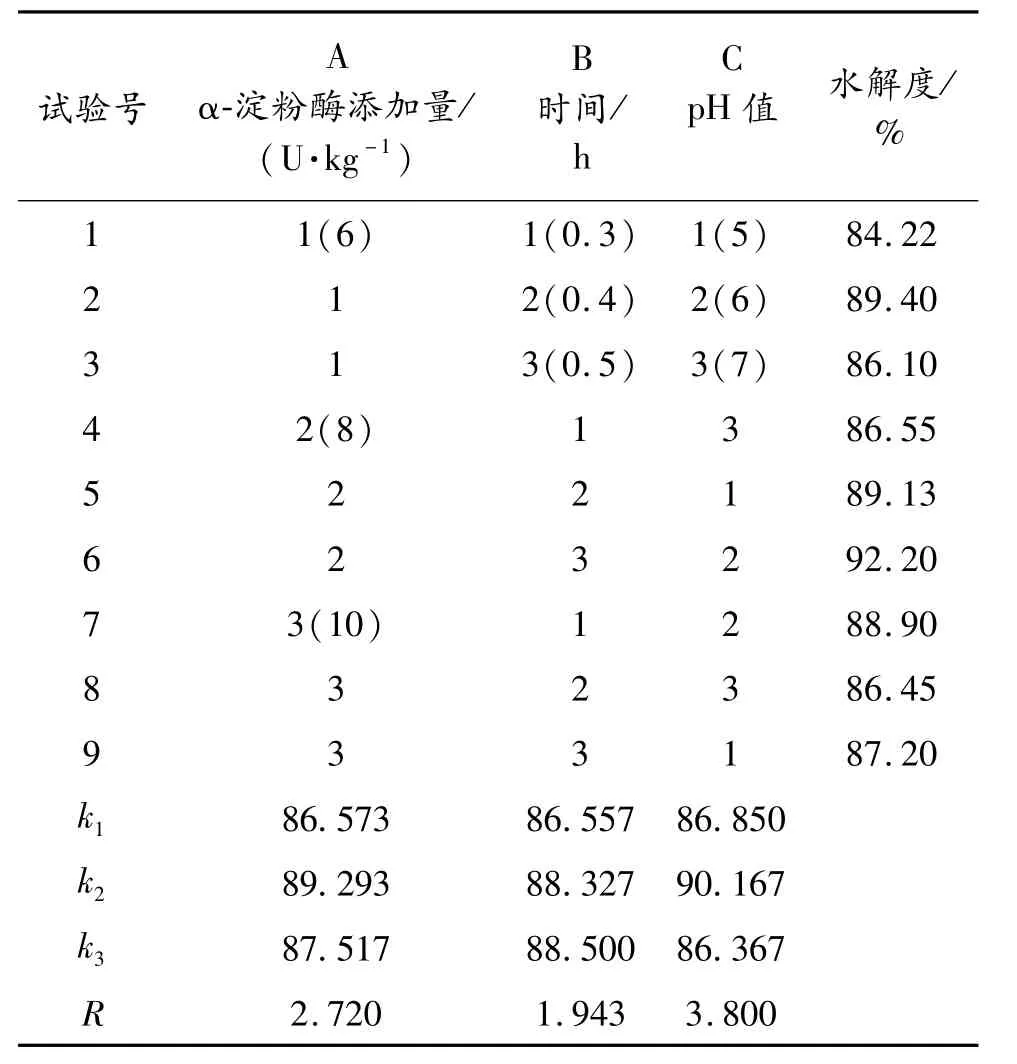
表2 α-淀粉酶液化条件正交试验结果
2.3 糖化工艺参数的确定
用糖化酶将液化充分的土豆浆液糖化,以糖化酶添加量、时间、pH值、温度为影响因素,3次实验取平均值作为实验数据,还原糖含量作为指标设计L9(34)正交试验,正交试验设计方案及结果见表3。
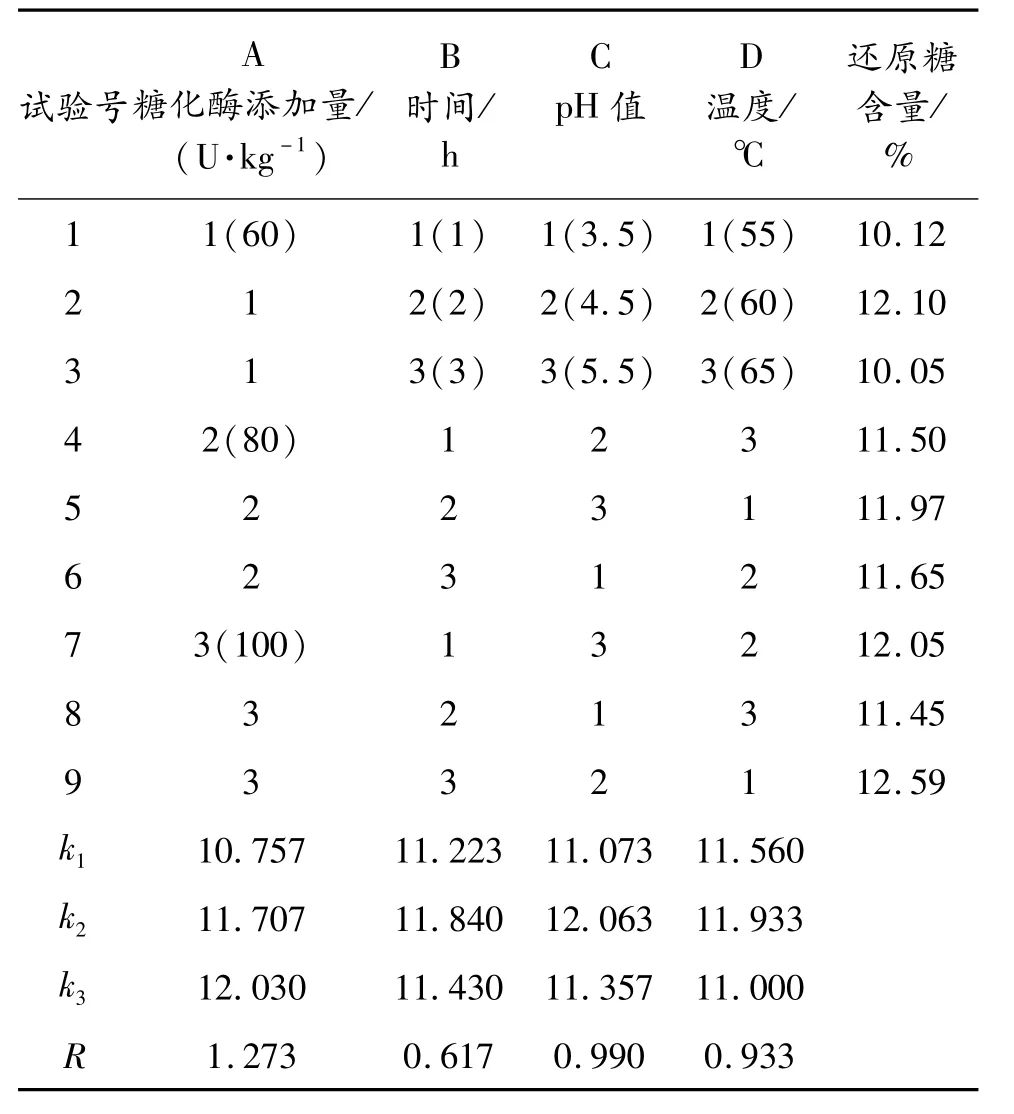
表3 糖化酶糖化条件的正交试验设计及结果
由表3中极差 R分析可知,糖化酶添加量对糖化影响效果最大,其次是温度和pH值,影响最小的是酶作用时间。比较 k值可以得出最优的组合方式是A3B2C2D2,在此条件下实验测得还原糖含量为13.25%,高于其他所有组次,所以最优的糖化条件为:每克土豆添加糖化酶量100 U,pH值4.5,60℃保温处理2 h。
2.4 发酵工艺参数的确定
发酵是整个生产过程中最重要的一环,直接影响成品酒的质量[6]。在研究中,将对发酵结果可能产生较大影响的酵母菌种类、接种量、初始 pH值、温度、发酵时间作为考察因子,以成品酒的理化指标作为指标设计单因素实验和正交试验,最终确定最优的发酵工艺参数。
2.4.1 单因素实验设计
2.4.1.1 酵母菌的选择对酒的影响
将糖化好的土豆浆液分别接种酿酒酵母 Y1、Y2、Y3,接种量均为0.2%,28℃发酵 4 d,后转移到11~15℃下发酵14 d,比较成品酒的感官特性和理化特性。比较三种酵母发酵的成品酒:均为清亮透明的淡黄色,有特有的土豆香气。Y1条件下的酒口感略酸,酒味重,口感较单一,其余两种条件下的酒口感柔和,酸甜适口。比较酒度和 pH值,结果如图2所示。
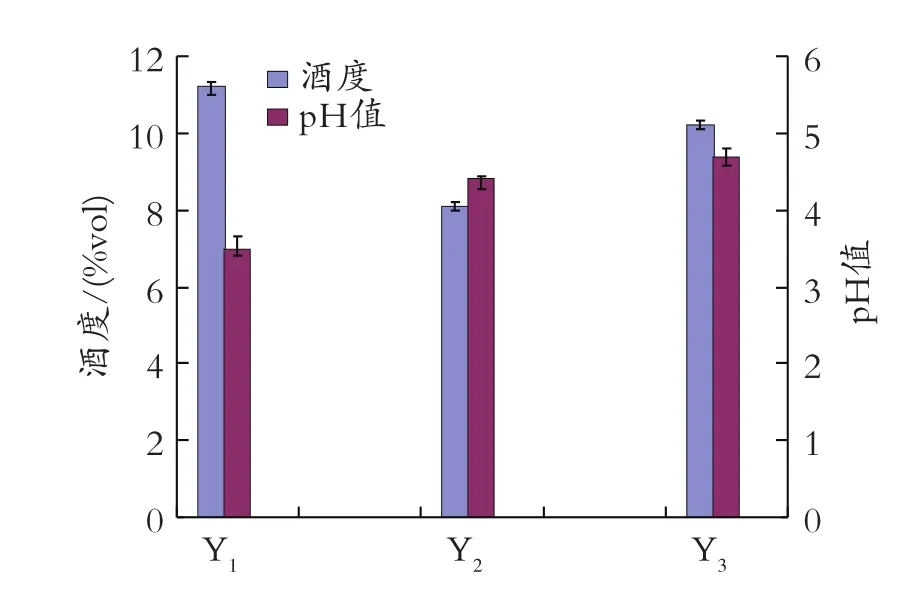
图2 不同酵母菌对酒度和 pH值的影响
由图 2可知,Y1和 Y3条件的清酒酒度高,Y2条件的酒度偏低,残糖高,结合感官特性结果,Y3条件下酿造的红皮土豆清酒最好。
2.4.1.2 酵母菌接种量对酒的影响
接种酵母 Y3,改变接种量,28℃发酵4 d,后转移到11~15℃下发酵14 d,比较成品酒的感官特性和理化特性,结果见表4。
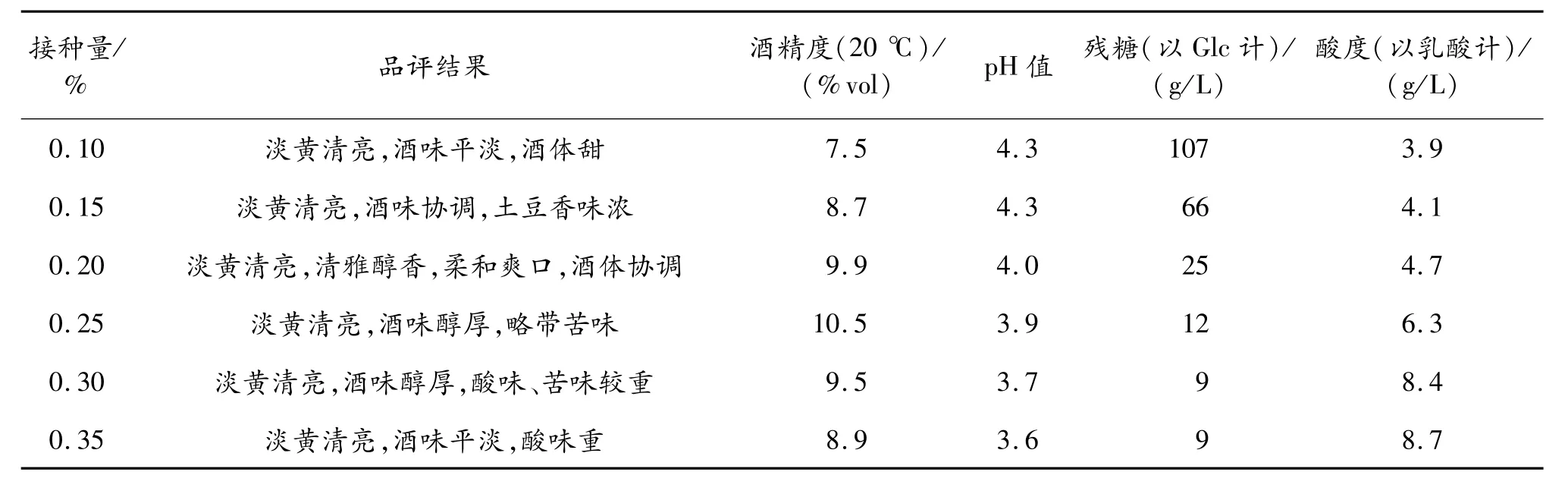
表4 酵母菌接种量对酒的影响
从表4可以看出,当接种量小于0.15%时,发酵缓慢,酒度较低;当接种量大于0.25%时,酒体发酸,原因可能是过高的接种量导致发酵过快,发酵后期残糖较少,酵母开始大量死亡;当接种量控制在0.15%~0.25%时,酒的品质较高,其中接种量为0.2%时最好。
2.4.1.3 初始pH值对酒的影响
接种酵母 Y3,改变 pH值,28℃发酵4 d,后转移到11~15℃下发酵14 d,比较成品酒的品质发现pH值在3.5~6.5时,酒的感官特性和理化指标变化不大,这个范围内的初始 pH值对成品酒的影响不大,按照简化原则,初始 pH值不再调整。
2.4.1.4 主发酵温度对酒的影响
主发酵温度分别为22、24、26、28、30、32、34℃,其他条件均按前面优化后条件,28℃发酵4 d,后转移到11~15℃下发酵14 d,比较酒度和酸度,结果见图3。

图3 主发酵温度对酒度和酸度的影响
从图3可以看出,主发酵温度控制在28~30℃时,发酵彻底,酒度较高,但温度超过28℃时酸度开始明显上升,对28℃和30℃发酵条件下的酒品评比较,30℃发酵的酒酸味明显重,且有更浓的苦味;28℃发酵的酒酒味醇厚,酒体协调,酸度适中,因此选用28℃为主发酵温度较适宜。为增加酒体协调感,进一步丰富酒的口感,主发酵完全后把醪液放置于11~15℃的低温下后再发酵14 d,这样经过后酵的酒口感丰富,酒体更协调,酒味也更醇厚。
2.4.1.5 主发酵时间对酒的影响
按照上述优化的条件发酵,从发酵第二天开始,每隔1天进行一次检测,直到酒度变化不大后继续发酵2 d,检测结果如图4所示。

图4 主发酵时间对酒度和酸度的影响
从图4可知,当发酵进行到第四天时,主发酵基本结束,此后酒度变化不大,酸度有较明显上升。对这些批次的酒进行感官比较后,发现发酵 4 d的酒口感明显优于其他发酵时间的酒。因此主发酵时间控制在4 d最好。
2.4.2 正交试验设计
参考单因素实验结果,以酵母菌种类、接种量、温度、主发酵时间作为考察因子,3次实验取平均值作为实验数据,品评结果作为指标设计 L9(34)正交试验,品评结果参照黄酒评定标准采用打分制,正交试验设计方案及结果见表5。

表5 发酵工艺正交试验设计及结果

续表5
由表5可知,酵母菌种类对发酵影响最大,其次是主发酵时间和接种量。比较k值可以得出最优的组合方式是 A3B2C2D2,在此条件下进行试验,品评打分成绩96.2,高于其他所有组次,所以最优的发酵条件为:选用酵母 Y3作为菌种,接种量为 0.2%,28℃下发酵4 d后,转移到 11~15℃条件下发酵14 d。
2.5 甲醇含量的测定
参照国家标准 GB/T 5009.48—2003,分光光度法测定成品酒中甲醇含量,配制甲醇标准溶液,用2 mL比色皿,在590 nm处测定吸光度,绘制标准曲线如图5所示。
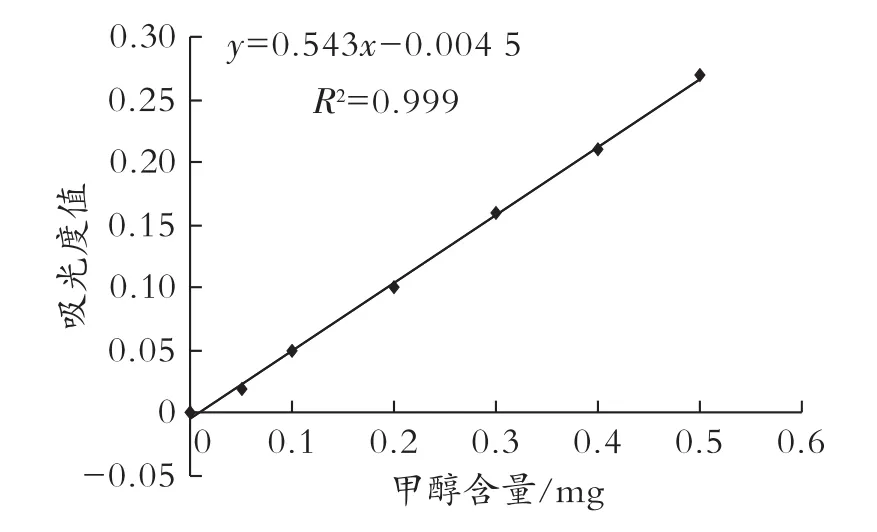
图5 甲醇标准曲线的测定
依次取2 mL酒样置于3个比色皿中,按照国标法测定各自吸光度,测得数值依次为 0.98、0.96、0.95,代入回归方程求得甲醇含量依次为1.82、1.78、1.76 mg。将求得的甲醇数值代入如下公式测定样品酒中甲醇的含量:X=m/(V×1000)×100,计算得出 X1、X2、X3分别为 0.091、0.089、0.088,平均数为0.089,即每100 mL酒中甲醇含量为0.089 mg,远低于每100 mL酒中甲醇含量不得超过0.2 mg的标准,达到酿造酒国家标准。
2.6 花青素含量的测定
配制不同浓度锦葵色素标准溶液,浓度依次为0、3、6、9、12、15、18、21、24 μg/mL,在546 nm处测定吸光度,绘制标准曲线如图6所示。
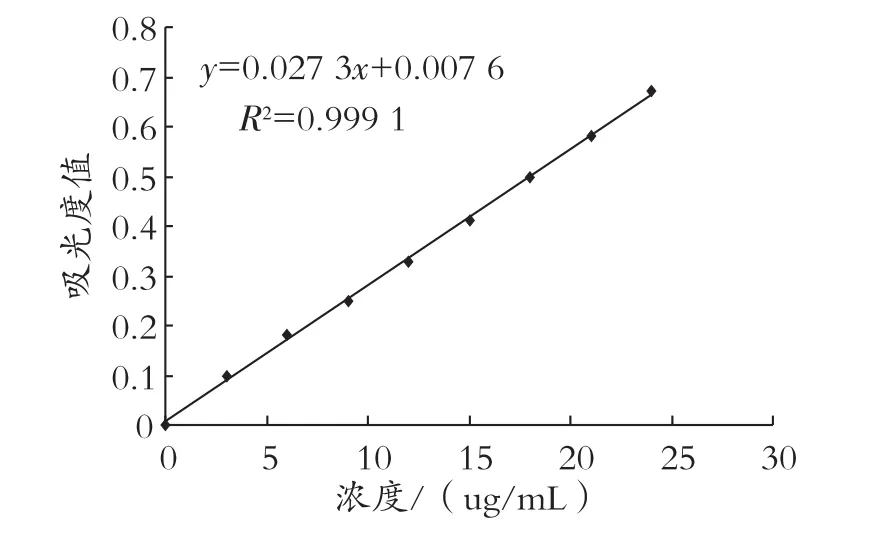
图6 花青素标准曲线的测定
平行三组测定待测酒样的吸光度,代入回归方程求得浓度,三数值求平均值得出酒样中花青素的浓度为4.3 μg/mL。
2.7 稳定性处理
提高清酒稳定性一直是清酒生产中一项重要的课题,清酒出现不同程度的浑浊、沉淀现象严重影响产品的感官品质和销售。浑浊分为生物浑浊和非生物浑浊,前者是由微生物污染引起的,可通过彻底灭菌和预防杂菌污染来解决;后者则是由蛋白质、多酚等引起的,实验采用混合添加单宁、明胶去除蛋白质,添加 PVPP(交联聚乙烯吡咯烷酮)和硅藻土吸附酒中多酚物质,经过稳定性处理的酒样室温密封存放3个月,酒样澄清,口感更佳,适宜存储后饮用。
3 结论
本研究采用边蒸煮边液化操作的方法,液化充分,且有效缩短了工艺流程,提高了能源利用率,节能省时。研究结果表明,采用酵母菌 Y3发酵,接种量为0.2%,28℃下发酵4 d后,转移到11~15℃下后发酵14 d左右,可得到较高品质的土豆清酒,生产出来的酒清亮透明,呈淡黄色,酒体协调,清雅醇香,具有独特的红皮土豆风味。本研究中未经巴氏灭菌或瞬时高温灭菌,而采用物理方法除菌,保证了纯生清酒的“生”,口感新鲜,酒香清醇,口味柔和,营养丰富。终滤膜过滤前,必须经过粗滤和精滤,之所以这样做是为了减轻终过滤膜的压力,防止滤膜超负荷引起损坏。终过滤膜的孔径最大不超过0.45 μm。
[1]杨瑞,苏慧,张伟.低度紫薯酒及其发酵规律的研究[J].酿酒科技,2008,(9):55-57.
[2]喇录忠,李善文.青稞清酒混浊的防止措施[J].酿酒,2013,(4):64-65.
[3]GB/T 5514—2008粮油检验 粮食、油料中淀粉含量测定[S].
[4]GB/T 13662—2008黄酒[S].
[5]GB/T 5009.48—2003蒸馏酒与配制酒卫生标准的分析方法[S].
[6]胡普信.纯生黄酒工艺的研究[J].食品与发酵工业,2010,(8):93-96.
[责任编辑:王东霞]
Study on Brewing Technology of Red Potatoes Draft Sake
LIU Lin-ming,WANG Yan,YANG Ping-ping,ZHANG Hai-tao,SUN Zi-ding
(School of Food and Biological Engineering,Qilu University of Technology,Jinan 250300,Shandong,China)
With red potatoes from Tibet as raw material,the optimization of fermentation conditions was investigated by single factor experiments and orthogonal experiments.The optimum conditions for the brewing process were as following:yeast of 0.2%,main fermentation temperature of 28℃,main fermentation time of 4 d,later fermentation temperature of 11~15℃,later fermentation time of 14 d.The results provide theoretical support for the further industrialized production of red potatoes.
red potatoes;draft sake;fermentation condition
TS262.4
:A
:1006-8481(2015)02-0018-05
2014-07-16
刘林明(1988—),男,齐鲁工业大学食品与生物工程学院在读硕士研究生;王燕(1961—),女,齐鲁工业大学食品与生物工程学院教授,博士。
