溶胶-凝胶法制备稀土金属离子掺杂LiFePO4/C正极材料及其电化学性能研究
2015-12-28龙秉文邓伏礼刘生鹏杨昌炎丁一刚
袁 铭,梁 蕾,龙秉文,邓伏礼,刘生鹏,杨昌炎,丁一刚
(1.武汉工程大学化工与制药学院湖北省新型反应器与绿色化学工艺重点实验室绿色化工过程省部共建教育部重点实验室,湖北武汉430074;2.湖北祥云(集团)化工股份有限公司,湖北黄冈435400)
近年来,LiFePO4(LFP)作为锂离子电池正极材料因其绿色、无毒、原材料来源广泛而廉价、充放电电压较高、比容量大、循环性能和倍率性能良好、稳定性卓越等受到越来越多的关注[1-2]。但是作为晶体颗粒,LiFePO4不可避免地存在晶体结构缺陷、排列不规整、电导率和离子扩散率极低(电导率只有10-9S·m-1)[3-4]等问题,严重限制了LiFePO4作为二次电池正极材料的应用。目前,除了在工艺上进行优化以提高LiFePO4的电化学性能外,主要依靠碳包覆和金属离子掺杂来改善晶体结构、导电性能和振实密度等[5-7]。大量关于金属离子掺杂改性LiFePO4的研究报道中所用金属离子包括Mg2+、Mn2+、Al3+、Ti4+、Cu2+、Ni2+等,而采用稀土金属离子掺杂改性LiFePO4的报道不多,稀土金属离子的半径大,可以使LiFePO4的晶体层间距变大,从而加快了Li+脱出和嵌入的速度。陈晗等[8]采用固相法,分别掺杂5种固定比例的稀土金属离子合成了Li0.99Re0.01FePO4(Re=Er、Y、Gd、Nd、La),其中Li0.99Gd0.01FePO4具有最优的电化学性能,在0.1C 和1C 充放电倍率下其比容量分别为136.6mAh·g-1、121.7mAh·g-1。武聪等[9]同样采用固相法合成了掺杂了不同量Ce的LiFePO4,发现Li0.9975Ce0.0025FePO4首次放电比容量可达116 mAh·g-1。
作者在此采用溶胶-凝胶法,以Tm2O3、Sm2O3、CeO2和Gd2O3等相对廉价的稀土金属氧化物作为掺杂剂,以葡萄糖为碳源制备了碳包覆的LiFePO4/C 正极材料,考察了不同稀土金属离子和不同掺杂量对LiFePO4/C的结构和电化学性能的影响。
1 实验
1.1 试剂与仪器
磷酸铁、草酸、氢氧化锂、葡萄糖,分析纯,国药集团化学试剂有限公司;氧化铥、氧化钐、氧化铈、氧化钆,99.9%,阿拉丁试剂有限公司;实验用水为蒸馏水。
Rigaku D/MAX-RB 型X-射线衍射仪(Cuκα射线,电压40kV,电流45mA);JSM-5510LV 型扫描电子显微镜;CT2001A 型电池测试系统;DF-101S型集热式恒温加热磁力搅拌器;SK2-4-13型管式电阻炉;DZF-6020型真空干燥箱;DG-W100型电动加热对辊机;Super(1220/750)型手套箱;QM-3SP04型行星式球磨机;SKL-2032型扣式封口机。
1.2 稀土金属离子掺杂LiFePO4/C正极材料的制备
溶胶-凝胶法制备稀土金属离子掺杂LiFePO4/C正极材料的工艺流程[10]见图1。
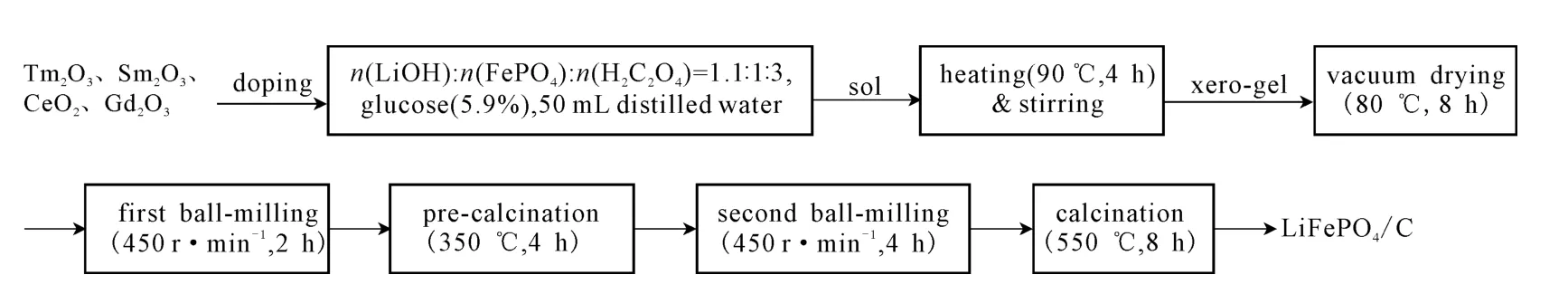
图1 溶胶-凝胶法制备稀土金属离子掺杂LiFePO4/C正极材料的工艺流程Fig.1 Process flow of cathode material LiFePO4/C doped with rare earth metal ions by sol-gel method
将氢氧化锂、磷酸铁和草酸按物质的量比1.1∶1∶3与葡萄糖(质量分数5.9%,碳源)和50mL 蒸馏水一起加到三口烧瓶中,再分别按掺杂量1%、2%、3%、5%(质量分数,下同)加入稀土金属氧化物,在水浴锅中搅拌,使温度达到90 ℃,保持4h,然后降至室温,真空蒸馏至80 ℃,即得前驱体。反应式如下:
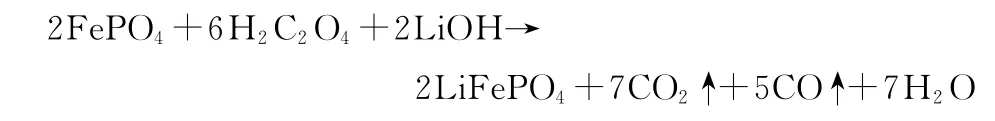
将所制备的前驱体干燥后,加入酒精开始第1次球磨(2h),干燥,在氮气保护下于管式马弗炉中350 ℃预烧4 h(升温速率为5 ℃·min-1,直到350 ℃,煅烧过程也采用这一升温速率),冷却至室温,取出;再加入酒精开始第2 次球磨(4h),干燥,在550 ℃煅烧8h,冷却后即得LiFePO4/C。
1.3 LiFeO4/C正极材料的表征
LiFePO4/C正极材料的微观形貌和晶体结构分别采用扫描电子显微镜和X-射线衍射仪进行分析。
1.4 电池的组装与电化学性能测试
将所制备的LiFePO4/C(80%)、乙炔黑(10%)、60%聚四氟乙烯分散液(10%)充分混合,制成黏稠的浆料,通过对辊机把浆料制成一块厚约1mm 的均匀薄片,于真空干燥箱中120 ℃干燥12h。将干燥好的薄片裁成小圆片,称量并与圆形钢丝网压实在一起,即制得扣式电池的正极片。将所制备的17个正极材料样(16个掺杂LiFePO4/C 改性样+1个空白样)制成正极片后,在手套箱中以锂片为负极装配成8个2032扣式电池,再使用电池测试系统在室温下对电池进行电化学性能测试,用G 值法检测得到的平行实验数据的显著性,结果表明所得的平行数据的可信度均在99%以上。
2 结果与讨论
2.1 稀土金属离子的掺杂对LiFePO4/C比容量的影响
将所组装的电池在0.1C的充放电倍率下进行充放电性能测试,首次放电比容量如图2所示。
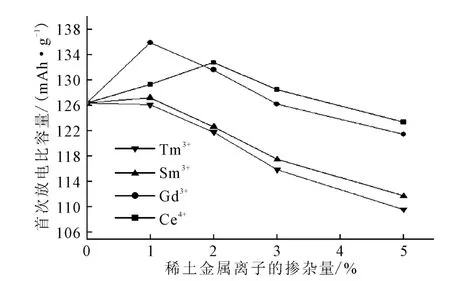
图2 正极材料的首次放电比容量Fig.2 The initial discharge capacity of cathode materials
由图2 可以看出:空白样的首次放电比容量为126.3mAh·g-1,比固相法所制备的LiFePO4/C 高;掺杂1%Gd3+的LiFePO4/C 具有最高的首次放电比容量,达135.7 mAh·g-1,但随着掺杂量的增加,其首次放电比容量呈下降的趋势,当Gd3+掺杂量提高到5%时,其首次放电比容量下降到121.4 mAh·g-1;掺杂Ce4+的LiFePO4/C 的首次放电比容量随Ce4+掺杂量的增加先上升后下降,在掺杂量达到2%时LiFePO4/C表现出最佳的首次放电比容量,达132.6 mAh·g-1;而Sm3+和Tm3+的掺杂会使LiFePO4/C的首次放电比容量降低,而且随着掺杂量的增加降幅增大。
首次放电比容量反映了所制备的LiFePO4/C中具有能够提供可脱出/嵌入Li+的正极材料的含量,即活性LiFePO4的含量(LiFePO4的理论比容量为170 mAh·g-1),适量的Gd3+和Ce4+的掺杂可以提高活性LiFePO4的含量。
2.2 稀土金属离子的掺杂对LiFePO4/C循环性能的影响
对掺杂1%Gd3+、2%Ce4+、1%Tm3+、1%Sm3+的LiFePO4/C 和空白样进行循环性能测试,即在0.1C的充放电倍率、室温下稳定充放电循环50次后,测定其比容量保持率,结果见表1。

表 1 LiFePO4/C 充放电循环50次后的比容量保持率/%Tab.1 The specific capacity retention of LiFePO4/C after charge-discharge cycle for 50times/%
由表1可以看出,掺杂1%Tm3+和1%Sm3+的LiFePO4/C充放电循环50 次后比容量保持率比空白样低,表明Tm3+和Sm3+的掺杂对LiFePO4/C的性能没有改善,反而会影响LiFePO4/C 的电化学性能;掺杂2%Ce4+的LiFePO4/C 表现出较好的循环性能,在充放电循环50 次后其比容量保持率可达93.3%;掺杂1%Gd3+的LiFePO4/C 的比容量保持率也明显高于空白样。
循环性能与LiFePO4/C 的结构稳定性直接相关,充放电循环过程就是Li+不断的脱出和嵌入的过程,掺杂适量的Gd3+和Ce4+,可以凭借它们较大的离子半径扩大Li+脱出和嵌入的路径,从而增大LiFePO4/C的比容量,同时也提高了LiFePO4/C 晶体结构的稳定性。
2.3 稀土金属离子的掺杂对LiFePO4/C倍率性能的影响
对掺杂1%Gd3+、2%Ce4+的LiFePO4/C 和空白样进行倍率性能测试,即分别在0.1C、0.5C、1C、5C和10C的充放电倍率下测试比容量,结果见图3。
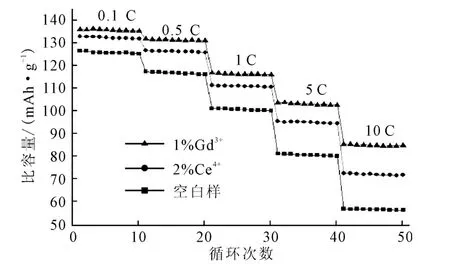
图3 正极材料的倍率性能Fig.3 The rate capability of cathode materials
由图3可以看出,随着充放电倍率的增加,正极材料的比容量显著降低,同空白样相比,掺杂1%Gd3+和2%Ce4+可以明显提高LiFePO4/C 的倍率性能,其中掺杂1%Gd3+的正极材料在10C 充放电倍率下的比容量为85.5mAh·g-1,掺杂2%Ce4+的正极材料在10C充放电倍率下的比容量为72.8mAh·g-1,空白样在10C 充放电倍率下的比容量只有57.1 mAh·g-1。
正极材料的导电性能(即电子和Li+在两相间的移动速度)直接制约了LiFePO4/C 的倍率性能,高倍率意味着需要更快的电子和Li+移动速度,在LiFePO4/C中掺杂适量的Gd3+和Ce4+均可以提高正极材料的导电性和减小Li+的扩散阻力。
2.4 XRD分析(图4)
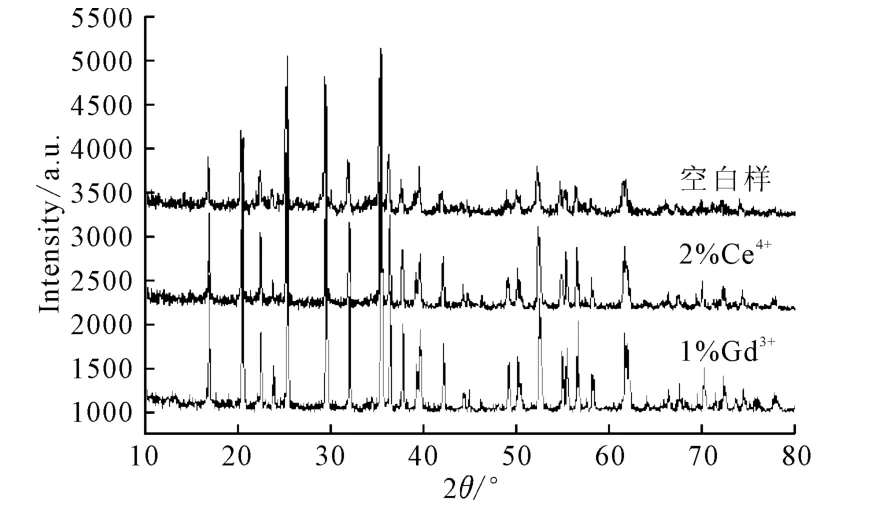
图4 LiFePO4/C的XRD图谱Fig.4 XRD Patterns of LiFePO4/C
对比橄榄石结构LiFePO4的XRD 标准卡(JCPDS 卡号:83-2092)可知,空白样和掺杂1%Gd3+或2%Ce4+的LiFePO4/C 都是典型的橄榄石结构的LiFePO4。由图4可看出,掺杂1%Gd3+的衍射峰最尖锐,衍射强度最高,其次是掺杂2%Ce4+,而空白样的衍射强度最弱。这说明掺杂1%Gd3+或2%Ce4+的LiFePO4/C的晶相较空白样更加完美,晶体颗粒的结晶度高而且分散均匀,即掺杂1%Gd3+或2%Ce4+可以显著改善LiFePO4/C 的晶体结构,其中掺杂1%Gd3+的效果最好。较规整的晶相意味着晶体颗粒的结构缺陷更少,这是高比例的活性物质存在和Li+能够具有较高扩散速率的保证,而这些与正极材料的电化学性能直接相关。
2.5 SEM 分析(图5)
由图5可以看出:空白样的晶体颗粒基本都聚集在一起,很难确定粒径大小,也没有固定形状(图5c),大量晶体颗粒的聚集会将部分LiFePO4/C 包裹在里层,使得Li+的扩散严重受阻,产生大量没有活性的LiFePO4/C而导致比容量降低;掺杂了1%Gd3+的LiFePO4/C,其晶体颗粒分散,粒径在400nm 左右,且基本都呈球形(图5a),这是比较理想的晶体颗粒;掺杂了2%Ce4+的LiFePO4/C 的微观形貌介于掺杂了1%Gd3+的LiFePO4/C和空白样之间,晶体颗粒分散不均匀,存在部分结团的现象(图5b)。

图5 掺杂1%Gd3+(a)、2%Ce4+(b)的LiFePO4/C和空白样(c)的SEM 照片Fig.5 SEM Images of LiFePO4/C doped with 1%Gd3+(a)、2%Ce4+(b)and blank sample(c)
3 结论
采用溶胶-凝胶法制备了碳包覆的掺杂稀土金属离子Gd3+、Ce4+、Sm3+和Tm3+的LiFePO4/C正极材料,其中Sm3+和Tm3+的掺杂会使正极材料的电化学性能变差,而掺杂1% Gd3+或2% Ce4+会使LiFePO4/C的电化学性能提高,其中掺杂1%Gd3+的效果最好,0.1C下LiFePO4/C 的首次放电比容量可达135.7mAh·g-1,10C下为85.5mAh·g-1,其充放电循环50次后仍可保持92.1%的比容量,并具有较好的晶体结构和微观形貌。
[1]ZAGHIB K,STRIEBEL K,GUERFI A,et al.LiFePO4/polymer/natural graphite:Low cost Li-ion batteries[J].Electrochimica Acta,2004,50(2):263-270.
[2]PADHI A K,GOODENOUGH J B,NANJUNDASWAM K S.Phospho-olivines as positive-electrode material for rechargeable lithium batteries[J].Electrochem Soc,1997,144(4):1188-1194.
[3]UCHIDA S,YAMAGATA M,ISHIKAWA M.Optimized condition of high-frequency induction heating for LiFePO4with ideal crystal structure[J].Journal of Power Sources,2013,243:617-621.
[4]WAKIHARA M.Recent developments in lithium ion batteries[J].Mater Sci Eng,2001,33(4):109-134.
[5]LAN Y C,WANG X D,ZHANG J W,et al.Preparation and characterization of carbon-coated LiFePO4cathode materials for lithium-ion batteries with resorcinol-formaldehyde polymer as carbon precursor[J].Powder Technology,2011,212(2):327-331.
[6]ZHAO B,JIANG Y,ZHANG H J,et al.Morphology and electrical properties of carbon coated LiFePO4cathode materials[J].Journal of Power Sources,2009,189(1):462-466.
[7]SAUVAGE F,BAUDRIN E,LAFFONT L,et al.Origin of electrochemical reactivity enhancement of post-annealed LiFePO4thin films:Preparation of heterosite-type FePO4[J].Solid State Ionics,2007,178(1-2):145-152.
[8]陈晗,王生朝.锂离子电池正极材料Li0.99Re0.01FePO4的合成及性能[J].湖南有色金属,2008,24(6):37-40.
[9]武聪,罗绍华,田勇,等.稀土铈掺杂LiFePO4正极材料的电化学性能研究[J].硅酸盐通报,2009,28(Z):153-156.
[10]沈琼璐.锂离子电池正极材料磷酸铁锂的合成与性能研究[D].武汉:武汉工程大学,2013.
