金纳米颗粒在电化学传感中的应用
2015-12-28
(伊犁师范学院电子与信息工程学院,新疆伊宁835000)
近年来,功能化的纳米材料引起了研究者的广泛关注,其中,金纳米颗粒因其独特的电子、光学、热性能以及在物理、化学、生物学、药学和材料科学中的特性受到青睐。尤其在分析化学领域,功能化的金纳米颗粒可用于制造各种灵敏度高、选择性好、可靠性高、成本低、性能优异的电化学传感器(图1),对信号起到增强、放大的作用。
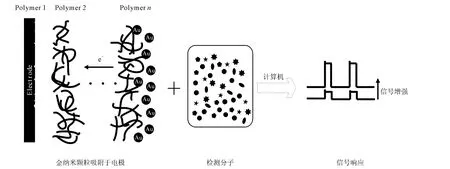
图1 电化学传感器的原理Fig.1 Principle of electrochemical sensor
金纳米颗粒作为一种新型的电化学传感介质,结合适宜的配体修饰电极,不仅能促进检测分子与电极之间的电子转移,而且能提高体系的灵敏度、催化性与检测限。另外,金纳米颗粒能固定活的生物细胞,保留其生物活性,为生物分子提供适宜的微环境,放大电化学传感器的分析信号。
金纳米颗粒因其良好的生物兼容性,可用于酶、蛋白质和DNA 的检测。基于金纳米颗粒,结合电化学测量手段可实现重金属离子的检测,实时、在线解决环境问题。基于癌细胞的生物分析,将金纳米颗粒用于医疗诊断可解决癌细胞检测繁冗、费用高、仪器贵等问题。基于金纳米颗粒,还可构建比色传感器、荧光传感器、表面等离子体共振传感器、表面增强拉曼散射传感器等。作者在此介绍了金纳米颗粒的合成与表面修饰,对金纳米颗粒在电化学传感中的应用进行了综述,拟为电化学传感器的研究提供新策略。
1 金纳米颗粒的合成与表面修饰
1.1 金纳米颗粒的合成
自Schmid和Brust等突破性报道金纳米颗粒的合成后,目前已发展了多种金纳米颗粒合成方法。金纳米颗粒在制备过程中受到各种因素的影响,包括pH 值、保护剂用量、反应温度、试剂浓度、外界条件等。Park等[1]通过控制金离子与稳定剂十二烷基硫酸钠(SDS)的比值R和超声波功率,合成了多种形状和尺寸的金纳米颗粒,当R=1时,金纳米颗粒平均粒径为18nm,显示球形或者三角形;当R=0.2时,平均粒径为10nm,也显示球形或者三角形;当R=0.1时,粒径继续减小,显示为杆状或圆盘状。Sugano等[2]采用无阀微泵混合脉冲法制备金纳米颗粒,其粒径随频率的增大而增大,50 Hz、100 Hz、200 Hz对应的平均粒径分别为11.2nm、16.1nm、22.8nm。Jiang等[3]利用(110)晶面,通过种子生长法合成了五星形多面体的金纳米颗粒,通过改变生长液的浓度来调整金纳米颗粒的粒径,合成的金纳米颗粒对提高催化、能量转换等具有十分重要的意义。Lähde等[4]在200~800 ℃下,通过气溶胶辅助合成了不同粒径的金纳米颗粒。
金纳米颗粒根据其分散性可分为多分散性金纳米颗粒和单分散性金纳米颗粒。单分散性金纳米颗粒的合成方法主要有离心沉降法、相转移法、还原剂还原法(柠檬酸钠还原法、抗坏血酸还原法、鞣酸-柠檬酸钠还原法、白磷还原法)、种子生长法和电泳法等。
还原剂还原法是制备金纳米颗粒最常用的方法,通过改变还原剂和保护剂的用量来有效控制金纳米颗粒的粒径。以还原能力较强的柠檬酸钠为例,将其与氯金酸(HAuCl4)溶液混合,刚开始时,只有部分金离子(Au-)被还原成金原子(Au),随着反应的进行,逐渐形成金核,金核的粒径很小,具有很大的表面能;当金原子形成稳定的晶核时,会将柠檬酸根负离子吸附到表面,阻碍AuCl-4与金核的进一步接触,防止金核的过生长;继续加入柠檬酸钠,两者的接触面逐渐扩大,导致金纳米颗粒粒径逐渐减小;反应停止后,金纳米颗粒表面吸附的柠檬酸根负离子有效阻止了颗粒间的团聚,避免其二次生长。但柠檬酸钠用量过多时会因为大量的钠离子与金纳米颗粒表面的柠檬酸根负离子发生中和反应而减小颗粒间的斥力,加速团聚。
种子生长法主要用于合成粒径比较大的金纳米颗粒。该方法是用预先合成的单分散小颗粒(505nm)作为晶种,加入氯金酸溶液、羟胺、还原剂,促使金离子自行还原,从而实现金纳米颗粒的二次生长,通过控制氯金酸与晶种的比例,可合成不同粒径的颗粒。反应完成时,需加入适量的稳定剂[如聚乙烯吡咯烷酮(PVP)、十六烷基三甲基溴化铵(CTAB)],防止因粒径过大而导致聚沉。
1.2 金纳米颗粒的表面修饰
众所周知,金纳米颗粒是由金盐在水溶液、有机相或者两相中的化学反应合成,若没有修饰剂保护,表面能极高的金纳米颗粒易发生团聚或表面钝化,应用到电化学传感中很难观察到响应信号。因此,对金纳米颗粒的表面修饰一直是该领域的研究热点。
万菁等[5]利用Au-S之间的键合作用,将肝素钠固定到金纳米颗粒表面,通过肝素与蛋白质之间的特异性作用以及金纳米颗粒良好的生物相容性,为研究病毒、细胞分子、糖提供了一种媒介。Schofield等[6]用乳糖衍生物修饰金纳米颗粒,通过比色法检测霍乱毒素。Kong等[7]用半胱胺和硫基葡萄糖修饰金纳米颗粒,通过X-射线或γ-射线照射癌细胞,发现修饰后的金纳米颗粒能有效提高对癌细胞的杀伤能力。
对于聚合物分子修饰金纳米颗粒,由于低浓度的均聚物和嵌段共聚物即可有效稳定金纳米颗粒,所以聚合物修饰是目前应用最多的金纳米颗粒表面修饰方法。巯基、硫醇、羧基、氨基以及巯基衍生的一些配基基团都可作为表面修饰剂,它们通过物理吸附或者共价键的方式形成较牢固的键合力,使金纳米颗粒性质趋于稳定,再结合电化学测量手段达到检测的目的。
对于树型超大分子修饰金纳米颗粒,由于其特殊的结构和性能特点,一般以氨基为端基基团、聚酰胺-胺(PAMAM)树状大分子为模板对金纳米颗粒进行修饰,将金纳米颗粒封装于PAMAM 的内部空腔,可保持金纳米颗粒的稳定性,再通过PAMAM 可控表面引入大量的功能性基团,为生物检测、分析化学、电化学传感、材料改进等领域提供了新策略。
对于生物分子修饰金纳米颗粒,由于其良好的生物相容性和大的比表面积,可灵活应用于生物分子的识别,包括生物鉴定、生物成像和生物传感器等。例如,DNA 探针技术[8]是巯基化的DNA 链修饰到金纳米颗粒上构成纳米金探针,可实现对寡核苷酸的比色检测;若蛋白质通过共价键物理吸附到纳米金探针上,则可实现对蛋白质的检测。
2 金纳米颗粒在电化学传感中的应用
金纳米颗粒的高表面能和界面可控性提高了修饰分子在其表面的固定率、增强了分析信号,良好的生物相容性促进了生物分子与电极之间的电荷传递,这些优异的催化性能使得金纳米颗粒在电化学传感中得到广泛应用。金纳米颗粒一般通过静电吸附、共价键、电化学沉积等方法修饰电极,因此,金纳米颗粒修饰的电化学界面是光电化学传感器增强信号响应的关键。
2.1 用于小分子的检测
金纳米颗粒已经用于增强许多小分子(如葡萄糖、多巴胺、去甲肾上腺素、尿酸、亚硝酸盐、抗坏血酸、氨基酸、苹果酸、苯磷二酚等)的电化学检测信号。
Willner等通过印迹金纳米颗粒复合材料的交联聚合来提高对TNT 的检测灵敏度,此过程是TNT 和π-供体修饰电极之间的相互作用或者π-供体交联金纳米颗粒共轭到电极上,通过金电极上聚苯胺单元的桥接、金纳米颗粒的电化学聚集检测TNT,检测限是2 nmol·L-1。Kannan等[9]利用1,6-己二硫醇连接的金纳米颗粒和溶胶-凝胶修饰的电极,对尿酸进行了电催化检测,检测限是1μmol·L-1。之后又通过羟胺增大金纳米颗粒粒径来提高其电催化活性,将2,5-二巯基-1,3,4-噻二唑(DMT)修饰到金电极上,通过共价键连接扩大沉积面积的金纳米颗粒来检测尿酸的电催化活性,发现尿酸的氧化电位转移到一个较小的正电位,而且其峰值电流增大,检测限增加3倍多。
Wang等[10]用二硫苏糖醇(DTT)、硫醇(DDT)和胶体金纳米颗粒自组装的混合单层膜修饰的金电极(图2)对肾上腺素进行电催化活性检测,发现该电极具有极高的灵敏度和快速响应性,其检测限是60 nmol·L-1。
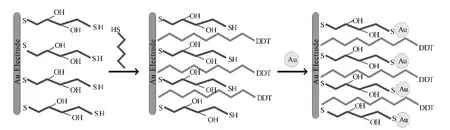
图2 DTT、DDT与AuNPs自组装修饰金电极Fig.2 Au Electrode modified by self-assembly of DTT,DDT and AuNPs
Liu等[11]将乙二胺连接金纳米颗粒的电催化单层固定到预先处理好的玻碳电极上,对亚硝酸盐进行电催化活性检测,发现该电极表现出灵敏的电化学响应。这是因为,金纳米颗粒的尺寸效应提供了一个较大的活性表面,其检测限是45μmol·L-1(S/N=3),线性范围是1.3×10-4~4.4×10-2mol·L-1。该法已用于实际样品中亚硝酸盐的检测。Xiao等[12]构建了一种基于金纳米颗粒的生物电催化系统(图3),用于提高葡萄糖的检测,该系统在葡萄糖氧化酶(GOx)和电极之间存在着高效的电子转移。

图3 基于金纳米颗粒的生物电催化系统Fig.3 Biological eletrocatalytic system based on gold nanoparticles
具体过程是:1.4nm 的金纳米颗粒被黄素腺嘌呤二核苷酸(FAD)修饰,然后FAD 修饰金纳米颗粒上的载脂蛋白葡萄糖氧化酶(apo-GOx)和巯基化单层相连的金电极进行重组,相对于功能化的金纳米颗粒首先组装到金电极上,随后和apo-GOx 重组。结果表明,金纳米颗粒促进了酶的氧化还原中心和电极之间快速的电子转移,电子转移率约为5 000s-1。
2.2 用于重金属离子/非金属有毒物质的检测
重金属离子/非金属有毒物质对环境和人类健康的危害已引起广泛关注,因此,建立高效、灵敏、快捷、选择性好的检测方法具有十分重要的意义。有人对肼做了电解氧化,发现金纳米颗粒修饰电极对肼表现出了极高的催化活性。Raj建立了一个对肼超灵敏的电化学检测方法,具体过程是:用金纳米颗粒自组装到溶胶-凝胶衍生的三维硅酸盐网络中,构建修饰金电极,发现在没有氧化还原介质的情况下,相对于金电极,修饰金电极的过电位(约800 mV)显著降低,峰电流明显增大。该纳米结构的电化学平台表现出极好的灵敏度,检测限达到200pmol·L-1。
Ciftci等[13]报道了一种用于铜离子检测的电化学传感器(图4)。具体过程是:用壳聚糖(Ch)包覆的金纳米颗粒(Ch/AuNPs)修饰玻碳电极,以微分脉冲伏安法(DPV)测定电催化性能。由于金纳米颗粒的特性,Ch/AuNPs所修饰的电极具有高的催化活性和大的比表面积,相对于未修饰的玻碳电极(GCE)和壳聚糖修饰的玻碳电极(Ch/GCE),Ch/AuNPs所修饰电极的峰电流显著增大。在电流噪声比为3∶1时,检测限低至5×10-9mol·L-1,富集时间8min。
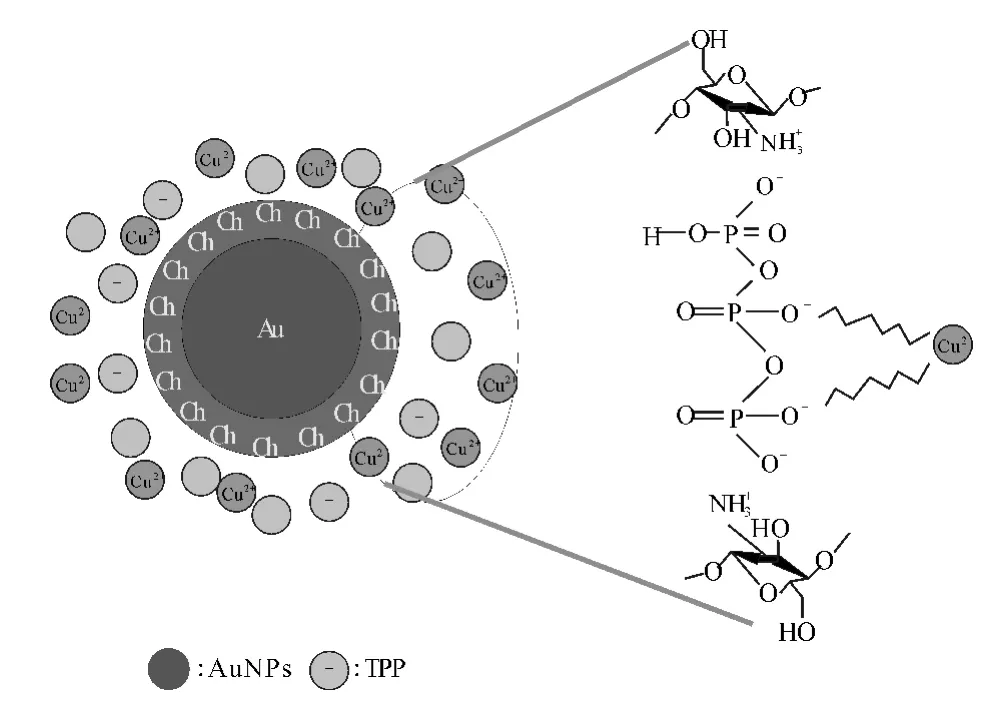
图4 用于铜离子检测的电化学传感器Fig.4 Electrochemical sensor for detection of Cu2+
Abollino 等[14]用金纳米颗粒修饰玻碳电极(AuNPs/GCE),通过阳极溶出伏安法(ASV)对汞离子进行检测,发现AuNPs/GCE 较固体金电极具有较低的检测限和较高的重复性。这是因为,沉积的金纳米颗粒具有大的比表面积,从而提高了检测灵敏度,同时金纳米颗粒解决了金层不可逆污染问题,减少了记忆效应。当汞离子浓度为0~50μg·L-1时,AuNPs/GCE 灵敏度为3.5μA·L·μg-1,而固体金电极(SGE)为1.71μA·L·μg-1,汞离子的最低检测限(LOD)是0.0015μg·L-1。
Dai等[15]报道了金纳米颗粒修饰玻碳电极对砷离子的检测,用线性伏安扫描法(LSV)所获得的检测限为0.0096×10-9。Lu等[16]研究了石墨烯、金纳米颗粒和壳聚糖修饰的玻碳电极(GR-AuNPs-CS/GCE)对铅离子的检测,在信噪比为3 的情况下,检测限达到
1ng·L-1。
2.3 用于癌细胞的检测
目前,癌细胞早期诊断技术成本高且时间长,因此有必要发展一种成本效益优化的技术,可以定性或定量地对癌细胞进行早期检测。最近,有研究者发展了一种检测特异性肿瘤细胞的电化学平台(图5)。具体过程是:细胞表面的分子通过抗体与金纳米颗粒共轭来识别,以氢的催化还原来提供对肿瘤细胞的检测。
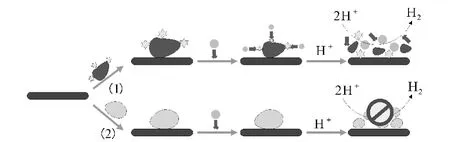
图5 肿瘤细胞的电化学检测平台Fig.5 Electrochemical detection platform for tumor cells
Selwyna等[17]开发了一种对乳腺癌监测的无标记的电化学免疫传感器,检测限是5~75 U·mL-1,它是基于CA 15-3在血清中的水准、癌细胞标记物与金纳米颗粒修饰的特异性抗体之间的相互作用对CA 15-3进行监测,金纳米颗粒较大的比表面积可以提高反应效率,较高的电导率可利用电化学阻抗谱(EIS)和恒电位仪为传感器提供检测信号,时刻反映病变状态。
Annie等[18]开发了一种基于ENO1 作为肺癌细胞诊断标记的电化学检测平台(图6)。具体过程是:以anti-ENO1单克隆抗体在聚乙二醇(PEG)修饰的一次性丝网印刷碳电极(SPCE)上的物理吸附作为电化学检测平台,以金纳米颗粒标记的第二多克隆anti-ENO1聚集作为电化学探针信号,对ENO1 进行检测,其检测限低至11.9fg。该传感器中金纳米颗粒的标记优于其它标记是因为:(1)提高了整个系统的电化学稳定性;(2)使整个系统的构造更简单、明确;(3)金纳米颗粒的生物相容性不妨碍其它生物分子的标记。
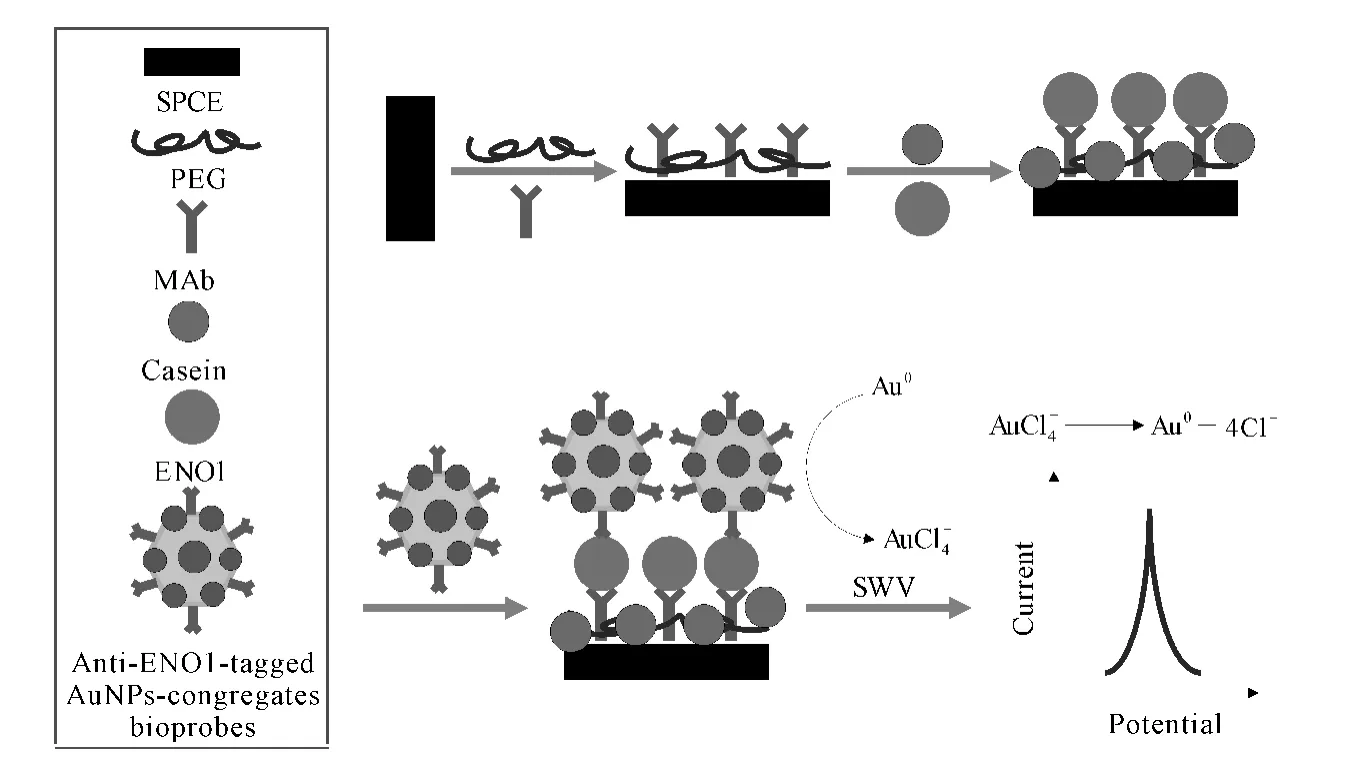
图6 肺癌细胞的电化学检测平台Fig.6 Electrochemical detection platform for lung cancer cells
金纳米颗粒也可用于其它癌细胞的检测。Yan等[19]报道了金纳米颗粒修饰血癌K562细胞的电化学行为,此过程金纳米颗粒促进了电极和细胞活性中心的电子转移。Du等[20]利用金纳米颗粒固定活的As-PC-1细胞(胰腺癌细胞)在电极表面,发现该电极表现出不可逆的伏安响应。
3 结语
金纳米颗粒优异的化学性能为电化学传感器的设计与研究提供了新策略。利用金纳米颗粒的生物相容性将生物分子固定在衬底上,可以提高生物传感器的稳定性。利用金纳米颗粒的催化性能,可以提高电化学传感器的灵敏度与选择性。此外,将金纳米颗粒扩展到其它功能性材料(如碳纳米管、碳纳米棒、碳纳米线等),再结合量子点、石墨烯等新型材料,可以增强传感器界面的光电响应,提高检测限与检测范围,更好地应用于药物检测、环境检测、生命分析等各个领域。
[1]PARK J E,ATODE M,FUCHIGAMI T,et al.Synthesis of multiple shapes of gold nanoparticles with controlled sizes in aqueous solution using ultrasound[J].Ultrasonics Sonochemistry,2006,13(3):237-241.
[2]SUGANO K,YAMADA H,ICHIHASHI O,et al.Fabrication of gold nanoparticle using pulsed mixing method with valveless micropumps[C].19th IEEE International Conference on Micro Electro Mechanical Systems,2006:546-549.
[3]JIANG L,TANG Y X,LIOW C H,et al.Synthesis of fivefold stellate polyhedral gold nanoparticles with{110}-facetsviaa seedmediated growth method[J].Small,2013,9(5):705-710.
[4]LAHDE A,KOSHEVOY I,KARHUNEN T,et al.Aerosol-assis-ted synthesis of gold nanoparticles[J].Journal of Nanoparticle Research,2014,16:2716.
[5]万菁,陈敬华.肝素修饰金纳米粒子的制备及表征[J].中国组织工程研究与临床修复,2009,13(8):1521-1524.
[6]SCHOFIELD C L,HAINES A H,FIELD R A,et al.Silver and gold glyconanoparticles for colorimetric bioassays[J].Langmuir,2006,22(15):6707-6711.
[7]KONG T,ZENG J,YANG J,et al.Surface modifications of goldnanoparticles to enhance radiation cytotoxicity[C].2007IEEE/NTH Life Science Systems and Applications Workshop,2007:265-268.
[8]SAHA K,AGASTI S S,KIM C,et al.Gold nanoparticles in chemical and biological sensing[J].Chemical Reviews,2012,112(5):2739-2779.
[9]KANNAN P,JOHN S A.Determination of nanomolar uric and ascorbic acids using enlarged gold nanoparticles modified electrode[J].Analytical Biochemistry,2009,386(1):65-72.
[10]WANG L,BAI J Y,HUANG P F,et al.Self-assembly of gold nanoparticles for the voltammetric sensing of epinephrine[J].Electrochemistry Communications,2006,8(6):1035-1040.
[11]LIU Y,GU H Y.Amperometric detection of nitrite using a nanometer-sized gold colloid modified pretreated glassy carbon electrode[J].Microchimica Acta,2008,162(1-2):101-106.
[12]XIAO Y,PATOLSKY F,KATZ E,et al.“Plugging into Enzymes”:Nanowiring of redox enzymes by agold nanoparticle[J].Science,2003,299(5614):1877-1881.
[13]CIFTCI H,TAMER U,METIN A,et al.Electrochemical copper(Ⅱ)sensor based on chitosan covered gold nanoparticles[J].Journal of Applied Electrochemistry,2014,44(5):563-571.
[14]ABOLLINO O,GIACOMINO A,MALANDRINO M,et al.Determination of mercury by anodic stripping voltammetry with a gold nanoparticle-modified glassy carbon electrode[J].Electroanalysis,2008,20(1):75-83.
[15]DAI X,NEKRASSOVA O,HYDE M E,et al.Anodic stripping voltammetry of arsenic(Ⅲ)using gold nanoparticle-modified electrodes[J].Analytical Chemistry,2004,76(19):5924-5929.
[16]LU Z Z,YANG S L,YANG Q,et al.A glassy carbon electrode modified with graphene,gold nanoparticles and chitosan for ultrasensitive determination of lead(Ⅱ)[J].Microchimica Acta,2013,108(7-8):555-562.
[17]SELWYNA P G C,LOGANATHAN P R,BEGAM K H.Development of electrochemical biosensor for breast cancer detection using gold nanoparticle doped CA 15-3antibody and antigen interaction[C].2013International Conference on Signal Processing,Image Processing &Pattern Recognition,2013:75-81.
[18]ANNIE H J,CHANG H C,SHIH N Y,et al.Diagnostic detection of human lung cancer-associated antigen using agold nanoparticle-based electrochemical immunosensor [J].Analytical Chemistry,2010,82(14):5944-5950.
[19]YAN F,CHEN J,JU H X.Immobilization and electrochemical behavior of gold nanoparticles modified leukemia K562cells and application in drug sensitivity test[J].Electrochemistry Communications,2007,9(2):293-298.
[20]DU D,LIU S L,CHEN J,et al.Colloidal gold nanoparticle modified carbon paste interface for studies of tumor cell adhesion and viability[J].Biomaterials,2005,26(33):6487-6495.
