Ku70与hTERT在胃癌组织中的表达及其意义
2015-12-28,,,
, ,,
(1.南华大学附属第二医院病理科,湖南 衡阳 421001;2.南华大学附属第一医院病理科;3.南华大学附属第二医院妇产科;4.南华大学肿瘤研究所)
·基础医学·
Ku70与hTERT在胃癌组织中的表达及其意义
胡华1,阳帅2,周建斌3,梁晓秋4*
(1.南华大学附属第二医院病理科,湖南 衡阳 421001;2.南华大学附属第一医院病理科;3.南华大学附属第二医院妇产科;4.南华大学肿瘤研究所)
目的探讨Ku70和人端粒酶逆转录酶(hTERT)蛋白表达与胃癌发生发展的关系及两者之间的联系。方法应用免疫组织化学方法检测Ku70和hTERT蛋白在10例正常胃黏膜、15例胃癌前病变黏膜和20例胃癌组织中的表达。结果Ku70蛋白阳性表达定位于正常胃黏膜和胃癌组织的细胞核,胃癌前病变黏膜的细胞浆,其阳性表达率分别为90%、100%和80%;hTERT蛋白在正常胃黏膜几乎不表达,在胃癌前病变黏膜和胃癌组织中均定位于细胞浆,其阳性表达率分别为30%、100%和100%。胃癌组织中Ku70和hTERT蛋白的表达强度明显高于正常胃黏膜和胃癌前病变黏膜。Ku70和hTERT蛋白的表达显著相关。结论Ku70和hTERT蛋白可能与胃癌的发生发展过程相关。
Ku70; 胃癌; 免疫组织化学
人类Ku70蛋白由609个氨基酸组成,分子量约69 581 Da,其编码基因位于22q13。Ku70蛋白作为DNA依赖蛋白激酶(DNA-dependent protein kinase,DNA-PK)的调节亚单位,广泛参与了DNA双链断裂修复、V(D)J重组、细胞周期调控、基因表达调控、端粒长度和结构维持以及某些细胞信号转导过程。鉴于Ku70蛋白功能的多样性,其与恶性肿瘤发生发展的关系已引起重视。人端粒酶逆转录酶(Human telomerase reverse transcriptase,hTERT)是端粒酶的催化亚单位,可以直接反映端粒酶活性的高低,从而影响端粒功能,与恶性肿瘤的发生发展密切相关[1]。本文检测了Ku70与hTERT蛋白在正常胃黏膜、胃癌前病变黏膜和胃癌组织中的表达,以探讨两者与胃癌发生发展的关系。
1 材料与方法
1.1 材料
10例正常胃黏膜、15例胃癌前病变黏膜和20例胃癌组织均取自南华大学附属第一医院手术切除标本。20例胃癌均为腺癌;低分化12例,高中分化8例。所有患者术前均未接受化疗或放疗,病理组织类型根据《消化系统肿瘤WHO分类(第四版)》诊断标准分类[2]。
1.2 实验方法
每一石蜡块连续切片3张,厚度4 μm,一张常规HE染色,再次病理证实。另两张常规脱蜡水化,采用枸橼酸缓冲液煮沸法进行抗原修复后按SP试剂盒(购自福建迈新生物技术公司)说明书进行操作。第一抗体为:兔抗人Ku70多克隆抗体(购自Santa Cruz Biotechnology USA),工作浓度为1∶80;兔抗人hTERT多克隆抗体(购自Santa Cruz Biotechnology USA),工作浓度为1∶200,DAB显色,苏木素复染。
1.3 结果判定
以表达Ku70与hTERT的乳腺癌组织作阳性对照,用PBS代替一抗作阴性对照。由2个不同的病理医生阅片计分,取平均值。每张切片观测10个高倍镜视野,根据阳性细胞数及细胞染色强度进行半定量统计:无阳性细胞,计0分;阳性细胞数1%~25%,计1分;26%~50%计2分;51%~75%记3分;76%~100%记4分。再根据阳性着色强度依次计0、1、2、3分(不着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分),每张切片进行2项分数累计,0分为阴性(-),1~2分为弱阳性(+),3~4分为中阳性(++),5~7分为强阳性(+++)[3]。
1.4 统计方法
用SPSS13.0统计软件中的χ2检验或四格表确切概率检验对数据进行分析,以P<0.05为差异具有显著意义。
2 结 果
2.1 Ku70蛋白在正常胃黏膜、胃癌前病变黏膜和胃癌组织中的表达
正常胃黏膜Ku70蛋白定位于细胞核,阳性率90%(9/10),其中弱阳性占70%,中阳性占20%,无强阳性表达;胃癌前病变黏膜Ku70蛋白定位于细胞浆,阳性率80%(12/15),其中弱阳性占53.3%,中阳性占26.7%,无强阳性表达;胃癌组织Ku70蛋白定位于细胞核,阳性率100%(20/20),其中中阳性占5%,强阳性为95%。Ku70蛋白在这三种病变中的表达差异具有显著性(P<0.001,表1及图1)。
表1Ku70与hTERT蛋白在正常胃黏膜、胃癌前病变黏膜和胃癌组织中的表达(例,%)

组织分类nKu70表达-++++++hTERT表达-++++++正常胃黏膜101(10.0)7(70.0)2(20.0)0(0.0)7(70.0)2(20.0)1(10.0)0(0.0)胃癌前病变黏膜153(20.0)8(53.3)4(26.7)0(0.0)0(0.0)7(46.7)8(53.3)0(0.0)胃癌组织200(0.0)0(0.0)1(5.0)19(95.0)0(0.0)2(10.0)0(0.0)18(90.0)
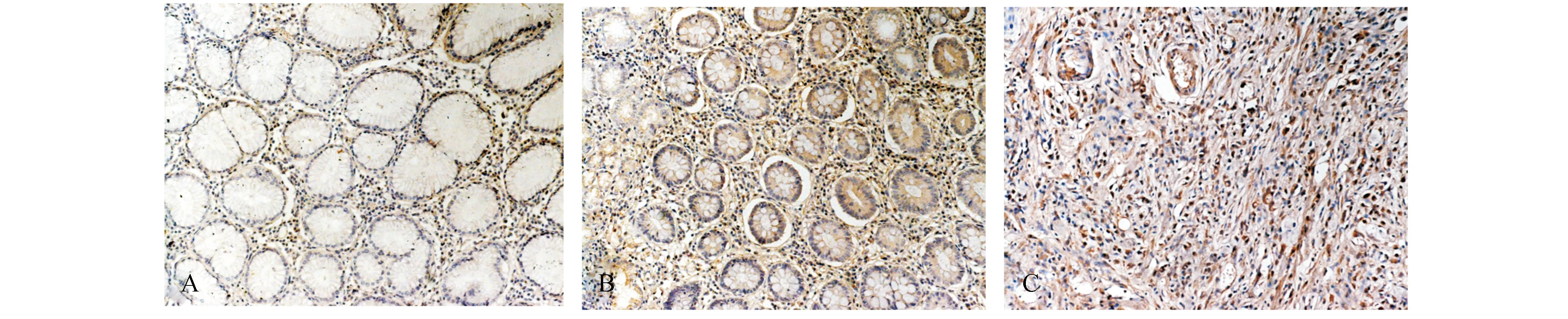
图1 Ku70蛋白在不同组织中的表达(SP 200×) A:正常胃黏膜;B:胃癌前病变黏膜;C:胃癌组织
2.2 hTERT蛋白在正常胃黏膜、胃癌前病变黏膜和胃癌组织中的表达
正常胃黏膜hTERT蛋白定位于细胞浆,阳性率30%(3/10),其中弱阳性占20%,中阳性占10%,无强阳性表达;胃癌前病变黏膜hTERT蛋白定位于细胞浆,阳性率100%(15/15),其中弱阳性占46.7%,中阳性占53.3%,无强阳性表达;胃癌组织hTERT蛋白定位于细胞浆,阳性率100%(20/20),其中弱阳性占10%,强阳性为90%。hTERT蛋白在这三种病变中的表达差异具有显著性(P<0.001,表1及图2)。
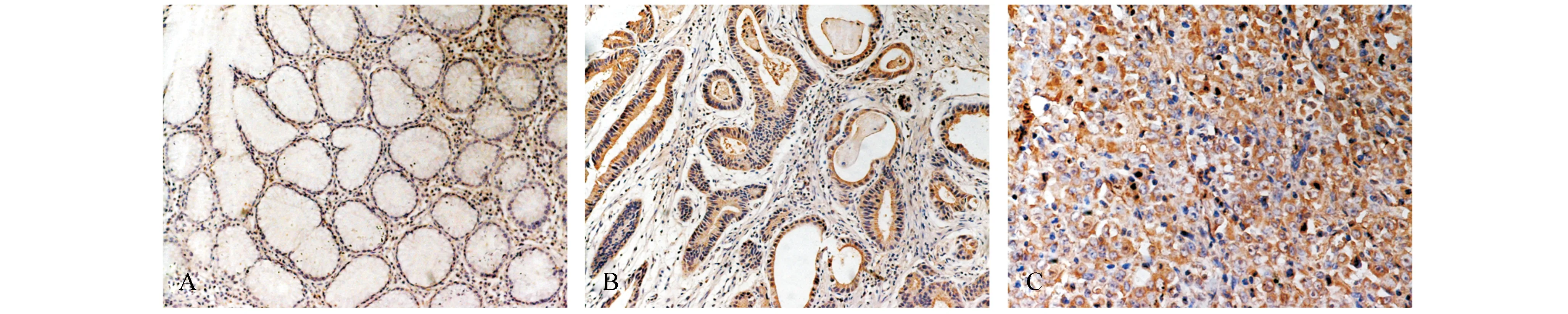
图2 hTERT蛋白在不同组织中的表达(SP 200×) A:正常胃黏膜;B:胃癌前病变黏膜;C:胃癌组织
2.3 胃癌中Ku70与hTERT蛋白表达之间的关系
胃癌中Ku70与hTERT蛋白表达高低具有一致性(P<0.001,表2)。
表2胃癌中Ku70与hTERT蛋白表达之间的关系

Ku70表达nhTERT表达(例,%)-~+++~+++-~+00(0.0)0(0.0)++~+++202(10.0)18(90.0)合计202(10.0)18(90.0)
3 讨 论
胃癌是消化道最常见的肿瘤,其发病率占全球恶性肿瘤的第4位,其致死率位于癌症相关死亡的第2位,严重威胁着人类的健康[4]。胃癌的发生发展是多因素影响、多阶段和多步骤的过程。在遗传和环境因子的作用下,经历了从正常胃黏膜向癌前病变、早期癌、浸润癌、转移癌的逐渐转变。在此转变过程中,基因组不稳定和端粒功能失常是其重要机制。
基因组稳定性的威胁主要来自各种内外因子引起的DNA双链断裂(DSBs)。DSBs修复包括同源重组(HR)和非同源DNA末端连接(NHEJ)两种,其中NHEJ是哺乳动物DSBs修复的主要方式,依赖于Ku蛋白的参与。在真核生物中,Ku是由70和80 kDa的两个亚单位构成的异二聚体,这两个亚单位分别被称作Ku70(在芽殖酵母中为Yku70和Hdf1)和Ku80(在芽殖酵母中为Yku80和Hdf2,在高等真核生物中称作Ku86)。Ku异二聚体与DNA-PKcs结合形成DNA-PK,参与DNA损伤修复活动,进而维持基因组的稳定[5]。
端粒是真核生物线性染色体末端的核酸—蛋白质复合体,其重要功能主要表现为保护染色体末端,以避免不正确的重组、融合和降解等改变。端粒功能的维持体现在对端粒长度和结构的调控上。端粒酶是一种逆转录酶由RNA、端粒酶逆转录酶(TERT)及相关蛋白组成,它以自身RNA为模板在逆转录酶的作用下合成端粒重复序列以维持端粒长度的稳定性,从而防止细胞在复制分裂时因端粒的丢失而发生复制性的衰老或死亡。根据大量的研究发现,在几乎所有的人类恶性肿瘤中均发现端粒酶的强阳性表达,而在正常组织中端粒酶则呈阴性。TERT被普遍认为是端粒酶的催化亚基,其表达水平与端粒酶活性水平成正比关系。
Ku缺陷的芽殖酵母对温度敏感,当其暴露于不适宜的生长温度时,细胞由于端粒缩短而死亡。在裂殖酵母,Ku缺陷可以使端粒缩短。人Ku缺陷引起端粒长度进行性缩短,导致染色体融合,使基因组不稳定的发生率增加。另外人Ku还可以与端粒酶的催化亚基结合。Ku也可以不依赖hTERT而与端粒酶RNA直接作用,从而维持端粒的完整性[7-8]。
Ku70与恶性肿瘤发生发展的关系已引起关注。有研究报道,在卵巢癌、前列腺癌、鼻咽癌中Ku70蛋白均呈高表达[8-10]。本研究发现,Ku70在正常胃黏膜、胃癌前病变和胃癌中都有不同程度的表达,但胃癌组织中Ku70的表达明显增强。Ku70蛋白的高表达可能是恶性肿瘤的共同特征。而且,Ku70在正常胃黏膜和胃癌中定位于细胞核,在胃癌前病变中则定位于细胞浆,提示Ku70蛋白的转位可能也参与了胃癌的形成,其机制有待进一步研究。与此同时,笔者发现胃癌组织中hTERT蛋白的表达强度明显高于正常胃黏膜和胃癌前病变黏膜,并且与Ku70蛋白的表达具有高度一致性,提示Ku70与hTERT密切相关,Ku70有可能促进了hTERT的表达进而影响端粒功能参与胃癌发生发展的过程。
尽管Ku70最初是在一些自身免疫性疾病患者血清中发现的,但其生物功能的多样性,决定了其在恶性肿瘤发生发展过程中的特殊作用。本文中Ku70通过端粒调控途径参与胃癌的形成,这有可能为胃癌的预防和治疗提供新的方向和作用靶点。
[1] Kovalenko NA,Zhdanov DD,Kovalenko TF.Possibilities and effects of telomerase activation[J].Mol Biol (Mosk),2013,47(4):544-557.
[2] 崔全才,孟宇宏,王鲁平.消化系统肿瘤WHO分类[M].4版.北京:人民卫生出版社,2012:56-70.
[3] Oh BK,Kim YJ,Park C,et al.Up-regulation of telomere-binding protins,TRF1,TRF2,and TIN2 is related to telomere shortening during humanmultistep hepatocarcinogenesis[J].Am J Pathol,2005,166(1):73-80.
[4] Jayavelu ND,Bar NS.Metabolomic studies of human gastric cancer[J].World J Gastroenterol,2014,20(25):8092-8101.
[5] Ju YJ,Lee KH,Park JE,et al.Decreased expression of DNA repair proteins Ku70 and Mre11 is associated with aging and may contribute to the cellular senescence[J].Exp Mol Med,2006,38(6):686-693.
[6] 何晋,陈晓彬,郑昭芬,等.C反应蛋白诱导外周血内皮祖细胞衰老及非诺贝特的保护作用[J].中国动脉硬化杂志,2012,20(1):42-46.
[7] Armstrong CA,Pearson SR,Amelina H,et al.Telomerase Activation after Recruitment in Fission Yeast[J].Curr Biol,2014,24(17):2006-2011.
[8] Kotsopoulos J,Prescott J,De Vivo I,et al.Telomere Length and Mortality Following a Diagnosis of Ovarian Cancer[J].Cancer Epidemiol Biomarkers Prev.2014 Aug 26.pii:cebp.0885.2014.[Epub ahead of print]
[9] 由卫芝,申爱方,张玲,等.卵巢上皮性肿瘤组织中DNA-PKcs、Ku70蛋白的表达变化及意义[J].山东医药,2013,53(7):46-48.
[10] 黄锦坤,吴文启,梁叶萍,等.Ku70蛋白在前列腺癌中表达的临床研究[J].现代泌尿生殖肿瘤杂志,2012,4(2):105-107.
ExpressionofKu70andhTERTinHumanGastricCancerandtheClinicalSignificance
HU Hua,YANG Shuai,ZHOU Jianbin,et al
(DepartmentofPathology,theSecondAffiliatedHospital,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo explore the relationship of Ku70 and hTERT protein expressions in the progression of human gastric carcinogenesis and their correlations.MethodsExpressions of Ku70 and hTERT protein in 10 normal gastric mucosa,15 precancerous lesions and 20 gastric cancers were examined by immunohistochemistry.ResultsKu70 was found in normal gastric mucosa with mild nuclear expression,in precancerous lesion with mild cytoplasmic expression and in GC with marked nuclear expression and its positive expression rates were 90%,80% and 100% respectively.hTERT was found in cytoplasm and its positive expression rates in normal gastric mucosa,precancerous lesion and gastric cancer were respectively 20%,100% and 100%.The staining densities of Ku70 and hTERT protein in gastric cancer tissues were significantly higher than that in normal gastric mucosa and precancerous lesions.There was a significant correlation between the expressions of Ku70 and hTERT.ConclusionKu70 and hTERT protein protein might play an important role in the progression of human gastric carcinogenesis.
Ku70; Gastric cancer; Immunohistochemistry
10.15972/j.cnki.43-1509/r.2015.01.008
2014-08-09;
2014-11-20
*通讯作者,E-mail:liangxiaoqiu368@aliyun.com.
R735.2
A
(此文编辑:蒋湘莲)
