阿利吉仑对大鼠肾纤维化TGF-β1/Smad信号通路的影响
2015-12-28,,,
,, ,
(1.南华大学护理学院,湖南 衡阳,421001;2.衡阳市中心医院;3.南华大学医学院)
·基础医学·
阿利吉仑对大鼠肾纤维化TGF-β1/Smad信号通路的影响
李健芝1,庾江东2,胡丽1,梁瑜3*
(1.南华大学护理学院,湖南 衡阳,421001;2.衡阳市中心医院;3.南华大学医学院)
目的探讨阿利吉仑对单侧输尿管梗阻大鼠肾间质纤维化的作用及机制。方法24只雌性SD大鼠随机分为3组,Sham组、UUO组及aliskiren组,除Sham组外,UUO组及aliskiren组均行左侧输尿管结扎术。aliskiren组术前1 d开始灌胃给药,阿利吉伦50 mg/(kg·d),每日1次,连续2周。术后第14天处死大鼠,留取梗阻侧肾组织行HE染色和Masson染色,光镜下观察各组大鼠肾组织病理变化,免疫组化和Western印迹检测肾组织TGF-β1、Smad2和Smad7蛋白表达水平。结果阿利吉仑可明显减轻大鼠肾间质炎性细胞浸润、纤维组织增生及肾小管扩张和萎缩。免疫组化和Western印迹结果均显示:与Sham组相比,UUO组TGF-β1、Smad2表达明显上升,而Smad7表达明显下降(均P<0.05);与UUO组相比,aliskiren组TGF-β1、Smad2表达明显下降,Smad7表达明显上升(均P<0.05)。结论TGF-β1/Smad信号通路与肾间质纤维化有关,阿利吉仑可抑制肾间质纤维化,其机制可能与下调TGF-β1、Smad2的表达和上调Smad7的表达有关。
TGF-β1; Smad2; Smad7; 纤维化; 阿利吉仑; 梗阻性肾病
肾间质纤维化是各种慢性肾脏疾病进展至终末期肾病的共同途径,与肾小球硬化相比,肾间质纤维化严重程度与肾功能的关系更为密切[1]。TGF -β/Smads信号通路参与了肾间质纤维化的进程[2]。目前,临床上在治疗慢性肾脏疾病时,主要围绕减少AngⅡ的生成及抑制其效应而首选ACEI或ARB保护肾功能。阿利吉仑是一种新型直接肾素抑制剂(direct renin inhibitor,DRI),主要通过抑制肾素的催化活性中心,从源头上阻断RAS的激活。因此,我们推测阿利吉仑能通过抑制TGF-β1/Smads通路发挥抗肾间质纤维化作用。本研究拟构建单侧输尿管梗阻(unilateral ureteral obstruction,UUO)大鼠模型,观察阿利吉仑对肾间质纤维化大鼠TGF-β1、Smad2、Smad7表达的影响,探讨阿利吉仑抑制肾间质纤维化的作用机制。
1 材料与方法
1.1 材料与试剂
4~6周龄清洁级健康雌性SD大鼠24只,体重220~250 g,购自南华大学试验动物部。BCA蛋白定量试剂盒,TGF-β1,Smad2,Smad7及GAPDH 兔抗鼠多克隆抗体,SABC免疫组织化学试剂盒,DAB显色剂,武汉博士德生物有限公司;PVDF膜,美国Pierce 公司;阿利吉仑,Novartis International AG,批号:0078-0486-15,规格:每片150 mg。
1.2 UUO模型建立及分组
24只大鼠随机分为3组:假手术组(Sham组)、模型组(UUO组)、阿利吉伦治疗组(aliskiren组),每组8只。UUO组及aliskiren组行左侧输尿管结扎术,Sham组只分离左侧输尿管,不结扎。aliskiren组大鼠从建立UUO模型前1d开始灌胃给药,阿利吉伦50 mg/( kg·d),每日1次,连续2周。Sham组、UUO组用等体积的生理盐水灌胃。各组均于术后14天处死,留取左侧肾标本,部分用10%中性甲醛固定,行常规病理及免疫组化检测,部分迅速保存于-80 ℃冰箱,备western blot检测用。
1.3 肾组织病理学检查
肾组织经固定、脱水、石蜡包埋、常规切片,厚度3 μm,行HE染色和Masson染色来评估肾小管间质损伤程度。对每张切片随机选择20个肾皮质视野,按文献[3]描述的方法进行半定量评分,肾小管间质病变按以下3个参数决定:蛋白管型和肾小管的扩张、坏死、萎缩;炎性细胞浸润;间质纤维化的程度。每个参数按0~3分评定(0=正常,1=轻度受损,2=中度受损,3=重度受损)。每个视野小管间质的评分为0~9分。每张切片由两位病理医生双盲法分别评分,取平均值。
1.4 免疫组织化学对TGF-β1,Smad2,Smad7的表达进行定位和半定量分析
采用SABC法,具体步骤参照SABC试剂盒说明。每张肾组织切片在400倍镜下随机选取5个面积相同的视野,摄取图像,应用Image-proplus图像分析系统对TGF-β1,Smad2,Smad7的结果进行自动分析,计算平均光密度值。
1.5 Western印迹检测TGF-β1,Smad2,Smad7的表达量
取-80 ℃保存的肾组织,加适量裂解液后匀浆,离心,取上清,BCA法测定蛋白浓度。取等量组织蛋白样本经10% SDS-PAGE胶电泳。湿转法电转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,加TGF-β1(1∶500)、Smad2(1∶500)、Smad7(1∶500)抗体,4 ℃孵育过夜。辣根过氧化物酶标记的二抗工作液(1∶2 000),室温孵育2 h,膜发光底物工作液(ECL)A和B两种试剂各取0.5 mL混合后显色1 min,置入暗匣中拿到暗房,显影1~5 min,定影1 min,冲洗,晾干,曝光,扫描蛋白条带。以GAPDH为内参照,采用Labwork4.0图像分析软件进行半定量分析。
1.6 统计学处理
采用SPSS 17.0 统计学软件进行分析,计量资料以表示,多样本均数比较采用单因素方差分析。P<0.05认为差异有统计学意义。
2 结 果
2.1 实验动物数量分析
实验共纳入24只SD大鼠,分为3组,UUO组和aliskiren组各死亡1只,其余30只进入结果分析。
2.2 一般情况观察
大鼠单侧输尿管切除后,UUO组和aliskiren组大鼠均有不同程度的精神萎靡、厌食、体重减轻、毛发杂乱等表现。aliskiren组的上述表现明显轻于UUO组。Sham组大鼠活动自如,精神状态、皮毛及食量均好,体重增加。
2.3 肾脏病理改变
光镜下假手术组肾脏肾小管结构正常,间质未见增宽,无炎性细胞浸润,小管基底膜光滑完整。模型组肾小管上皮细胞弥漫空泡变性,多数肾小管扩张、萎缩,多灶状炎性细胞浸润和肾间质纤维化。aliskiren组间质内炎性细胞呈小灶状浸润,少许上皮细胞肿胀,少许肾小管轻度扩张,肾间质未见明显纤维化(见图1A)。肾小管间质损伤指数半定量评分结果显示:与sham组相比,UUO组和aliskiren组分值明显升高,差异有统计学意义(P<0.05);与UUO组相比,aliskiren组分值明显降低,差异有统计学意义(P<0.05),见图1B。
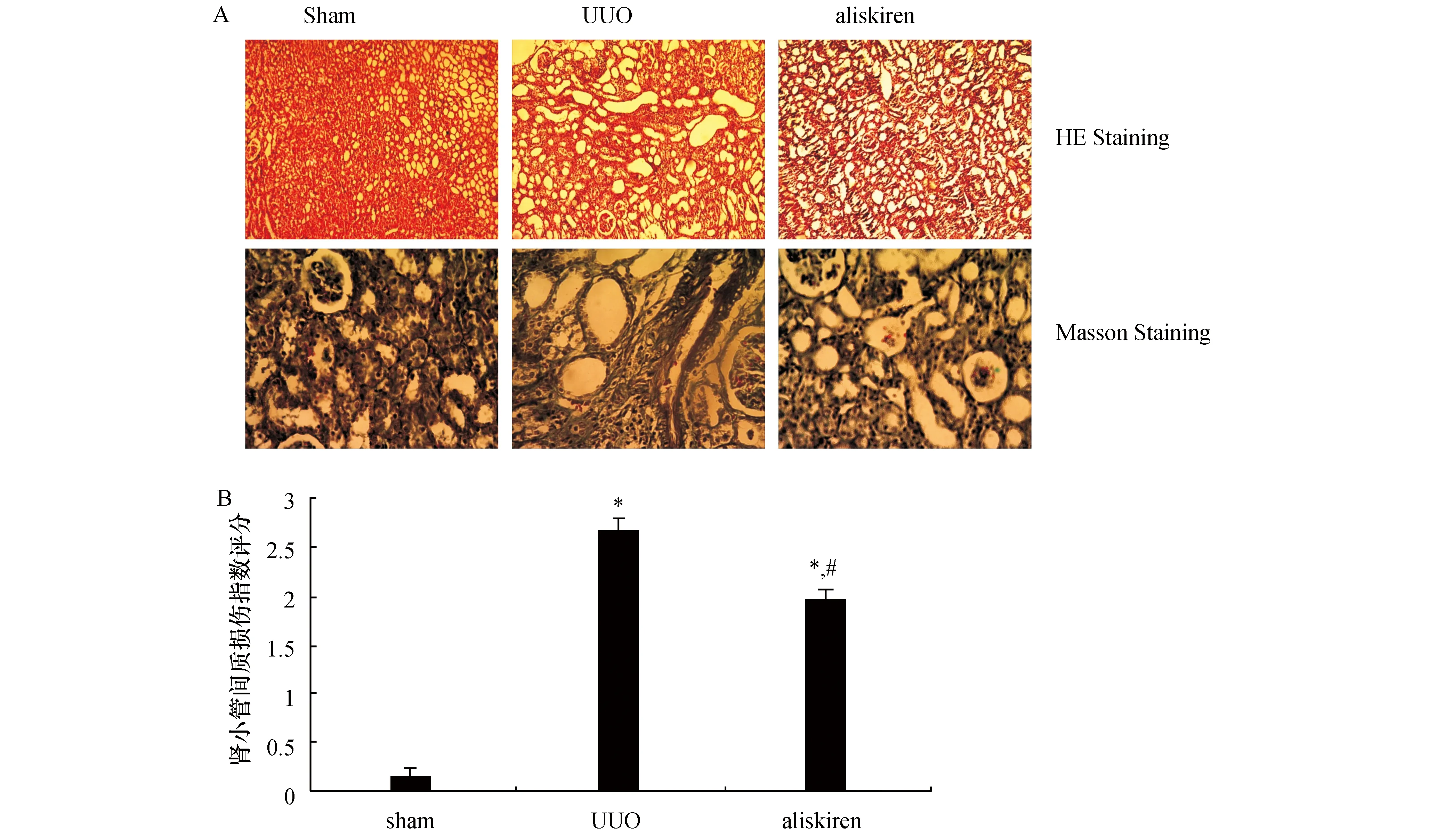
图1 各组大鼠肾组织病理改变 A:HE染色(100×)和Masson染色(400×);B:肾小管间质损伤指数半定量评分. 与Sham组比较,*:P<0.05;与UUO组比较,#:P<0.05
2.4 免疫组织化学对TGF-β1,Smad2,Smad7的表达进行定位和半定量分析结果
用兔抗鼠TGF-β1,Smad2,Smad7多克隆抗体作一抗,生物素标记的二抗对各组肾组织的TGF-β1,Smad2,Smad7蛋白表达进行检测。免疫组化结果显示,TGF-β1、Smad2和Smad7主要表达于皮髓交界的肾小管间质区以及肾小管上皮细胞,肾小球中未见明显表达(见图2A)。半定量分析结果显示:与Sham组相比,UUO组TGF-β1、Smad2表达明显上升,而Smad7表达明显下降,差异有统计学意义(均P<0.05)。与UUO组相比,aliskiren组TGF-β1、Smad2表达明显下降,Smad7表达明显上升,差异有统计学意义(均P<0.05),见图2B。
2.5 TGF-β1,Smad2,Smad7的表达
用兔抗鼠TGF-β1,Smad2,Smad7多克隆抗体作一抗,GAPDH为内参照,对各组肾组织的TGF-β1,Smad2,Smad7蛋白表达进行检测,结果用凝胶图像分析系统分析得出TGF-β1,Smad2,Smad7蛋白表达的相对吸光度。Western印迹结果显示:与Sham组相比,UUO组TGF-β1、Smad2表达明显上升,而Smad7表达明显下降,差异有统计学意义(均P<0.05)。与UUO组相比,aliskiren组TGF-β1、Smad2表达明显下降,Smad7表达明显上升,差异有统计学意义(均P<0.05)。各组TGF-β1、Smad2和Smad7蛋白表达趋势改变与免疫组化结果相似,见图3。
3 讨 论
肾间质纤维化关键的形态学改变是以ECM的过度沉积、成纤维细胞大量增生、小管萎缩及间质炎性细胞浸润为特征。其发生机制极其复杂,涉及多种细胞、细胞因子、细胞外间质及多个信号传导通路参与,受到多种因素的调节作用[4]。
转化生长因子β1是最重要的致9纤维化细胞因子,能促进ECM产生,抑制ECM降解,并诱导上皮细胞生长停滞及凋亡。如图2所示,TGF-β1广泛分布于皮髓交界的肾小管间质区以及肾小管上皮细胞,UUO组肾小管上皮及间质细胞中TGF-β1分泌明显活跃。Western blot结果进一步显示,UUO组TGF-β1表达明星升高,提示TGF-β1在UUO所致慢性肾间质纤维化的进程中具有重要的作用。
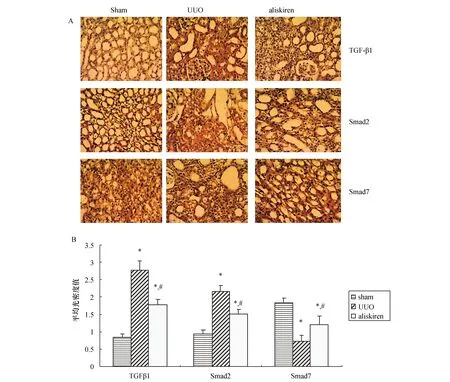
图2 各组大鼠肾组织TGF-β1、Smad2、Smad7的表达 A:免疫组化染色(400×);B:免疫组化半定量评分,与Sham组比较,*:P<0.05;与UUO组比较,#:P<0.05
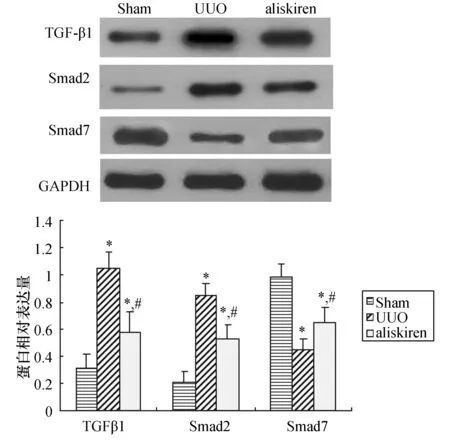
图3 各组大鼠肾组织TGF-β1、Smad2、Smad7的蛋白表达 与Sham组比较,*:P<0.05;与UUO组比较,#:P<0.05
TGF-β1主要通过Smad蛋白家族传递信号而发挥生物学效应。TGF-β1/Smads通路是肾纤维化发生中最关键的信号转导通路,也是器官纤维化发生中最重要的信号通路[5-6]。TGF-β1与Ⅱ型受体(TβRII)结合后,激活转化生长因子-Ⅰ型β受体(TβRI)激酶,导致Smad2和Smad3蛋白磷酸化,随后磷酸化Smad2和Smad3与Smad4结合,形成Smad2,3,4复合物,转移到细胞核内,调节靶基因的转录,包括Smad7。Smad7是抑制性Smad,Smad7与TβRⅠ蛋白结合,抑制活化的TβRⅠ对Smad2和Smad3的磷酸化[9],增加泛素介导的TβRⅠ自身的降解[10],从而阻抗TGF-β1的信号转导,抑制肾纤维化的发生及发展。
单侧输尿管梗阻是目前公认的导致肾间质纤维化病理学改变的经典模型,通过该模型可以有效地评价药物对肾间质纤维化的疗效[9]。从模型组大鼠的肾脏病理变化和肾小管间质损伤指数半定量评分结果来看,我们成功地复制了单侧输尿管梗阻模型。
肾素—血管紧张素—醛固酮系统(RAAS) 慢性持续激活是心血管疾病、肾脏病、糖尿病发生与发展的重要因素。RAAS中起主要作用的是血管紧张素Ⅱ(AngⅡ)。既往研究表明,ACEI或ARB 阻断RAAS会导致血浆肾素活性的代偿性增加和AngⅠ的蓄积,反过来激活RAAS,出现“血管紧张素Ⅱ逃逸”现象[10]。
阿利吉仑是一种新型DRI,主要通过抑制肾素的催化活性中心从源头上阻断RAS的激活。使用DRI不会增加AngⅠ的浓度,故无“AngⅡ逃逸”现象。DRI和醛固酮受体拮抗剂的作用以及多类药物联合治疗的效果虽越来越受到关注,但因临床数据尚不充分,有待更多、更大规模的临床试验的观察和证实。Feldman等[11]利用转基因大鼠(mRen-2)-27研究了阿利吉仑对糖尿病大鼠的作用,结果显示阿利吉仑不仅能够防止大鼠产生蛋白尿,而且可以抑制肾脏的TGF-β1和Ⅰ型胶原的表达,减少肾小球、肾小管以及皮质血管的肾素受体表达,从而产生肾脏保护作用。Kavvadas等[12]利用转基因大鼠研究了阿利吉仑对高血压肾病的作用,发现阿利吉仑不仅能降低血压,而且能减轻肾间质纤维化。为深入探讨其治疗作用的信号转导机制,本实验首先观察该药对大鼠单侧输尿管梗阻模型肾间质纤维化的防治作用。用阿利吉仑灌胃后,大鼠的一般情况改善,肾纤维化程度也较模型组显著减轻,提示阿利吉仑能有效防治肾纤维化。采用免疫组化和Western blot的方法检测了各组大鼠肾组织TGF-β1/Smads通路中的几个关键分子TGF-β1、Smad2和Smad7的蛋白表达水平。结果显示:模型组的TGF-β1、Smad2表达较假手术组显著升高,Smad7显著降低。阿利吉仑能明显下调TGF-β1、Smad2的表达,上调Smad7的表达,从而抑制TGF-β1/Smads信号通路,与国内研究结果一致[13-15]。
总之,阿利吉仑可能通过下调TGF-β1、Smad2的表达,上调Smad7的表达从而抑制促纤维化信号通路TGF-β1/Smads激活,发挥其抗肾纤维化作用。
[1] Tonelli M,Klarenbach SW,Lloyd AM,et al.Higher estimated glomerular filtration rates may be associated with increased risk of adverse outcomes,especially with concomitant proteinuria[J].Kidney Int,2011,80(12):1306-1314.
[2] Pan MM,Zhang MH,Ni HF,et al.Inhibition of TGF-β1/Smad signal pathway is involved in the effect of Cordyceps sinensis against renal fibrosis in 5/6 nephrectomy rats[J].Food Chem Toxicol,2013,58:487-494.
[3] Fine LG,Orphanides C,Norman JT.Progressive renal disease:the chronic hypoxia hyPotheses[J].Kidney Int,1998,53(Suppl 65):S574-578.
[4] Liu Y.Cellular and molecular mechanisms of renal fibrosis[J].Nat Rev Nephrol,2011,7(12):684-696.
[5] Liu SF,Chang SY,Lee TC,et al.Dioscorea alata attenuates renal interstitial cellular fibrosis by regulating Smad- and epithelial-mesenchymal transition signaling pathways[J].PLoS One,2012,7(11):e47482.
[6] Lan HY.Diverse roles of TGF-β/Smads in renal fibrosis and inflammation[J].Int J Biol Sci,2011,7(7):1056-1067.
[7] Kavsak P,Rasmussen RK,Causing CG,et al.Smad7 binds to Smurf2 to form an E3 ubiquitin ligase that targets the TGF beta receptor for degrada-tion[J].Mol Cell,2000,6:1365-1375.
[8] Ebisawa T,Fukuchi M,Murakami G,et al.Smurf1 interacts with transforming growth factor-beta type I receptor through Smad7 and induces receptor degradation[J].J Biol Chem,2001,276:12477-12480.
[9] Chevalier RL,Forbes MS,Thornhill BA.Ureteral obstruction as a model of renal interstitial brosis and obstructive nephropathy[J].Kidney Int,2009,75(11):1145-1152.
[10] Sica DA.Combination angiotensin converting enzyme inhibitor and angiotensin receptor blocker therapy:its role in clinical practice[J].J Clin Hypertens,2003,5( 6):414-420.
[11] Feldman DL,Jin L,Xuan H,et al.Effects of aliskiren on blood pressure,albuminuria,and (pro)rennin receptor expression in diabetic TG (mRen-2) 27 rats [J].Hypertension,2008,52(1):130-136.
[12] Kavvadas P,Weis L,Abed AB,et al.Renin inhibition reverses renal disease in transgenic mice by shifting the balance between profibrotic and antifibrotic agents[J].Hypertension,2013,61(4):901-907.
[13] 刘咏梅,刘瑞华,刘文军,等.益气活血方对肾间质纤维化大鼠肾脏TGF-β/Smad信号通路及结缔组织生长因子的影响[J].中西医结合学报,2012,8(12):1165-1172.
[14] 刘煜敏,张悦,何立群,等.抗纤灵方对单侧输尿管梗阻大鼠TGF-β1-Smad通路的影响[J].中国病理生理杂志,2008,24(12):2423-2427.
[15] Pan MM,Zhang MH,Ni HF,et al.Inhibition of TGF-β1/Smad signal pathway is involved in the effect of Cordyceps sinensis against renal fibrosis in 5/6 nephrectomy rats[J].Food Chem Toxicol,2013,58:487-494.
EffectsofAliskirenonRatRenalInterstitialFibrosisTGF-β1/SmadSignalPathway
LI Jianzhi,YU Jiangdong,HU Li,et al
(NursingSchool,UniversityofSouthChina,Hengyang,Hunan,421001)
ObjectiveTo investigate the mechanism of aliskiren on renal interstitial fibrosis in rats exerted unilateral ureteral obstruction.Methods24 female Sprague-Dawley (SD) rats were randomly divided into 3 groups:Sham-operated group(Sham),UUO group (UUO) and aliskiren treated group(aliskiren).Except for Sham group,the UUO and aliskiren group underwent left ureteral ligation.Rats in aliskiren group were performed with intragastric administration of aliskiren (50mg/ kg·d) at 1 day before surgery,once per day and lasted for 2 weeks.All rats were sacrificed at 14 days after surgery.The pathological changes of the obstruction renal tissues were examined by HE and Masson staining.Immunohistochemistry and Western blot were applied to detect the protein expression of TGF-β1,Smad2 and Smad7.ResultsAliskiren could significantly reduce inflammatory cell infiltration,fibroplasia,the expansion and atrophy of the tubular.Compared with Sham group,the protein expression of TGF-β1 and Smad2 was increased significantly,but Smad7was decreased significantly in UUO group(allP<0.05).Compared with UUO group,the protein expression of TGF-β1 and Smad2 was decreased significantly,Smad7 was increased significantly in aliskiren group(allP<0.05).ConclusionAliskiren could relieve the renal interstitial fibrosis and fibrosis,and the mechanism of effects may be related to its down regulation TGF-β1,Smad2 and up regulation Smad7.
TGF-β1; Smad2; Smad7; Fibrosis; Aliskiren; Obstructive nephropathy
10.15972/j.cnki.43-1509/r.2015.01.006
2014-07-28;
2014-10-22
衡阳市科学技术局(2013KS34).
*通讯作者,E-mail:nhliangyu@163.com.
R692
A
(此文编辑:秦旭平)
