胃癌中葡萄糖调节蛋白78的表达及其临床病理学意义
2015-12-28,,,,,
,,,,,
(1.南华大学医学院2009级临床医学专业临改1班,湖南 衡阳 421001;2.南华大学医学院组织胚胎学教研室)
·基础医学·
胃癌中葡萄糖调节蛋白78的表达及其临床病理学意义
贺正希1,唐慧岚1,陈景飞1,陈文琳1,蒋炜峥1,谢远杰2*
(1.南华大学医学院2009级临床医学专业临改1班,湖南 衡阳 421001;2.南华大学医学院组织胚胎学教研室)
目的检测葡萄糖调节蛋白78(GRP78)在胃癌组织中的表达,分析其临床病理学意义,探讨GRP78在胃癌发生发展中的作用。方法收集48例不同临床分期及不同分化程度胃腺癌及28例癌旁正常胃黏膜组织标本,分别应用RT-PCR、Western Blotting和免疫组化检测GRP78 mRNA和蛋白质的表达。结果与正常胃黏膜组织相比,胃癌组织中GRP78 mRNA及蛋白表达水平显著增加(P<0.05)。免疫组化检测GRP78阳性表达定位于胞浆,在正常胃粘膜组织中GRP78阳性表达率为10.7%(3/28),高、中分化与低分化胃癌组织阳性表达率分别为59.4%(19/32)和93.8%(15/16);直径≥5 cm的胃癌组织中GRP78阳性表达率(88.9%,16/18)高于直径<5 cm的胃癌组织(60%,18/30),Ⅲ、Ⅳ期(TNM分期)病例胃癌组织中GRP78阳性表达率(90.5%,19/21)高于Ⅰ、Ⅱ期病例(55.6%,15/27);5年内病情复发或者死亡病例胃癌组织中GRP78阳性表达率(82.8%,24/29)高于5年内病情无复发病例(52.6%,10/19);淋巴结转移胃癌组织中GRP78阳性表达率(96.2%,25/26)明显高于非淋巴结转移胃癌组织(40.9%,9/22),各组间差异均具有统计学意义(P<0.05)。结论GRP78在胃癌组织中高表达,其表达水平与胃癌肿瘤大小、分化程度、淋巴结转移、临床分期及预后密切相关。
胃癌; 葡萄糖调节蛋白78; 分化; 淋巴结转移; 临床分期
葡萄糖调节蛋白78(Glucose regulatory protein 78 KD,GRP78)是葡萄糖调节蛋白家族的重要成员,又称为免疫球蛋白重链结合蛋白,它作为一种分子伴侣参与蛋白质的折叠和转运,是正常状态下促进蛋白质成熟、调节细胞机能的重要物质。细胞在低氧等条件下发生内质网应激,诱导GRP78大量表达,因此GRP78蛋白成为内质网应激的标志性蛋白质。近来研究发现在肝癌[1]、胃癌[2]、乳腺癌[3]等多种肿瘤细胞中GRP78表达增高,表明GRP78的表达可能与肿瘤发生、发展有关,但具体作用机制尚未阐明,而且目前关于GRP78在胃癌组织中表达的临床病理意义存在分歧[4-6]。本研究通过RT-PCR、免疫组化和Western blotting等方法分别检测GRP78 mRNA和蛋白质在胃癌组织中的表达,分析其临床病理学意义,初步探讨GRP78表达与胃癌的关系,为进一步研究GRP78在胃癌发生、发展中的作用及其机制奠定基础。
1 材料与方法
1.1 组织标本和主要试剂
收集2011年10月~2013年10月南华大学附属第一医院行胃癌根治术后并建立电话随访的48例病例标本(一般病理特征见表1),癌旁正常胃黏膜组织28例(癌旁5 cm以上),其中高、中分化胃癌32例,低分化胃癌16例;伴淋巴结转移胃癌组织26例。手术标本取材后立即放入液氮罐保存,每例组织标本各取一部分经甲醛固定,制成石蜡切片,组织标本其余部分分别用于提取蛋白质和RNA。所有病例均经过病理学诊断证实,且术前均未接受放化疗。蛋白裂解液、BCA蛋白质定量试剂盒、蛋白marker、SP免疫组化试剂盒及DAB显色试剂盒购自北京中杉金桥生物技术公司。一步法RT-PCR试剂盒和DNA marker购自碧云天生物技术公司。PVDF膜购自Millipore,GRP78兔抗人多克隆抗体、兔抗人β-actin单抗购自博士德生物技术公司;DEPC水和Trizol购自Invitrogen,GRP78、β-actin引物由上海华美生物工程公司合成。
1.2 RT-PCR检测胃癌组织中GRP78 mRNA的表达
取保存在液氮中各组胃组织标本,每例100 mg,采用Trizol-氯仿抽提总RNA,按RT-PCR试剂盒(Takara公司)说明合成cDNA,以cDNA为模板进行PCR扩增,GRP78 Primer:fwd(5′-GCACCACCTACTCGTGCGTT-3′)rev(5′-ACCCAGGTGAGTATCTCCGTTAG-3′),扩增片段长度为656 bp,PCR反应条件是:94 ℃ 4 min;94 ℃变性30 s,58 ℃退火60 s,70 ℃延伸2 min,36个循环;70 ℃延伸6 min。β-actin Primer:fwd(5′-TGAGACCTTCAACACGCCG-3′) rev (5′-ATGGTGATGACCTGCCCGTC-3′),扩增片段长度为378 bp,PCR反应条件是:94 ℃ 4 min;94 ℃变性45 s,56 ℃退火60 s,72 ℃延伸1.5 min,36个循环;72 ℃延伸8 min。反应后各取终产物10 μL经1.2%琼脂糖凝胶电泳后,用凝胶成像分析系统观察、分析实验结果,分别测出各组胃组织中GRP78及β-actin的积分吸光度(A)值,计算两者的比值,以此比值作为各组胃组织中GRP78 mRNA的相对表达量。
1.3 Western blotting检测胃癌组织中GRP78蛋白的表达
提取各组胃组织标本的总蛋白,BCA法测定蛋白浓度,样品和上样缓冲液以4∶1混合,SDS-PAGE电泳后,经半干转膜仪转到PVDF膜上,脱脂奶粉封闭1 h,分别加入GRP78兔抗人多克隆抗体(1∶300)和β-actin抗体(1∶1 000),37 ℃孵育2 h,HRP标记Ⅱ抗孵育1 h,TBST洗脱3次,ECL化学发光显影,采用Quantity One软件测定各条带的吸光度值,分别以各条带与β-actin(内参照)吸光度的比值表示各组GRP78蛋白的相对含量。
1.4 SP免疫组化检测胃癌组织中GRP78蛋白的表达
石蜡切片常规脱蜡至水,免疫组化操作步骤按试剂盒说明进行。3%H2O2孵育10 min以阻断内源性过氧化物酶,10%枸橼酸盐缓冲液热修复抗原,PBS洗后正常羊血清封闭30 min,滴加1∶80 GRP78兔抗人多克隆抗体,4 ℃孵育过夜,PBS清洗3 min×3次,滴加生物素化的羊抗兔Ⅱ抗,37 ℃孵育30 min,PBS清洗5 min×3次,经DAB显色,镜下控制显色时间,苏木精复染,脱水,中性树胶封片,阴性对照以PBS代替I抗,每张切片至少随机观察5个高倍视野,按照阳性细胞所占比例记分:≤5%为0分;6%~24%为1分;25%~50%为2分;>50%为3分。同时根据染色强度记分为:无黄色为0分;淡黄色为1分;黄色或深黄色为2分;褐色或深褐色为3分。两项指标的积分相加结果:≤1分为阴性,>2分为阳性。
1.5 统计学处理
采用SPSS 13.0统计学软件处理各组数据。计量数据用均数±标准差表示,多组数据间的比较行单因素方差分析,计数资料用百分比(%)表示,样本率的比较行χ2检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 胃癌组织中GRP78 mRNA及其蛋白的表达
RT-PCR检测结果显示(图1),正常胃黏膜组织中GRP78 mRNA相对表达量(0.10±0.02)明显低于胃癌组织(0.97±0.10,P<0.05)。Western Blotting 检测结果显示(图2),GRP78蛋白在正常胃黏膜组织中相对含量(0.13±0.03)明显低于胃癌组织(0.87±0.08),差异有显著性(P<0.05)。
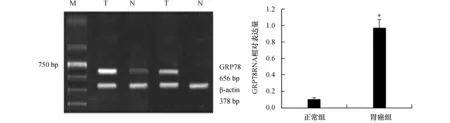
图1 RT-PCR检测胃组织中GRP78 mRNA表达水平 T:正常胃组织;N:胃癌组织 M:DNA marker;与正常组织比较,*P<0.05

图2 Western blotting 检测胃组织中GRP78蛋白表达水平 T:正常胃组织;N:胃癌组织;与正常组比较,*P<0.05
2.2 胃癌组织GRP78蛋白的免疫组化表达
GRP78阳性染色为棕黄色,位于胞浆(图3)。在正常胃粘膜组织中的阳性表达率10.7%(3/28),高、中分化与低分化胃癌组织阳性表达率分别为59.4%(19/32)和93.8%(15/16);在直径≥5 cm的胃癌组织中GRP78阳性表达率(88.9%,16/18)高于直径<5cm的胃癌组织(60%,18/30),TNM分期Ⅲ、Ⅳ期病例胃癌组织中GRP78阳性表达率(90.5%,19/21)高于Ⅰ、Ⅱ期病例(55.6%,15/27);5年内病情复发或者死亡病例胃癌组织中GRP78阳性表达率(82.8%,24/29)高于5年内病情无复发病例(52.6%,10/19);淋巴结转移胃癌组织中GRP78阳性表达率96.2%(25/26)明显高于非淋巴结转移胃癌组织40.9%(9/22),各组间差异均具有统计学意义(P<0.05)。胃癌组织中GRP78蛋白表达情况分析见表1。
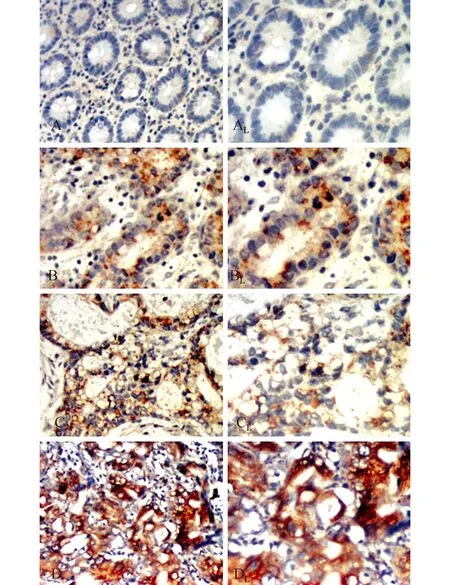
图3 免疫组化SP法检测GRP78在胃组织中的表达 A:正常胃组织;B:高分化胃癌组织;C:中分化胃癌组织;D:低分化胃癌组织 AL、BL、CL、DL(400×):分别为A、B、C、D(200×)的局部放大
3 讨 论
胃癌的发生、发展是遗传、环境、饮食及幽门螺杆菌(HP)感染等多因素共同作用的结果,但胃癌发生、发展的具体分子机制仍未明确[7]。肿瘤从根本上说属于基因病,探讨相关基因及其蛋白质在胃癌组织中的表达,分析其临床病理学意义,不仅为进一步研究相关基因在胃癌发生、发展中的作用提供实验基础,同时也有助于揭示胃癌发生、发展的分子机制。
近期研究表明,GRP78在人类多种肿瘤组织中高表达,而且其表达水平与肿瘤的恶性程度、转移能力及细胞凋亡有关,抑制ERK通路能阻断GRP78上调表达,从而促进内质网应激诱导的胃癌细胞凋亡[8]。GRP78的高表达与肿瘤内皮细胞的耐药有关[9],并且对血管生成也有一定的促进作用[10]。虽然目前关于GRP78是通过何种机制参与肿瘤的发生发展尚未完全明确,但其在多种肿瘤的高表达足以说明GRP78蛋白在肿瘤的发生、发展中扮演重要角色。因此,GRP78蛋白可能成为判断肿瘤细胞分化程度和临床分期的有价值的分子标记物[11]。
表1胃癌组织中GRP78蛋白表达与临床病理特征分析
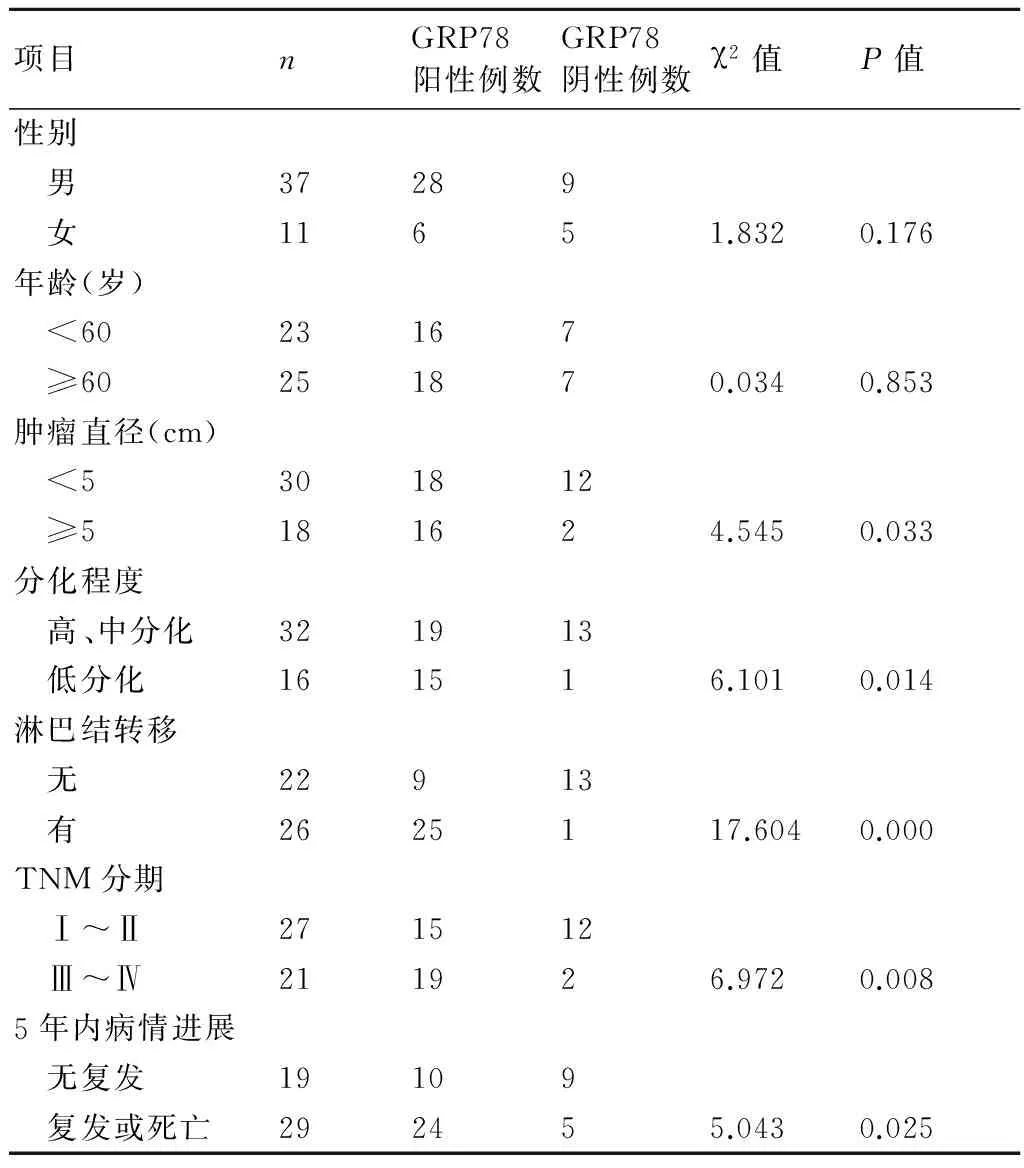
项目nGRP78阳性例数GRP78阴性例数χ2值P值性别 男37289 女11651.8320.176年龄(岁) <6023167 ≥60251870.0340.853肿瘤直径(cm) <5301812 ≥5181624.5450.033分化程度 高、中分化321913 低分化161516.1010.014淋巴结转移 无22913 有2625117.6040.000TNM分期 Ⅰ~Ⅱ271512 Ⅲ~Ⅳ211926.9720.0085年内病情进展 无复发19109 复发或死亡292455.0430.025
多篇文献报道表明,在胃癌组织中GRP78表达明显高于正常胃黏膜组织[4-6,12-13],但目前关于GRP78在胃癌组织中表达的临床病理意义存在分歧,姚元春等[4]认为GRP78高表达与胃癌肿瘤的大小、浸润、转移、分期有关,但与胃癌的分化程度无关,而余先祥等[5]认为GRP78高表达仅与胃癌的分化程度有密切关系,而与胃癌肿瘤的大小、浸润、转移等无关。本实验研究结果显示,GRP78在胃癌手术标本中的表达显著高于正常组织,男性胃癌患者GRP78蛋白表达阳性率稍高于女性,<60岁胃癌患者稍高于≥60岁患者,但差异无统计学意义,表明GRP78蛋白表达与胃癌患者年龄及性别无关。但本实验研究结果还显示,不同分化程度的胃癌组织中GRP78表达的水平不同,低分化胃癌组织中GRP78表达阳性率明显高于中、高分化胃癌,且低分化癌多呈强阳性表达,而在高、中分化癌中多呈弱阳性或阳性表达(图3)。肿瘤直径≥5 cm的胃癌组织中GRP78蛋白质表达阳性率明显高于肿瘤直径<5 cm的胃癌组织,淋巴结转移胃癌组织中GRP78表达阳性率明显高于无淋巴结转移的胃癌组织,Ⅲ、Ⅳ期患者胃癌组织中GRP78表达阳性率明显高于Ⅰ、Ⅱ期患者,表明GRP78蛋白质表达不仅与胃癌细胞分化程度有关,而且与肿瘤体积大小、淋巴结转移及临床分期密切相关。组织缺氧容易导致内质网应激,诱导GRP78的产生。由于肿瘤组织内本身存在缺氧、低糖的状况,而随着胃癌细胞恶性生长,肿瘤体积越大,肿瘤组织内缺氧、应激更明显,从而导致GRP78表达越高。淋巴结转移胃癌组织中GRP78表达阳性率明显高于无淋巴结转移的胃癌组织,提示GRP78可能具有促进胃癌淋巴结转移的作用,然而关于GRP78促进胃癌淋巴结转移的分子机制尚未明确。由于临床分期与胃癌肿瘤大小及淋巴结转移密切相关,因此不难理解Ⅲ、Ⅳ期患者胃癌组织中GRP78表达阳性率明显高于Ⅰ、Ⅱ期患者。本研究显示,根治术后5年内无复发的患者胃癌组织中GRP78表达阳性率明显低于5年内复发或死亡的患者,表明GRP78蛋白质表达与患者预后密切相关。进一步研究GRP78蛋白在胃癌发生、发展过程中的作用机制,有助于揭示胃癌发病的分子机制,为抑制GRP78基因表达作为胃癌防治的新靶点提供实验依据。
[1] Jiang X,Kanda T,Nakamoto S,et al.Involvement of androgen receptor and glucose-regulated protein 78 kDa in human hepatocarcinogenesis[J].Exp Cell Res,2014,323(2):326-336.
[2] Yang L,Yang S,Liu J,et al.Expression of GRP78 predicts taxane-based therapeutic resistance and recurrence of human gastric cancer[J].Exp Mol Pathol,2014,96(2):235-241.
[3] Heng YZ,Cao ZG,Hu X,et al.The endoplasmic reticulum stress markers GRP78 and CHOP predict disease-free survival and responsiveness to chemotherapy in breast cancer[J].Breast Cancer Res Treat,2014,145(2):349-358.
[4] 姚元春,张红,赖丽琴.GRP78、GRP94 蛋白和mRNA 在人胃癌组织中的表达及临床意义[J].安徽医科大学学报,2013,48(2):152-155.
[5] 余先祥,谢本俊,张林杰.胃癌组织中GRP78的表达与临床病理特征的相关性分析[J].安徽医科大学学报,2012,47(6):681-683.
[6] Yang L,Yang SY,Ji JM,et al.GRP78 expression in gastric cancer and its clinical significance[J].Zhong hua Zhong Liu Za Zhi,2013,35(11):837-842.
[7] Grabsch HI,Tan P.Gastric cancer pathology and underlying molecular mechanisms[J].Dig Surg,2013,30(2):150-158.
[8] Zhang LJ,Chen S,Wu P,et al.Inhibition of MEK blocks GRP78 up-regulation and enhances apoptosis induced by ER stress in gastric cancer cells[J].Cancer Lett,2009,274(1):40-46.
[9] Visioli F,Wang Y,Alam GN,et al.Glucose-regulated protein 78 (Grp78) confers chemoresistance to tumor endothelial cells under acidic stress[J].PLoS One,2014,9(6):e101053.
[10] Dong D,Stapleton C,Luo B,et al.A critical role for GRP78/BiP in the tumor microenvironment for neovascularization during tumor growth and metastasis[J].Cancer Res,2011,71(8):2848-2857.
[11] Thornton M,Aslam MA,Tweedle EM,et al.The unfolded protein response regulator GRP78 is a novel predictive biomarker in colorectal cancer[J].Int J Cancer,2013,133(6):1408-1418.
[12] Bai Z,Ye Y,Liang B,et al.Proteomics-based identification of a group of apoptosis-related proteins and biomarkers in gastric cancer[J].Int J Oncol,2011,38(2):375-383.
[13] Wu JY,Cheng CC,Wang JY,et al.Discovery of tumor markers for gastric cancer by proteomics[J].PLoS One,2014,9(1):e84158.
TheExpressionandClinicalPathologicalSignificancesofGRP78inHumanGastricCancerTissues
HE Zhengxi,TANG Huilan,CHEN Jingfei,et al
(ClassOneforClinicalMedicalReforminGrade2009ofMedicalSchool,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo explore the role of GRP78 in the development of gastric carcinoma by analysis of the expression of GRP78 in gastric carcinoma tissue.Methods48 cases of human gastric carcinoma tissue with different clinical period and differentiation degree and 28 cases of normal gastric tissue were selected.The mRNA and protein of GRP78 were detected by RT-PCR,Western blotting and immunohistochemistry,respectively.ResultsCompared with normal gastric epithelial tissue,the expression of GRP78 at mRNA and protein level in gastric carcinoma tissue increased significantly,which were showed by RT-PCR and Western Blotting(P<0.05).GRP78 protein was mainly distributed in cytoplasm showed by immunohistochemistry.The positive rate of GRP78 in normal gastric tissue,well or moderately-differentiated and poorly-differentiated gastric cancer tissue were 10.7% (3/28),59.4% (19/32) and 93.8% (15/16),respectively.The positive rate of GRP78 in gastric carcinoma tissue with diameter ≥5 cm was 88.9%(16/18),at Ⅲ,Ⅳ period in TNM staging was 90.5% (19/21),and with recurrence or death less than 5 years was 82.8% (24/29),which were higher than that with diameter < 5 cm(60%,18/30),at Ⅰ,Ⅱ period (55.6%,15/27),and with relapse-free in five years(52.6%,10/19),respectively.The positive rate of GRP78 in gastric carcinoma tissue with lymphatic metastasis was 96.2% (25/26),which was much higher than that of without lymphatic metastasis (40.9%,9/22).ConclusionThe expression of GRP78 in gastric cancer tissue increased,and GRP78 was involved in the development and progression of gastric cancer,which was highly related to tumor size,differentiation,lymph node metastasis,clinical stage and prognosis of gastric cancer.
gastric carcinoma; glucose regulatory protein 78 KD; differentiation; lymph node metastasis; clinical stage
10.15972/j.cnki.43-1509/r.2015.01.005
2014-08-06;
2014-11-20
本项目受2012年湖南省大学生研究性学习和创新性实验计划项目及2012年地方高校国家级大学生创新创业训练计划项目(201210555017)资助.
*通讯作者,E-mail:charlesking8888@163.com.
R735.2
A
(此文编辑:蒋湘莲)
