胡萝卜中类胡萝卜素的提取动力学
2015-12-27刘晓庚陈梅梅陈优生张雅坤胡唐明王立峰彭冬梅
刘晓庚,陈梅梅,陈优生,张雅坤,袁 磊,胡唐明,王立峰,彭冬梅
(1.南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏省粮油品质控制及深加工技术重点实验室,江苏 南京 210023;2.南京财经大学图书馆,江苏 南京 210023;3.广东食品药品职业学院,广东 广州 510520)
胡萝卜中类胡萝卜素的提取动力学
刘晓庚1,陈梅梅2,陈优生3,张雅坤1,袁 磊1,胡唐明2,王立峰1,彭冬梅1
(1.南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏省粮油品质控制及深加工技术重点实验室,江苏 南京 210023;2.南京财经大学图书馆,江苏 南京 210023;3.广东食品药品职业学院,广东 广州 510520)
使用抗坏血酸和2,6-二叔丁基-4-甲基苯酚保护剂,以石油醚-丙酮(体积比4∶1)混合液为提取剂,分别用水浴直接提取法、超声辅助提取法和微波辅助提取法从胡萝卜粉中提取类胡萝卜素。采用不同温度和原料粒度进行从胡萝卜粉中提取类胡萝卜素的提取动力学实验。结果表明,水浴法和超声辅助法是符合反应-内扩散控制的动力学模型,所得提取动力学方程分别为:1)水浴法:y=0.009 9t+0.110 7(R2=0.920 9,30 ℃)、y= 0.018 6t+ 0.096 1(R2=0.893 7,40 ℃)、y=0.018 2t+0.088 6(R2=0.965 7,45 ℃);2)超声辅助法:y=0.001 1t+0.080 9(R2= 0.917 9,30 ℃)、y=0.001 6t+0.043 9(R2=0.978 8,40 ℃)、y=0.001 8t+0.039(R2=0.964 2,45 ℃)。表观活化能分别为Ea(水浴)=-26.825 1 kJ/mol和Ea(超声)=-35.196 5 kJ/mol。而微波辅助法则是符合混合控制的动力学模型,其方程为y=0.027 5t+0.344 6(R2=0.972 3,30 ℃)、y=0.031 9t+0.426 5(R2=0.868 9,40 ℃)、y=0.058 7t+0.275 1(R2=0.973 4,45 ℃),表观活化能为Ea(微波)=-36.105 2 kJ/mol。通过水浴法考察原料粒度对提取动力学的影响,结果表明原料粒度对提取速率和提取率的影响程度是60~80 目>40~60 目>20~40 目,即粒度越细越有利于类胡萝卜素的提取。
胡萝卜粉;类胡萝卜素;提取方法;提取动力学;动力学方程;表观活化能
胡萝卜为富含类胡萝卜素的蔬菜,在我国近年来的胡萝卜生产出现了节节攀升,种植面积、产质和出口质均占全球的40%以上,居全球第一[1]。自然界中类胡萝卜素已发现600多种[2],β-胡萝卜素是VA的重要前体物质,食品中类胡萝卜素有抗氧化[3-4]、预防心血管疾病[5-6]、抗衰老[7-8]、抗癌[9-10]、保护视力[11]等功效,也会影响食品色泽、滋味和风味等品质[12]。类胡萝卜素已被联合国粮食及农业组织、世界卫生组织及联合国食品添加剂专家委员会认定为A类营养素,已在众多国家广泛应用于食品和医药等领域。
目前类胡萝卜素提取的报道仍以简便经济的溶剂提取法为主[13-14],而采用微波和超声辅助提取的效果更好[15-16],对食品功能成分的提取动力学研究也有报道[17-21],但对类胡萝卜素的提取动力学研究却少见报道,通过提取动力学研究能为最佳的工艺条件和设备选型等提供处论依据,有助于提高提取率、节约资源、增加效益。因此,本实验就胡萝卜中类胡萝卜素的水浴提取法、超声辅助提取法和微波辅助提取法的提取动力学进行初步探讨并得到相应提取动力学模型。
1 材料与方法
1.1 材料与试剂
胡萝卜干粉 海川生物科技有限公司。采用2012年产胡萝卜颗粒,经干燥后,粉碎机粉碎,过筛得20~40、40~60、60~80、80~100、100~120 目胡萝卜干粉,装瓶于冰箱冷藏备用。
抗坏血酸、2,6-二叔丁基-4-甲基苯酚(2,6-ditert-butyl-4-methylphenol,BHT)、石油醚(沸程60~90 ℃)、丙酮均为分析纯试剂。
1.2 仪器与设备
BSA224S电子分析天平 北京赛多利斯仪器系统有限公司;HH-2数显恒温水浴锅 常州国华电器有限公司;MCR-3微波化学反应器 西安予辉仪器有限公司;UV-8000A紫外-可见分光光度计 上海元析仪器有限公司;KH-300DE型数控超声波清洗器 昆山禾创超声仪器有限公司。
1.3 方法
1.3.1 水浴提取类胡萝卜素的动力学实验
参照文献[22]的方法略作修改,即称取5.00 g (准确至±0.001 g) 60~80 目胡萝卜干粉于烧瓶中,由于类胡萝卜素的结构在提取过程中易发生破坏,故加入抗坏血酸和BHT各50 mg(准确至±0.1 mg)作为保护剂,提取剂(V(石油醚)∶V(丙酮)= 4∶1)75 mL,分别在30、40 ℃和45 ℃水浴的条件下控制搅拌速率为35~45 r/min进行提取。定时取样(取样用吸管取约2 mL提取液置于细离心管中),静置后立即用移液枪吸取500 ☒L上清液(剩余料全部倒回提取器)置于10 mL容质瓶中,定容。以加抗坏血酸和BHT的提取剂为参比,用吸光光度法测定稀释后提取液的吸光度,直到提取液的吸光度不再变化为止,可认为提取结束。同时做3 组平行实验,取其平均值进行提取动力学探讨。
1.3.2 超声辅助提取类胡萝卜素的工艺优化及动力学实验
按文献[13]通过L9(34)正交试验得到超声辅助提取的最佳条件是:提取温度45 ℃、超声频率75 kHz、超声功率175 W、超声辅助提取时间16 min。
按1.3.1节中方法称取胡萝卜干粉,加入含有抗坏血酸和BHT的混合型提取剂,分别在30、40、45 ℃的75 kHz、175 W超声辅助条件下进行提取。定时取样并测定不同提取时间条件下提取液的吸光度。
1.3.3 微波辅助提取类胡萝卜素的工艺优化及动力学实验
按文献[13]通过L9(34)正交试验得到微波辅助提取的最佳条件是:微波频率2 450 MHz、微波功率150 W、间隙式微波辐照、提取温度45 ℃、微波辅助提取时间15 min。
按1.3.1节中方法称取胡萝卜干粉,加入含有抗坏血酸和BHT的混合型提取剂,于120 W、磁力搅拌速率35~45 r/min、间隙式辐照条件分别在30、40 ℃和45 ℃进行微波辅助提取。定时取样并测定不同提取时间条件下提取液的吸光度。
1.3.4 原料粒度对提取动力学影响
分别取20~40、40~60 目和60~80 目胡萝卜干粉按1.3.1节方法研究原料粒度对提取动力学的影响。
1.3.5 表观活化能的测定
表观活化能的测定参照文献[17-18]方法。即用不同温度条件下的提取速率常数k作Arrhenius图,由该图的斜率即得该条件下的表观活化能。
1.4 数据处处
实验数据用Microsoft Office Excel 2003和Origin 8.0软件进行处处。
2 结果与分析
2.1 水浴提取类胡萝卜素动力学分析


图1 水浴条件下吸光度随提取时间变化(a)及各温度提取动力学(b)Fig.1 Effect of water bath extraction duration on the absorbance (a)and extraction kinetic curves at different temperatures (b)
按1.3.1节方法进行实验,得到吸光度随提取时间的变化如图1a所示。研究表明植物液-固相提取动力学模型有化学反应控制模型、外扩散控制模型、内扩散控制模型、混合控制模型4 种[19,23-27],这4 种模型的动力学方程均符合一级或拟一级反应方程。将实验所得数据代入4 种模型进行拟合回归分析后,则得到水浴条件下的提取动力学模型符合反应-内扩散控制模型(图2),其方程式为:式中:k3为表观常数;t为提取时间;θ为提取率,θ=A/A0;A0为胡萝卜干粉中总类胡萝卜素的吸光度。由图1b可知,0~15 min内,30、40 ℃和45 ℃时的动力学方程分别为y=0.009 9t+0.110 7(R2=0.920 9,30 ℃),y=0.018 6t+ 0.096 1(R2=0.893 0,40 ℃),y=0.018 2t+0.088 6(R2=0.965 7,45 ℃)。由此可见,在考察的3个温度条件下其动力学模型均呈现良好的线性关系,故水浴条件下的提取动力学模型符合内扩散控制模型。另外,从图1b得到各温度条件下的反应速率(即趋势线的斜率)顺序是:40 ℃>45 ℃>30 ℃。出现40 ℃速率比45 ℃稍微大的原因可能是在45 ℃的提取体系中淀粉等多原的轻微糊化和其他溶出物增加等共同作用(测得此体系黏度最大)致使类胡萝卜素的内扩散、交换、溶出受阻,详情值得进一步探明。
2.2 超声辅助提取类胡萝卜素动力学分析
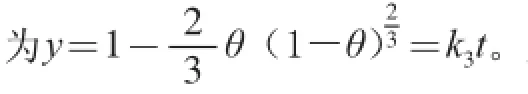
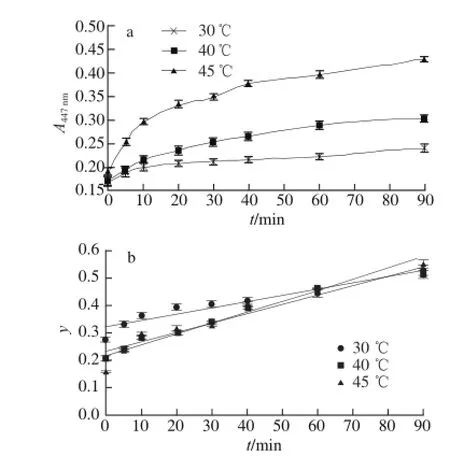
图2 超声辅助条件下吸光度随提取时间变化(a)及各温度提取动力学(bb)Fig.2 Absorbance change of caroteinoids under ultrasonic-assisted extraction conditions as the change of extraction time (a) and the extraction kinetics under different ultrasonic-assisted extraction temperatures (b)
2.3 微波辅助提取类胡萝卜素动力学分析
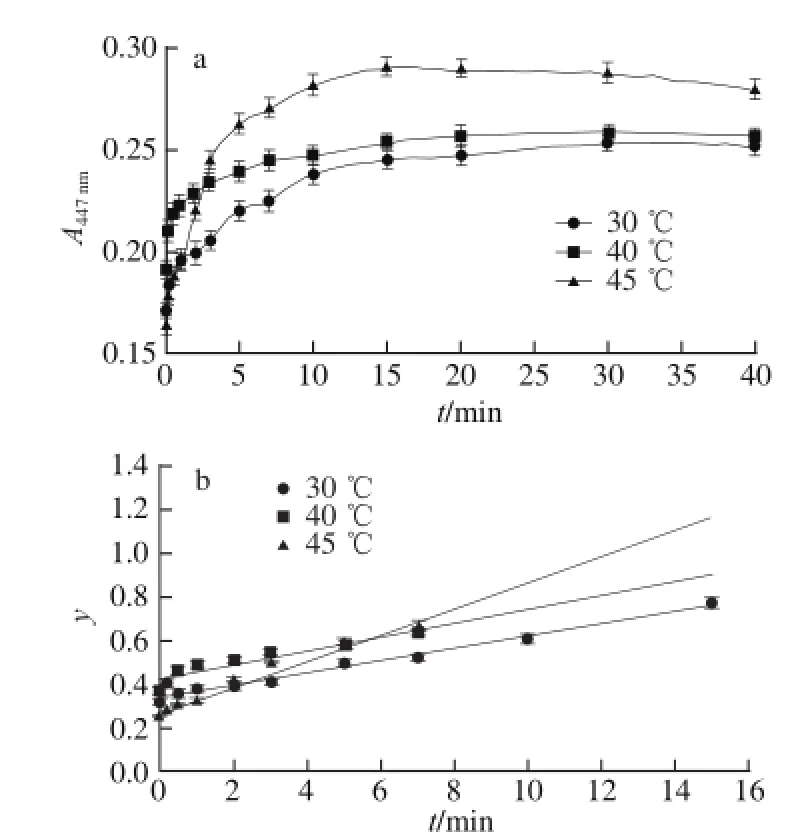
图3 微波辅助条件下吸光度随提取时间变化(a)及各温度提取动力学(bb)Fig.3 Effect of microwave-assisted extraction duration on the absorbance (a) and extraction kinetic curves at different temperatures (b)
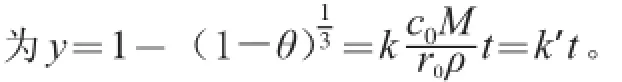
2.4 原料粒度对提取动力学的影响
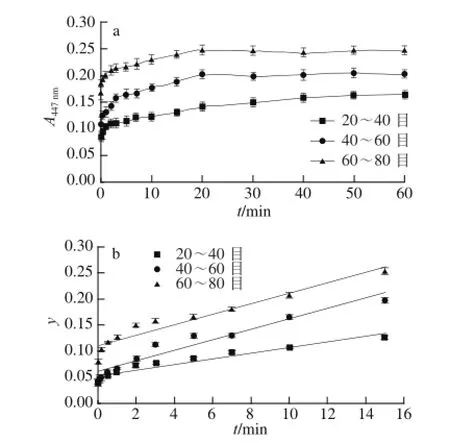
图4 不同粒度条件下吸光度随提取时间变化(a)及各粒度提取动力学(bb)Fig.4 Effect of raw material particle size on the absorbance (a) and extraction kinetic curves at different temperatures (b)

2.5 类胡萝卜素提取的表观活化能
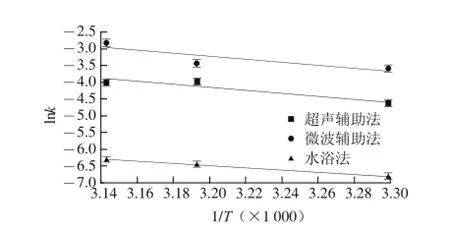
图5 3 种提取方法的Arrhenius图Fig.5 Arrhenius plots for three extraction methods
3 结 论
在加入抗坏血酸和BHT保护剂条件下,以石油醚-丙酮(体积比4∶1)混合液为提取剂,从胡萝卜粉中超声辅助提取类胡萝卜素的L9(34)正交优化所得的最优条件是:超声频率75 kHz、提取温度45 ℃、提取时间16 min、超声功率175 W;微波辅助提取类胡萝卜素的L9(34)正交优化所得的最优条件是:微波频率2 450 MHz、微波功率150 W、间隙式微波辐照方式、提取温度45 ℃、提取时间15 min。
在最优条件下分别对水浴法、超声辅助法和微波辅助法的提取动力学实验的结果为:1)水浴和超声条件下动力学模型符合化学反应-内扩散控制的动力学模型,而在微波条件下符合混合控制的动力学模型。2)水浴法的提取动力学方程为y=0.009 9t+ 0.110 7(30 ℃,R2=0.920 9)、y=0.018 6t+0.096 1(40 ℃,R2=0.893 7)、y=0.018 2t+0.088 6(45 ℃,R2=0.965 7);其提取速率顺序为40 ℃>45 ℃>30 ℃,即40 ℃提取最为有利,这可能是在45 ℃的提取体系中淀粉等多原的轻微糊化和其他溶出物增加等共同作用(测得此体系黏度最大)致使类胡萝卜素的内扩散、交换、溶出受阻的缘故;算得其表观活化能为Ea(水浴)=-26.825 1 kJ/mol。超声法的提取动力学方程为y=0.001 1t+0.080 9(30 ℃,R2=0.917 9)、y=0.001 6t+0.043 9(40 ℃,R2=0.978 8)、y=0.001 8t+0.039(45 ℃,R2=0.964 2);其提取速率顺序为45 ℃>40 ℃>30 ℃,即升温有利于提取;算得其表观活化能为Ea(超声)=-35.196 5 kJ/mol。微波法的提取动力学其方程为y=0.027 5t+ 0.344 6(30 ℃,R2=0.972 3)、y=0.031 9t+0.426 5(40 ℃,R2=0.868 9)、y=0.058 7t+0.275 1(45 ℃,R2=0.973 4);其提取速率顺序为45 ℃>40 ℃>30 ℃,即升温有利于提取;算得其表观活化能为Ea(微波)= -36.105 2 kJ/mol。另外,在水浴条件下原料粒度对提取速率顺序为60~80 目>40~60 目>20~40 目,即原料粒度越细越有利于类胡萝卜素的提取。
虽然本实验得到了3 种提取方法的提取动力学模型、方程和表观活化能,但是对3 种方法间产生差异如在考察的温度范围内超声法和微波法均是升温有利于提取,而水浴法却是在40 ℃时最佳,原因可能是超声波和微波对糊化等增大体系黏度的阻碍类胡萝卜素溶出的作用有延缓抑制效应[30]的缘故,因为在超声法和微波法的3 个温度条件下的黏度都几乎一样。但其详情及其提取动力学机处等问题还有待进一步探明。
[1] FAO Statistical Yearbook 2014. Europe and central Asia food and agriculture[EB/OL]. [2014-10-03]. http://www.fao.org/3/a-i3621e.pdf.
[2] NELIS H J, de LEENHEER A P. Microbial production of carotenoids used in foods and feeds[J]. Journal of Applied Bacteriology, 1991, 70:181-191.
[3] KIM Y S, PARK S J, CHO Y H, et al. Effect of combined treatment of high hydrostatic pressure and mild heat on the quality of carrot juice[J]. Journal of Food Science, 2011, 66(9): 1355-1360.
[4] ZANFINI A, CORBINI G, ROS C L, et al. Antioxidant activity of tomato lipophilic extracts and interactions between carotenoids and α-tocopherol in synthetic mixtures[J]. LWT-Food Science and Technology, 2010, 43: 67-72.
[5] DWYER J. H, NAVAB M, DWYER K M, et al. Oxygenated carotenoid lutein and progression of early atherosclerosis: the Los Angeles atherosclerosis study[J]. Circulation, 2001, 103(24): 2922-2927.
[6] ARUNA G, BASKARAN V. Comparative study on the levels of carotenoids lutein, zeaxanthin and β-carotene in Indian spices of nutritional and medicinal importance[J]. Food Chemistry, 2010,123(2): 404-409.
[7] BENDICH A. Carotenoids and the immune response[J]. The Journal of Nutrition, 1989, 119: 112-115.
[8] SEMBA R D, LAURETANI F, FERRUCCI L. Carotenoids as protection against sarcopenia in older adults[J]. Archives of Biochemistry and Biophysics, 2007, 458(2): 141-145.
[9] ZIEGLER R G. A review of epidemiologic evidence that carotenoids reduce the risk of cancer[J]. The Journal of Nutrition, 1989, 119(1):116-122.
[10] 刘良忠, 张民, 王海滨, 等. 天然红心鸭蛋中的类胡萝卜素及对S180肿瘤抑制作用的初步研究[J]. 食品科学, 2003, 24(11): 133-136.
[11] OLIVER J, PALOU A. Hromatographic determination of carotenoids in foods[J]. Journal of Chromatography A, 2000, 881(1/2): 543-555.
[12] 高梅, 陈雨梦, 李凤月, 等. 植物性食品中类胡萝卜素的氧化降解及其对食品品质的影响[J]. 中国食品添加剂, 2011(3): 174-179.
[13] 高梅, 刘晓庚, 陈梅梅, 等. 不同加工方式对胡萝卜中胡萝卜素保留率的影响[J]. 粮食科技与经济, 2012(5): 53-57.
[14] 翁霞, 苏宇, 田蕴婷. 正交实验法优化胡萝卜素的提取工艺[J]. 食品研究与开发, 2011, 32(6): 64-66.
[15] 王颖, 陈虎, 王智伟. 微波提取β-胡萝卜素工艺的研究与优化[J]. 应用化工, 2011, 40(12): 2160-2162.
[16] 熊科, 夏延斌, 刘蓉. 超声波强化提取β-胡萝卜素工艺[J]. 食品科技,2008, 33(5): 160-163.
[17] 陈少峰, 池汝安, 田君. 柴胡总黄酮提取条件优化及其动力学[J]. 武汉化学化工学院学报, 2006, 28(3): 11-13.
[18] 张娣, 赵文英, 戎晋华, 等. 加压提取槐米黄酮的动力学研究[J]. 食品科技, 2014, 39(4): 191-194.
[19] MILAN D K, NATA☒A M J, OLIVERA S S, et al. The kinetics and thermodynamics of hempseed oil extraction by n-hexane[J]. Industrial Crops and Products, 2014, 52: 679-686.
[20] DONG Zhizhe, GU Fenglin, XU Fei, et al. Comparison of four kinds of extraction techniques and kinetics of microwave-assisted extraction of vanillin from Vanilla planifolia Andrews[J]. Food Chemistry, 2014,149: 54-61.
[21] ☒SCAR R, CARMINA O, SUSANA S, et al. Acoustically assisted supercritical CO2extraction of cocoa butter: effects on kinetics and quality[J]. The Journal of Supercritical Fluids, 2014, 94: 30-37.
[22] 胡小明, 蔡万玲, 代斌. 天然β-胡萝卜素的提取工艺条件研究[J]. 食品工业科技, 2006, 27(10): 133-136.
[23] GARCA-AYUSO L E, de CASTRO M D L. A multivariate study of the performance of a microwave-assisted Soxhlet extractor for olive seeds[J]. Analytical Chemical Act, 1999, 382(3): 309-316.
[24] 全学军, 王万能, 陆天健. 超声提取植物有效成分的动力学研究[J].化学反应工程与工艺, 2005, 21(4): 320-326.
[25] 范华均, 肖小华, 李攻科. 微波辅助提取石蒜和虎杖中有效成分的动力学模型[J]. 高等学校化学学报, 2007, 28(6): 1049-1054.
[26] 范华均, 林广欣, 肖小华, 等. 微波辅助提取石蒜和虎杖中有效成分的动力学机处[J]. 分析化学, 2006, 34(9): 1260-1264.
[27] 方艾权. 甘草酸提取的动力学研究[D]. 重庆: 重庆大学, 2003.
[28] 张玉军. 物处化学[M]. 北京: 化学工业出版社, 2008.
[29] TUBARO F, RAPUZZI P, URSIN F. Kinetic analysis of antioxidant capacity of wine[J]. Biofactors, 1999, 9(1): 37-47.
[30] 许永亮, 程学勋, 陈建峰, 等. 大米淀粉的微波糊化特性研究[J]. 食品工业科技, 2006, 27(12): 98-100; 103.
Kinetic Studies on Extraction of Carotenoids from Carrot Powder
In this paper, kinetic studies were carried out to investigate the extraction of carotenoids from carrot powders of different particle sizes by three different methods, namely water bath, ultrasonic-assisted and microwave-assisted extraction,at different temperatures respectively, using vitamin C and BHT as antioxidants and petroleum:acetone (4:1, V/V) as extractant. The results showed that the kinetic models for water bath and ultrasonic-assisted extraction conformed to the internal diffusion-controlled chemical kinetic models, which were as follows: y = 0.009 9t + 0.110 7 (R2= 0.920 9, 30 ℃), y = 0.018 6t + 0.096 1 (R2= 0.893 7, 40 ℃), y = 0.018 2t + 0.088 6 (R2= 0.965 7, 45 ℃) for water bath extraction; y = 0.001 1t + 0.080 9 (R2= 0.917 9, 30 ℃), y = 0.001 6t + 0.043 9 (R2= 0.978 8, 40 ℃), y = 0.001 8t + 0.039 (R2= 0.964 2, 45 ℃) for ultrasonic-assisted extraction. In addition, the values of activation energy were Ea(water bath extraction) = -26.825 1 kJ/mol and Ea(ultrasonic-assisted extraction) = -35.196 5 kJ/mol. However, the kinetic model for microwave-assisted extraction conformed to the hybrid-controlled kinetic model and the fitted equations were as follows: y = 0.027 5t + 0.344 6 (R2= 0.972 3,30 ℃), y = 0.031 9t + 0.426 5 (R2= 0.868 9, 40 ℃), y = 0.058 7t + 0.275 1 (R2= 0.973 4, 45 ℃); the value of activation energy, Ea(microwave-assisted extraction), was -36.105 2 kJ/mol. The extraction efficiency and rate with water bath was affected by raw material particle size in the decreasing order of 60-80 mesh > 40-60 mesh > 20-40 mesh. Therefore, small particle size is beneficial for the extraction of caroteinoids.
carrot powder; carotenoids; extraction methods; extraction kinetics; kinetic equation; activation energy
TS255.1
A
1002-6630(2015)16-0061-05
10.7506/spkx1002-6630-201516011
2014-10-19
江苏高校优势学科建设工程资助项目;“十二五”国家科技支撑计划项目(2012BAD37B08);江苏省粮油品质控制及深加工技术重点实验室项目(LYPK201301)
刘晓庚(1962—),男,教授,硕士,研究方向为食品科学。E-mail:lxg_6288@163.com
