2株可感染大肠埃希菌工程菌的噬菌体的鉴定与分析
2015-12-27朱芷葳张利环侯燕平李慧锋
邢 颖, 朱芷葳, 张利环, 侯燕平, 范 华, 李慧锋*
(1.山西农业大学 生命科学学院,山西 太谷 030801;2.山西农业大学 实验教学中心,山西 太谷 030801)
2株可感染大肠埃希菌工程菌的噬菌体的鉴定与分析
邢 颖1, 朱芷葳1, 张利环1, 侯燕平2, 范 华2, 李慧锋1*
(1.山西农业大学 生命科学学院,山西 太谷 030801;2.山西农业大学 实验教学中心,山西 太谷 030801)
大肠埃希菌来源的基因工程菌是应用最为频繁的工程菌,但在基因工程菌规模化制备生物活性制剂的过程中常常会被噬菌体感染。通过对鸡粪中噬菌体大量筛选及鉴定,对工程菌防御相应噬菌体感染机制开展基础研究。实验以大肠埃希菌工程菌为宿主菌(CICC编号:10424),采用双层琼脂平板法从鸡场粪样中分离噬菌体,结果获得2株噬菌体,对其进行形态学鉴定。经透射电镜观察发现一株(CX)为短尾噬菌体,其头部外廓呈长六角形,非收缩性尾部,其噬菌斑清晰透亮,周围无晕环,裂解性较强;另一株(B1X)为长尾科噬菌体,其噬菌斑呈双层环状,中心澄清透明,直径约0.8~1.3 mm,外环呈半透明,云雾状区域,宽约0.8~1.3 mm。可进一步研究这2株噬菌体的侵染机制。
噬菌体;大肠埃希菌;双层平板法;工程菌
噬菌体作为细菌病毒,最早由英国细菌学家Twort[1]和加拿大细菌学家D′Herelle[2]分别于1915年和1917年发现,在自然界中广泛存在,凡是有细菌的场所,就可能有相应噬菌体的存在,其对维持自然界微生物的动态平衡起着重要作用。据估计,在生物圈内噬菌体种类繁多,形态各异,高达1031多种,而目前已经被描述的却仅有5 000多种,分离和鉴定新的噬菌体物种仍然任重道远[3]。基因工程菌是应用基因工程技术,按照人为设计对基因或基因的部分进行定向重组所构建的,能够在特定受体细胞中进行表达的重组微生物菌株。它是分子生物学研究与应用中重要的生物学工具与材料,被广泛应用于生命科学研究、食品工业、医药卫生、农牧业、环境保护等领域[4]。1998年,Y .Zhang等[5]首先将重组技术应用于大肠埃希菌。目前,大肠埃希菌基因工程菌是应用最广泛、最成功的表达体系,常被作为高效表达的首选载体。但是在应用基因工程菌大量培养时,常常会被噬菌体感染,一旦被感染,造成的损失将是不可估计的。目前对大肠埃希菌工程菌噬菌体的相关研究较少,通过对鸡粪中噬菌体大量筛选及鉴定,为防御相应类型的噬菌体感染提供一定的依据。本研究选取山西农业大学生命科学院微生物实验室保存的1株大肠埃希菌工程菌为宿主菌,从鸡粪中筛选相应噬菌体,结果分离到2株噬菌体,对其进行鉴定,得到相关的实验资料,以期为有效防御大肠埃希菌工程菌的感染制定合理完善的措施和策略提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源 本实验室-20 ℃甘油冻存的大肠埃希菌菌株(CICC编号:10424),购自中国工业微生物菌种保藏管理中心,为非模式菌株;致病性沙门氏菌菌株(CICC编号:21510),购自中国工业微生物菌种保藏管理中心;收集山西省晋中市太谷县孟家庄鸡场粪样2份,分别记为1号样、2号样,采样温度为27 ℃,pH 7.0。
1.1.2 培养基及试剂 ①营养琼脂培养基:胰蛋白胨5 g,牛肉膏3 g,氯化钠5 g,琼脂糖15 g,加蒸馏水至1 000 mL, pH 6.8~7.0;②上层琼脂培养基:胰蛋白胨17 g,大豆蛋白胨3 g,氯化钠5 g,磷酸氢二钠和葡萄糖各2.5 g,琼脂糖8 g,加蒸馏水至1 000 mL, pH 6.8~7.0;③液体肉汤培养基:胰蛋白胨5 g,牛肉膏3 g,氯化钠5 g,加蒸馏水至1 000 mL, pH 6.8~7.0;④TSB:胰蛋白胨17 g,大豆蛋白胨3 g,氯化钠5 g,磷酸氢二钠2.5 g,葡萄糖2.5 g;⑤2.5%戊二醛溶液用于透射电镜样品制备。
1.1.3 主要仪器 DH5000 AB型电热恒温培养箱,立式压力蒸汽灭菌锅,HZ-9212S型恒温振荡器,JEM-2010型透射电镜,6L-206-II型台式高速冷冻离心机。
1.2 方法
1.2.1 粪样的初步处理及菌悬液制备 取20 mL粪样于烧杯中,加入20 mL生理盐水稀释,制成悬液,1 000×g离心5 min,取上清液,0.22 μm滤膜过滤制成粪水滤液备用。
1.2.2 宿主菌的准备 用接种环挑取冻存的大肠埃希菌,在营养琼脂培养基上划线分离,37 ℃恒温培养12 h。将大肠埃希菌复苏后,接种于10 mL液体营养肉汤培养基中,37 ℃、130 r/min振荡培养约12 h至对数期,制成菌悬液备用。
1.2.3 噬菌体的初步鉴定 采用双层平板法,取200 μL对数期的宿主菌液与100 μL粪水滤液混合于4 mL上层半固培养基中,充分混匀后迅速倒入已准备好的营养琼脂平板上,倾斜旋转平皿使其分布均匀,待琼脂凝固后,37 ℃倒置培养4~12 h,观察结果。
1.2.4 噬菌体的纯化增殖 当有噬菌斑出现时,用10 μL枪头挑取单个噬菌斑接种到相应的宿主菌培养物中,37 ℃、130 r/min 振荡培养12 h,扩增噬菌体。然后在290×g下离心5 min,过滤除菌,无菌取上清液后,制作双层平板,再次得到噬菌斑,根据所形成的噬菌斑的形态,依据上述方法反复纯化5次以上,直至得到形态、大小均一的噬菌斑,即为同一噬菌体所形成的空斑。
1.2.5 噬菌体的形态观察 取样品悬液20 μL滴于微孔铜片上,15 min左右待样品进入微孔中,用滤纸吸去多余液体,再滴加2%磷钨酸(PTA)负染10 min后,用滤纸吸去多余染液,干燥后在透射电镜下观察其形态。
1.2.6 噬菌体效价(滴度)测定 用TSB作稀释液,将纯化后的噬菌体原液作连续10倍稀释,分别取100 μL加入200 μL相应宿主菌,再加入4 mL已溶化的60 ℃左右的半固体培养基,振荡使其充分混匀,采用双层琼脂平板法,观察噬菌斑的生长情况。上述每个稀释度分别做3个重复。计数时,选取噬菌斑数为30~300个的稀释度平板,然后取适当稀释度3个重复的平均数,以计算噬菌体的滴度。
噬菌体的效价(PFU/mL)=稀释倍数×平均噬菌斑数×10
1.2.7 噬菌体宿主范围的测定 细菌菌株有大肠埃希菌菌株及沙门氏菌菌株。取100 μL浓度为1010PFU/mL的噬菌体裂解液分别与200 μL不同的待测菌悬液混合,按双层平板法测定。
2 结果与分析
2.1 噬菌体分离结果
采用双层平板法验证发现,大肠埃希菌被侵染,出现大量噬菌斑(图1),圆形、边缘整齐,直径0.9~2.6 mm,呈蚕蚀状,推测粪样中含有能裂解大肠埃希菌的噬菌体。

图1 初次分离到的噬菌斑Fig.1 First isolated purified bacteriophage plaque
2.2 噬菌体的纯化
采用双层平板法反复纯化,直至得到的噬菌斑形态、大小均一。根据噬菌斑的形状和大小可分为两类,CX是直径约2.4 mm,圆形清晰透亮、边缘整齐、无晕环,呈现出典型的烈性噬菌体的噬菌斑特征(图2A);B1X是直径约1.6~2.6 mm,噬菌斑呈双层环状,中心澄清透明直径约0.8~1.3 mm,外环呈半透明云雾状区域(宽约0.8~1.3 mm),边缘不清晰(图2B、2C)。
2.3 噬菌体效价(滴度)测定
通过双层琼脂平板法测定可知,分离出的1株噬菌体的效价为5.04×109PFU/mL,噬菌斑为圆形透明。另一株噬菌体的效价为4.48×1010PFU/mL,噬菌斑呈双层环状。
2.4 噬菌体形态、大小
经透射电镜观察,根据大小、形态结构特征,可将所得到的噬菌体分为两类,CX是蝌蚪状非收缩尾的噬菌体,平面观察头部大致呈长六角形,头长径(L)约37 nm,头横径(W)约26 nm,L/W=1.4,非收缩性尾部,尾长约15 nm,尾宽约7 nm,
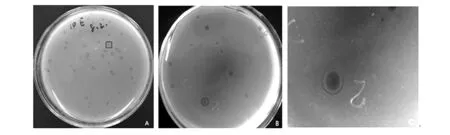
图2 纯化后的噬菌斑Fig.2 Purified bacteriophage plaqueA(CX)中用方形标出的为圆形透明的噬菌斑,B和C(B1X)中用圆形标出的为双层环状的噬菌斑A(CX) indicated by a circular transparent square plaques,B and C(B1X) indicated by a double ring plaques
为短尾噬菌体,噬菌斑为圆形清晰透亮(图3A);B1X是蝌蚪状非收缩尾的噬菌体,其头部平面轮廓为六角形,头长径(L)约55 nm,头横径(W)约65 nm,L/W=1.2,无囊膜,有尾鞘,尾长约127 nm,宽约11 nm,噬菌斑呈双层环状(图3B)。
按照Bradley和Ackermann形态分类法分类,噬菌体CX属于C形态群,根据ICTV病毒分类第九次报告,属于有尾病毒目(Caudovirales),短尾病毒科(Podoviridae);噬菌体B1X属于B1形态群,根据ICTV病毒分类第九次报告,属于有尾病毒目(Caudovirales),长尾病毒科(Siphoviridae)。

图3 电镜下的噬菌体CX(A)和B1X(B)Fig.3 Bacteriophage2CX (A) and B1X(B) under electron microscope
2.5 噬菌体的宿主范围
利用双层平板法测定了噬菌体对不同肠道菌的敏感性,以1株致病性沙门氏菌(CICC编号:21510)作为宿主菌,结果沙门氏菌未被裂解。表明该噬菌体的宿主菌范围相对较窄。
3 讨 论
从鸡粪样中初次通过双层平板法分离到2种噬菌斑,再进一步做双层平板试验发现这两种噬菌体的生长时间、形成噬菌斑的大小、形态以及裂解的程度都不相同,可以判定其为两种不同的噬菌体。
根据噬菌体与宿主的关系,噬菌体分为烈性和温和噬菌体两类[6]。烈性噬菌体(Virulent phage)侵入宿主菌后,可在其体内快速增殖,并使之裂解,在固体培养基上形成清晰透亮的溶菌空斑,即透明噬斑。温和噬菌体则是当它侵入宿主菌后,不裂解宿主菌,而是将其基因整合到宿主菌的基因组中或以质粒的形式存在,和宿主核酸同步复制,在固体培养基上形成混浊的半透明斑[7]。
如果在双层平板上形成的噬菌斑直径大于2 mm、而且噬菌斑的边缘比较清晰,则可以认为是噬菌体具有较强裂解性[8]。2014年李冰等[9]分离出的1株大肠埃希菌O18鸡源噬菌体,因形成的噬菌斑大多数为完全裂解,结果推测出该噬菌体为烈性噬菌体。观察本研究分离出的2株噬菌体,其中1株噬菌体CX的噬菌斑清晰透亮、边缘整齐,直径约2.4 mm,噬菌体效价为5.04×109PFU/mL,为短尾噬菌体。因其噬菌斑直径大于2 mm,噬菌斑又具有典型烈性噬菌斑的特征,故可认为该噬菌体有较强的裂解性。2008年郭秋菊等[10]从生活污水中分离的3株大肠埃希菌噬菌体,其中1株为短尾噬菌体,头部为二十面体,大小为20 nm,尾部长约2~3 nm。2009年马翔宇等[3]分离出的新型多价大肠埃希菌噬菌体,经透射电镜观察呈微球型,属短尾病毒科。本研究分离出的1株噬菌体CX也为短尾噬菌体。
本研究分离出的另一株噬菌体B1X的噬菌斑直径约1.6~2.6 cm,呈双层环状,效价为4.48×1010PFU/mL,由图3B的透射电镜照片可见,噬菌体由多面体头部及尾部组成,为蝌蚪状非收缩尾的噬菌体。尾长约127 nm,宽约11 nm,呈波浪状弯曲。毛普加等[11]分离的甲型副伤寒沙门菌噬菌体在电镜下观察为典型的噬菌体形态,也是由一个头部和长尾组成。
噬菌体的分离率有明显的季节性,如果从动物体外的环境中分离,则在温暖的季节,噬菌体的检出率相对较高[12]。Jamalludeen曾报道[13],从加拿大安大略省38个猪场污水分离大肠埃希菌噬菌体时,6~8月的分离率明显高于4月和5月。代保英[14]在10月、11月于江苏省扬州市釆集了100多份样品,只分离出3株噬菌体,其结果可说明天气寒冷时噬菌体检出率不高。本研究筛选是在7月到次年5月期间,7月份筛选出的噬菌体裂解性较强,而到11月份同样再筛选时,裂解性强的那株就没筛选出,推测寒冷季节时,不容易筛选出裂解性较强的噬菌体。
噬菌体与人类实践的关系极为密切,可用于生物防治、疫菌生产和作为遗传工程中的外源基因载体等,直接或间接地为人类创造出巨大的经济效益、社会效益和生态效应。然而噬菌体污染又会带来许多不利影响。本研究通过筛选分离到2株噬菌体并对其进行分离鉴定,为进一步研究防治大肠埃希菌噬菌体的感染提供参考。
致谢 感谢山西农业大学生命科学学院唐中伟老师提供大肠埃希菌菌株。
[1] Twort F W. An investigation on the nature of ultra-microscopic viruses[J]. Lancet,1915,186(4):1241-1243.
[2] D′Herelle M F. On an invisible microbe antagonistic toward dysenteric bacilli[J].Comptes Rendus Academie Des Sciences,1917,163(3):373-375.
[3] 马翔宇.新型多价大肠杆菌噬菌体285P分离鉴定及功能基因组学研究[D].重庆:第三军医大学,2009.
[4] 黎庶.一株基因工程菌噬菌体(EECP)的分离与鉴定[D].重庆:第三军医大学,2008.
[5] Zhang Y, Buchholz F, Muyrers JP,et al. A new logic for DNA engineering using recombination inEscherichiacoli[J]. Nature genetics,1988,20(2):123-128.
[6] 陆承平.兽医微生物学[M].北京:中国农业出版社,2007:476-477.
[7] 王雪松,李晓,杨光远,等.1株大肠杆菌O157鸭源噬菌体的分离、纯化及其特性鉴定[J]. 畜牧与兽医,2011,43(7):36-38.
[8] 周明.大肠杆菌裂解性噬菌体的分离鉴定及其实验治疗[D].长春:吉林大学,2009.
[9] 李冰,唐峰,刘孝刚.致病性大肠杆菌噬菌体分离及裂解特性分析[J].中国家禽,2014,09:53-55.
[10]郭秋菊,滕井华,许荣均,等.大肠杆菌噬菌体的分离、纯化及其特性研究[J]. 厦门大学学报(自然科学版),2008,47(S2):273-277.
[11]毛普加,冯金,洪愉.甲型副伤寒沙门菌噬菌体的分离及其生物学特性的分析[J]. 中国生物制品学杂志,2014,27(4):458-462.
[12]Comeau AM, Buenaventura E, Suttle CA.A persistent, productive,and seasonally dynamic vibriophage population within Pacific oysters (Crassostrea gigas)[J].Applied and Environmental Microbiology, 2005,71(9):5324-5331.
[13]Jamalludeen N, Johnson RP, Friendship R, et al. Isolation and characterization of nine bacteriophages that lyse O149 enterotoxigenicEscherichiacoli[J].Veterinary Microbiology,2007,124(1-2):47-57.
[14]代保英. 大肠杆菌K88噬菌体的分离、分类初步鉴定和生物学特性的测定[D].扬州:扬州大学,2009.
Identification & Analysis of TwoEscherichiacoliInfectable Phage Strains
XING Ying1, ZHU Zi-wei1, ZHANG Li-huan1, HOU Yan-ping2, FAN Hua2, LI Hui-feng1
(1.Coll.ofLifeSci., 2.Experim'lTeach.Ctr.,ShanxiAgric.Uni.,Taigu030801)
Genetic engineering bacteria (GEB) bred fromE.coliis frequently used GEB. However, bacteriophage infection is a common for culturing GEB in large-scale during the process of bio-active preparation. By screening and identifying phages by the gross from chicken manure, so as to carry out some basic studies on relevant phage infection mechanisms for the GEB defense. In this experiment, isolation method of double layer agar plate was used to separate the phages from chicken manure samples and anE.coliengineering bacteria (CICC code: 10424) was used as a host bacterium for phage isolation. As a result two phage strains were isolated and identified their morphologies. The images of transmission electron microscopy revealed that one strain (CX) is a Podoviridae phage that with a hexagonal head and a non-contractile tail. Its plaque was clear and transparent, without halo around, and with strong splitting character. Another strain (B1X) is a Siphoviridae phage that could form plaques (0.8~1.2 mm in diameter) present a double ring with a limpid center surrounded by a translucent loop (0.8~1.3 mm in diameter). It might be a phage with moving capability. The infection mechanism of these two phages can be further studied.
bacteriophage;Escherichiacoli; double-plate; genetic engineering bacteria (GEB)
国家自然科学基金(31172203);山西省青年科技研究基金(2011021028-1)
邢颖 女,硕士研究生。研究方向为生物化学与分子生物学。E-mail:xingying819@163.com
* 通讯作者。男,副教授,博士,硕士生导师。主要从事动物遗传育种的研究。E-mail: lihuifengtom@163.com
2015-02-26;
2015-09-08
Q939.121
A
1005-7021(2015)06-0064-05
10.3969/j.issn.1005-7021.2015.06.012
