高效除藻真菌云芝F21a遗传转化体系的建立
2015-12-27费维成陈晓琳邢育文韩国民
费维成, 陈晓琳, 任 冲, 邢育文, 戴 薇, 韩国民
(安徽农业大学 生命科学学院,安徽 合肥 230036)
高效除藻真菌云芝F21a遗传转化体系的建立
费维成, 陈晓琳, 任 冲, 邢育文, 戴 薇, 韩国民*
(安徽农业大学 生命科学学院,安徽 合肥 230036)
以蓝藻高效降解菌云芝F21a (Trametesversicolor)为出发菌株,对其原生质体的制备、再生条件及限制性内切酶介导的遗传转化进行研究。结果表明:在PDA培养基上,28 ℃培养4 d的菌丝最适于原生质体制备; 0.6 mol/L KCl为最适等渗条件;30 ℃混合酶液(2% cellulase+2% snailase+2% lywallzyme)酶解4 h,原生质体产量达到2.375×107个/mL,此时再生率达0.74%。采用限制性内切酶介导技术可将质粒pAN7-1导入云芝F21a的原生质体,在含有150 μg/mL 潮霉素的RM培养基中能够获得再生菌株,PCR验证初步表明该质粒已经转入云芝F21a原生质体。连续传代转接显示,阳性转基因菌株外源基因可以稳定表达,本结果为研究真菌高效消除蓝藻的分子机制奠定基础。
云芝F21a;原生质体制备;条件优化;限制性内切酶介导;遗传转化
近年来由于富含氮磷的农药、工业废水和生活污水的大量使用和排放,导致我国许多地区和大型湖泊出现了水华的蓝藻爆发性生长[1]。蓝藻的爆发会严重影响水源水质,使水生生物窒息死亡,而且蓝藻能分泌毒素,直接危害人类的生存与健康[2]。利用生物学方法治理蓝藻,特别是利用微生物控藻法与物理化学方法相比,具有方法简单、不易引起污染等优点,已成为蓝藻水华治理研究的热点[3-4]。然而现有的生物学方法,如病毒由于易发生突变使其作为控制藻华的应用前景变得扑朔迷离;溶藻细菌的大量繁殖会严重影响水体的透明度;释放抗生素除藻真菌会对其他水生生物带来许多不利影响;寄生真菌由于大规模的培养比较困难也限制了其实际应用[5-6]。目前,生物除藻研究多集中于发掘具有优良特性的溶藻细菌菌株及噬藻病毒[7]方面,而对利用真菌控藻关注较少。最近发现了一种新的真菌去除蓝藻的模式:真菌冷杉附毛孔菌BG-1302 (Trichaptumabietinum)菌丝体将活体藻细胞包裹后,活体藻细胞完全被分解,藻溶液最终变为透明澄清。本课题组负责人前期通过对大量不同种类的真菌进行除藻能力分析,筛选获得了1株效率更高的相同除藻模式的真菌——云芝F21a(T.versicolor),在相似条件下30 h内可彻底分解所有供试的蓝藻细胞,处理后的水体变为澄清透明[8]。然而,对此新型除藻方法的研究主要是表面影响因素有关的研究,而此新型除藻方法的分子机制尚不明确。为进行此方面研究,建立高效降解活体蓝藻的真菌云芝F21a遗传转化体系是进一步验证除藻分子机制的基础。本研究以高效降解活体蓝藻的真菌云芝F21a为供试菌,对其原生质体的制备与转化进行研究。通过研究酶种类、菌龄、酶解时间、渗透压稳定剂、渗透压等因素优化了原生质体形成条件;采用原生质体介导真菌遗传转化方法,通过限制性内切酶的方法将pAN7-1转入云芝F21a原生质体并进行转基因验证分析,初步确定转化云芝F21a成功。
1 材料与方法
1.1 材料
1.1.1 供试菌株 云芝F21a和表达载体 pAN7-1保存于安徽农业大学微生物实验室。
1.1.2 培养基 ①PDA培养基(g/L):马铃薯 200,葡萄糖20,琼脂 20;②PDB培养基(g/L):马铃薯 200,葡萄糖20; ③RM再生培养基:马铃薯200 g/L,葡萄糖 20 g/L,琼脂 20 g/L,KH2PO43 g/L,MgSO41.5 g/L,维生素B10.03 g/L,KCl 0.55 mol/L,酵母膏10 g/L。
1.1.3 主要试剂及配制方法 纤维素酶、蜗牛酶购自合肥博美生物公司;溶壁酶购自广东省微生物研究所;潮霉素B(Hygromycin B,HmB),Taq酶及PCR扩增试剂,SanPrep柱式质粒DNA小量抽提试剂盒,引物合成均购自上海生物工程公司,Hind Ⅲ 购自TaKaRa 生物公司,其他常规试剂均为分析纯。所有的酶液均用0.6 mol/L KCl配制,经0.22 μm微孔滤膜过滤除菌,保存于-20 ℃冰箱中备用。
1.2 方法
1.2.1 云芝F21a原生质体的制备与再生 用接种针挑取少量边缘菌丝接种于PDA培养基,28 ℃培养5 d,用打孔器取菌落边缘直径5 mm菌丝块接种于100 mL PDB培养基,28 ℃、150 r/min 摇床培养 4 d ,收集 0.2 g 湿菌丝,无菌水洗涤2次后,0.6 mol/L KCl稳渗剂洗涤3次,加入混合酶液(2% cellulase+2% snailase+2% lywallzyme),28 ℃、80 r/min 摇床酶解4 h。原生质体用灭菌的4层擦镜纸包裹注射器抽滤2次,滤液经4 000 r/min离心10 min,弃2/3上清,显微镜下观察原生质体形态并计数原生质体数量[9]。取100 μL原生质体涂布于RM再生培养基上,28 ℃倒置培养7~10 d后统计再生菌落数,以不含稳渗剂的低渗培养基为对照,计算再生率。
X:再生率;A:原生质体数量;B:再生的菌落数;C:对照组的菌落数量。
1.2.2 不同因素对云芝F21a原生质体制备的影响 为了获得更高的原生质体得率,通过改变某些制备过程中的单一因素来优化原生质体制备条件。分别测试了单一种类分解酶及混合酶解体系、不同菌龄菌丝、不同稳渗剂、稳渗剂浓度、酶解时间等条件来优化制备F21a原生质体的得率,重复3次,以确定最适条件。显微镜下观察原生质体形态并用血球计数板计数原生质体数量。
1.2.3 限制性内切酶介导的遗传转化 ①云芝F21a菌丝体对潮霉素的敏感性实验:将培养5 d的云芝F21a接种到含有0~200 μg/mL潮霉素B的PDA平板上,28 ℃恒温培养7 d后观察菌落生长情况,确定最佳的抑制供试菌生长的潮霉素浓度。②pAN7-1质粒的提取及线性化:将保藏的 pAN7-1质粒转入DH5α感受态中进行转化实验,待长出转化子后37 ℃摇菌,用SanPrep柱式质粒DNA小量抽提试剂盒提取pAN7-1质粒,将获得的pAN7-1质粒用限制性内切酶Hind Ⅲ于37 ℃酶切4 h,整个酶切在20 μL的反应体系中进行[10]。③原生质体转化:原生质体转化参考文献[11],用0.6 mol/L KCl稳渗剂悬浮制备好的云芝F21a原生质体,离心收集。再用STC(sorbitol 0.55 mol/L,10 mmol/L Tris-HCl pH 7.0,10 mmol/L CaCl2)冲洗2遍,用等渗液STC调整原生质体浓度为5×107个/mL左右,分成150 μL/mL每管。每管加入20 μg线性化质粒和30 U限制性内切酶HindⅢ,冰浴30 min。逐滴加入1 mL PTC(PEG4000 40%,25 mmol/L Tris-HCl pH 7.5,25 mmol/L CaCl2),冰浴20 min,取出后室温放置20 min。取100 μL转化液加入10 mL 1.0%琼脂的RM培养基中,混合后倒入平板,再次倒入10 mL 2.0%琼脂的潮霉素 B 150 μg/mL RM培养基。28 ℃培养10~15 d,即可长出转化子,连续转接几次后用于PCR验证[12]。
1.2.4 转化子验证 随机取性状稳定的转化子,利用CTAB法[7]提取转化子和对照未转化云芝F21a的总DNA。针对pAN7-1质粒的潮霉素hph基因片段设计引物,上游引物5′-GATTTGTGTACGCCCGACAG-3′,下游引物5′-CGCAAGGAATCGGTCAATAC-3′。引物扩增片段大小为500 bp左右。PCR程序设计如下:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,30个循环,72 ℃延伸10 min。PCR产物进行琼脂糖凝胶电泳,凝胶成像系统拍照观察。
2 结果与分析
2.1 云芝F21a原生质体的形态
云芝F21a酶解的过程如图1A所示,可以观察到有些菌丝正在酶解,菌丝刚被分解成节状的长方形细胞,菌丝尖端可见开始形成的原生质体,而有些真菌的菌丝已经完全酶解产生许多单个球形的原生质体。图1B为用4层擦镜纸过滤后用血球计数板记录原生质体的放大640倍的图片,可以清晰地看到云芝F21a的球形原生质体。

图1 云芝F21a原生质体的制备Fig.1 The preparation of Trametes versicolor F21a protoplast A:酶解1 h的酶液显微镜观察;B:酶解4 h酶液的显微镜观察A:microscopic examination of enzymolysis(1 h);B: microscopic examination of enzymolysis(4 h)
2.2 酶种类对原生质体产率的影响
不同的真菌细胞壁成分差异较大,适合的酶对原生质体的制备得率有重要的影响。本研究分别利用单一酶和复合酶酶解云芝F21a菌丝体,从表1可以看出复合酶酶解获得的原生质体高于单一酶酶解的产量。不同种类的单一酶酶解原生质体产率也有很大区别,溶壁酶的产量显著高于纤维素酶和蜗牛酶(P<0.01)。
表1 不同酶对云芝F21a原生质体产量的影响
Table 1 Effect of different enzymes on the protoplast yield
ofTrametesversicolorF21a

酶原生质体产量/(1×107个·mL-1)2%cellulase0.2502%snailase0.2002%lywallzyme2.1002%cellulase+2%snailase+2%lywallzyme2.375
2.3 菌龄对原生质体制备的影响
不同培养时期的菌龄原生质体的产率不同,从图2可以看出云芝F21a在生长到4 h时用于原生质体制备,酶解产生的原生质体最多。

图2 菌龄对原生质体制备的影响Fig.2 Effect of mycelial age on protoplast yield
2.4 稳渗剂种类对原生质体制备的影响
不同种类的稳渗剂对原生质体制备的影响很大,适合的稳渗剂对原生质体的产量起到很重要的作用。参考其他课题组研究,使用0.7 mol/L的浓度比较几种稳定剂对云芝F21a原生质体产量的影响。由图3可以明显地看出氯化钾作为稳渗剂可以产生更多的原生质体,硫酸镁次之,蔗糖、山梨醇和葡萄糖相对较少。
2.5 稳渗剂浓度对原生质体制备的影响
渗透压过大或过小都会影响原生质体的产量,过大会使原生质体破裂,过小不利于原生质体的释放且产生的原生质体偏小。由图4可以看出氯化钾的浓度为0.6 mol/L时原生质体的产量最高,此时制备的原生质体形态也最好。

图4 渗透压浓度对云芝原生质体的影响Fig.4 Effect of different concentration of KCl on protoplast yield
2.6 酶解时间对原生质体制备的影响
酶解时间不宜过长或过短,过长酶液会破坏原生质体膜,过短则酶解不完全而得不到原生质体。由图5可以看出酶解4 h最好,此时产量最高,达到2.375×107个/mL。

图5 酶解时间对云芝原生质体的影响Fig.5 Effect of different enzymatic hydrolysis time on protoplast yield
2.7 原生质体的再生及转化子验证
利用RM培养基可以获得大量的再生菌落,如图6A所示,云芝F21a原生质体再生率可达0.74%。再生菌落转接3代后的菌落形态已经完全变成正常菌落形态(图6B)。
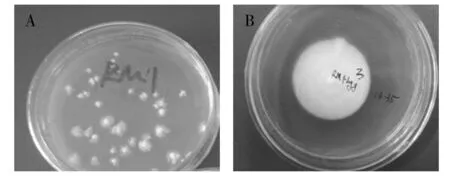
图6 云芝F21a的再生菌落Fig.6 The regeneration colonies of Trametes versicolor F21a A:转化子;B:转化子连续转接3代A:transformant;B:three consecutive generations of transformant
云芝F21a菌丝体在150 μg/mL潮霉素B的PDA平板上出现抑制现象,因此确定150 μg/mL潮霉素B为最适转化子筛选浓度。采用150 μg/mL 潮霉素B浓度筛选云芝F21a原生质体转化子,获得了几个再生菌落,将这几个可能的再生转基因菌落连续转接至少3次。为了初步检测pAN7-1质粒是否转入云芝F21a原生质体中,挑选抗性菌落提取其总DNA,进行PCR扩增验证。有2个转化子(泳道5、6)在500 bp 左右扩增出明显的条带,与阳性对照扩增的大小相同(与预期507 bp 的片段大小相符),而阴性对照未转化的云芝则未扩增出任何条带(图7)。初步表明pAN7-1质粒DNA已经转入到云芝F21a原生质体中,获得转基因菌落。

图7 转化子PCR验证Fig.7 Analysis of transformants by PCR
M:DL2000 Maker;1:质粒pAN7-1作为阳性对照;2:未转化的云芝F21a作为阴性对照;3~7:随机挑选的转化子
M:DL2000 Maker;1:Plasmid pAN7-1 as the positive control;2:UntransformedTrametesversicolorF21-a total DNA as the negative control; 3~7: Random selected transformants
3 讨 论
利用真菌菌丝体将活体藻细胞包裹后并将其完全分解不但是一种新型的真菌-蓝藻相互作用,具有一定的理论意义,而且具有潜在的蓝藻治理应用价值。对于这种新型真菌除藻的分子机理研究报道很少,一个主要的原因是该菌遗传转化体系尚未建成,而成功的噬藻真菌转化技术在分子机理研究过程中将发挥重要作用。
高质量制备原生质体是转化技术的前提和基础。生长时间较短的幼嫩菌丝最适于原生质体的制备,本研究以生长4 d的真菌菌丝最为合适,这与张鹏等研究杏鲍菇原生质体相近[13]。不同种或者同一种不同分布区域菌体的细胞壁结构存在差异,用酶法破壁制取原生质体,需要寻找合适的酶系统。现已有多种破除真菌细胞壁的酶类,一般用混合酶类比单一酶效果好,本研究也是混合酶的效果最好。混合酶酶解后的原生质体更利于转化实验,原因在于不同酶之间存在作用的互补能够更好的酶解细胞[14]。由于酶本身往往含有一些对原生质体有害酶类如过氧化物酶、核糖核酸酶等,酶解时间过长可能会破坏原生质体细胞膜。原生质体对渗透压非常敏感,合适浓度的渗透压稳定剂对原生质体的制备起着重要作用。常用的渗透压稳渗剂有KCl、NaCl、CaCl2、MgSO4、蔗糖、山梨醇等,本研究云芝F21a以KCl最为适合,这与一般丝状真菌以无机盐作为稳定剂比较适宜一致[15]。在原生质体制备中,不仅要考虑原生质体的数量,更重要的是原生质体的产量,即原生质体的活力和再生率[11]。但原生质体的再生率也受再生条件如稳定剂的种类、浓度以及再生培养基各种营养成分的影响。真菌的再生培养基中常常补加酵母膏、蛋白胨、糖类或氨基酸等作为营养因子,这些物质可作为细胞壁合成的前体物质,也可能通过代谢转化成细胞壁的前体物质或起到促进代谢,加速细胞壁合成的作用。而且许多研究发现Ca2+、Mg2+的存在可以显著提高原生质体的再生率[16]。故本实验的RM培养基中都包含了这些对原生质体再生有很大影响的营养因子,也取得了较好的再生效果。
限制酶介导的插入突变机理尚不十分清楚。有研究认为可能是在转化过程中,限制性酶和线性化质粒DNA一起进入细胞中,真菌染色体DNA的相应限制性酶位点被切开,尽管大多数切点没有整合外源DNA而重新连接,但也有可能外源DNA片段的粘性末端与染色体DNA的粘性末端连接后插入到染色体DNA某一酶切位点形成转化子。外源DNA带有抗性标记基因,通过培养基中加入的相对抗生素对转化子进行筛选及分子生物学验证即可获得转基因菌株[17]。相对于其他几种转化系统,REMI提高了转化效率、增加了单拷贝插入的几率,能够通过酶切与PCR等技术快速分离被标签的目的基因。但REMI也存在一些缺点,如大约30%~50%转化子不是由DNA转化子引起的,这给进一步分离基因带来困难,造成基因的误译。
丝状真菌的转化大多数采用带潮霉素抗性标记的质粒(如pCBl003、pAN7-1、pV2等)[18]。pAN7-1中含有来自构巢曲霉gpdA基因的启动子和潮霉素hph基因,本研究也采用此质粒用于云芝F21a的遗传转化。研究结果也显示pAN7-1中构巢曲霉gpdA启动子驱动的潮霉素hph基因能够在云芝F21a中表达,并且构成云芝F21a转化的一个较为理想的抗性选择性标记。以该hph基因标记设计PCR验证引物可以进行转化子筛选,而以来自构巢曲霉的启动子序列设计引物一般不适合用于筛选云芝转化子。这是由于构巢曲霉与云芝同源性较高,利用gpdA启动子设计引物需要首先验证其在未转化云芝中的扩增情况。本文经过连续传代3代以上后经PCR验证,初步表明pAN7-1可以导入到云芝F21a原生质体中并成功再生菌落,高效噬藻真菌云芝F21a的转化成功为进一步研究该新型真菌-蓝藻相互作用奠定基础。
[1] 李大命,孔繁翔,于洋,等.太湖蓝藻水华期间水体和底泥中产毒微囊藻种群丰度研究[J].环境科学学报,2011,31(2):292-298.
[2] Hudnell HK.The state of US freshwater harmful alglal blooms assessments,policy and legislation[J].Toxicon,2011,55(5):1024-1034.
[3] Imai I,Kimura S.Resistance of the fish-killing dinoflagellateCochlodiniumpolykrikoidesagainst algicidal bacteria isolated from the coastal sea of Japan[J].Harmful Algae,2008,7(3):360-367.
[4] Keawtawee T,Fukami K, Songsangjinda,et al.Isolation and characterization of Noctiluca-killing bacteria from a shrimp aquaculture pond in Thailand[J].Fisheries Science,2011,77(4):657-664.
[5] Lee YK,Ahn CY,Kim HS,et al.Cyanobactericidal effect ofRhodococcussp. Isolated from eutrophic lake onMicrocystissp.[J].Biotechnology Letters,2010,32(11):1673-1678.
[6] Wang Q,Su M.F,Zhu W.Q,et al.Growth inhibition ofMicrocystisaeruginosaby white-rot fungusLophariaspadicea[J].Water Science and Technology,2010,62(2):317-323.
[7] Paul C,Pohnert G.Interactions of the Algicidal Bacterium Kordia with Diatoms:Regulated Protease Excretion for Specific Algal Lysis[J].PLoSONE,2011,6(6):e21032.
[8] Jia Y,Han GM,Wang CY,et al.The efficacy and mechanisms of fungal suppression of freshwater harmful algal bloom species[J].Journal of Hazardous Materials,2010,183(1-3):176-181.
[9] 刘莉,肖招燕,郭丽琼,等.PEG介导的猴头菌遗传转化体系的建立[J]. 菌物学报,2014,33(1):121-128.
[10]Lau S K P, Chow W N, Wong A Y P, et al. Identification of microRNA-like RNAs in mycelial and yeast phases of the thermal dimorphic fungusPenicilliummarneffei[J].PLoS neglected tropical diseases,2013,7(8):e2398.
[11]Li C, Yang J, Zhou W, et al. A spindle pole antigen gene MoSPA2 is important for polar cell growth of vegetative hyphae and conidia, but is dispensable for pathogenicity inMagnaportheoryzae[J].Current genetics,2014:1-9.
[12]Gruber S,Seidl-Seiboth,V Self versus non-self:fungal cell wall degradation inTrichoderma[J].Microbiology,2012,158:26-34.
[13]张鹏,龚玲凤,庄卫东,等.杏鲍菇原生质体制备条件初探[J].中国农学通报, 2013, 29(31): 91-95.
[14]Wubie A J, Hu Y, Li W, et al. Factors Analysis in Protoplast Isolation and Regeneration from a Chalkbrood Fungus, Ascosphaera apis[J]. International Journal of Agriculture and Biology,2014,16(1):89-96.
[15]周庆新,陈静,于恺,等.疏绵状嗜热丝孢菌原生质体的制备与再生[J].菌物研究,2006,4:1-5.
[16]贾永峰,梁剑光,王永红,等.盐霉素产生菌原生质体的制备与再生[J].中国抗生素杂志, 2014, 39(3): 198-203.
[17]Kim JE,Myong K,Shim WB,et al. Functional characterization of aeetylglutamate synthase and phosphofibosylamine-glyeine ligase genes inGibberellazeae[J].Curr Genet,2006,51: 99-108.
Establishment of Genetic Transformation System of High Effective Algicidal fungusTrametesversicolorF21a
FEI Wei-cheng, CHEN Xiao-lin, REN Chong, XING Yu-wen, DAI Wei, HAN Guo-min
(Schl.ofLifeSci.,AnhuiAgric.Uni.,Hefei230036)
Cyanobacteria high-degrading fungusTrametesversicolorF21a as a starting strain was studied for its protoplasts preparation, regeneration conditions, and restriction endonuclease mediated genetic transformation. The results showed that the fungal mycelia cultured on the PDA medium at 28 ℃ for 4 days is the most suitable for protoplast preparation; 0.6 mol/L KCl was the optimal isotonic conditions for the protoplasts; 30 ℃ mixed enzyme solution (2% cellulase + 2% helicase + 2% cell-wall-lysozyme) zymolyzed for 4 hours. The protoplast production reached as high as 2.375×107/mL with the regeneration rate as high as 0.74%. The plasmid pAN7-1 could be introduced intoT.versicolorF21a protoplasts using restriction endonuclease-mediated technology, could be verified by PCR. Continuous transfer of the mycelia indicated that the exogenous gene could be stable expression in the positive strains. The results of this study supplied a good foundation for elucidation the molecular mechanism of the algicidal fungi.
TrametesversicolorF21a; protoplast preparation; condition optimization; restriction endonuclease-mediation; genetic transformation
国家自然科学基金项目(51309003);教育部博士点基金项目(20133418120003)
费维成 男,硕士。研究方向为环境微生物。E-mail:15856962718@163.com
* 通讯作者。男,副教授,博士,硕士生导师。研究方向为环境微生物。 E-mail:guominhan@ahau.edu.cn
2014-08-28;
2014-10-24
Q933
A
1005-7021(2015)06-0010-06
10.3969/j.issn.1005-7021.2015.06.002
