吗啡对顺铂诱导的肺癌A549细胞的生物学影响
2015-12-27王钱东吴淑娟朱国文
王钱东,吴淑娟,朱国文
(瑞安市人民医院,浙江 温州 325200,1.麻醉科;2.药剂科)
·论 著·
吗啡对顺铂诱导的肺癌A549细胞的生物学影响
王钱东1,吴淑娟2,朱国文1
(瑞安市人民医院,浙江 温州 325200,1.麻醉科;2.药剂科)
目的:探讨吗啡联合顺铂处理肺癌A549细胞后,细胞增殖能力和细胞凋亡水平的变化。方法:选择不同浓度吗啡处理肺癌A549细胞,CCK8法检测6、12、24和48 h时点的细胞增殖抑制率;再采用30 μg/ mL顺铂单药联合筛选出的最佳抑制率浓度的吗啡处理细胞,48 h后检测细胞增殖活力,同时采用Western blot电泳检测顺铂单药、吗啡,以及二者联合分别处理细胞后,凋亡相关蛋白Bax、Bcl-2、Caspase-3、survivin表达量的变化。结果:CCK8法显示500 μg/mL浓度的吗啡单独处理肺癌细胞48 h时,能最明显抑制细胞的增殖(P<0.05),抑制率达到41.2%;与单纯使用顺铂抑制细胞增殖效果(47.21%)相比,顺铂30 μg/ mL联合500 μg/mL吗啡对细胞的抑制率达77.45%,差异具有统计学意义(P<0.05);Western blot实验显示顺铂联合500 μg/mL吗啡与单纯顺铂药物作用相比,Bcl-2、survivin蛋白表达量降低,Bax、Caspase-3蛋白的表达升高。结论:选择合适的吗啡浓度可加强顺铂对肺癌细胞的抑制增殖和促凋亡功能,这种对肺癌细胞的生物学效应可能与促进凋亡蛋白Bax、Caspase-3表达上调和凋亡抑制蛋白的下调相关。
吗啡;顺铂;肺肿瘤;细胞生物学
晚期肺癌患者多数会伴有复发或转移灶的癌症疼痛[1],作为主要镇痛作用的阿片类药物,人们越发关注其镇痛效应以外的其他作用,如免疫调节、抗肺癌作用。吗啡作为阿片类代表药为癌症治疗中第三阶梯镇痛用药,除神经元激活阿片受体信号的镇痛机制外,大量研究表明吗啡产生许多不依赖其镇痛作用的生物学效应并可能会影响细胞存活或增殖[2-4]。顺铂作为细胞周期非特异性抗癌药物,以顺铂为基础的联合化疗具有重要的抗肺癌活性。癌症患者常在接受化疗的同时,予以镇痛的对症处理,那么在应用化疗药物的肺癌治疗过程中,吗啡是否会对肺癌化疗效果产生影响也成为关注的焦点[5-6]。因此,本研究提出吗啡与顺铂联合用药,观察其是否对肺癌细胞化疗效果有增强作用,以及对细胞增殖和凋亡的影响。
1 材料和方法
1.1 实验细胞株与实验药物 人源肺腺癌A549细胞株引自美国ATCC。临床用吗啡注射液(东北制药集团沈阳第一制药有限公司),分装成浓度分别为100、200、500和1 000 μg/mL的药物悬液。顺铂(南京制药厂有限公司),用前取0.3 mg,溶解于0.9%氯化钠溶液10 mL中,配成终浓度为30 μg/mL的溶液,主要实验试剂有CCK-8试剂盒(世纪康为生物公司,中国),BCA蛋白浓度测定试剂盒(碧云天,B480),GAPDH单抗(Santa Cruz公司,美国),Bax一抗(Santa Cruz公司,美国);Bcl-2一抗(Santa Cruz公司,美国);Caspase-3一抗(Santa Cruz公司,美国);survivin一抗(Santa Cruz公司,美国);HRP-羊抗兔IgG(Santa Cruz公司,美国)。
1.2 实验方法
1.2.1 细胞培养:从-196 ℃液氮中取出冻存的肺腺癌A549细胞,用含10% FBS、1%的青霉素-链霉素的改良型1640培养基均匀接种于10 cm dish中,放入37 ℃,5% CO2培养箱中,间隔2 d更换培养液1次,于80%左右的细胞密度时进行传代培养,根据胎盘兰染色判断细胞活度,在细胞处于对数期生长期时进行药物联合处理。
1.2.2 CCK8法检测细胞增殖:取对数生长期的肺癌细胞消化制备成单细胞悬液,细胞计数仪调整细胞密度1×107/mL,按每孔约2 000个细胞接种于96孔培养皿中,接种过程中保持吹打和晃动,使细胞分布尽量均匀,将培养板在培养箱预培养24 h(37 ℃,5% CO2),待细胞贴壁后吸除全部培养液,向培养板加入10 μL不同浓度的吗啡药物悬液,在培养箱孵育一段适当的时间(本实验的时间点为6、12、24和48 h),之后取出板子,向每孔加入10 μL CCK8溶液注意避光和不要在孔中生成气泡,它们会影响OD值的读数)。将培养板在培养箱内孵育1 h。注意遮盖培养板,避光保存在室温条件下,用酶标仪测定在450 nm处的吸光度。细胞活力按照公式计算,细胞活力(%)=[OD(加药)-OD(空白)]/[OD(0加药)-OD(空白)]×100。根据吗啡浓度梯度筛选最佳细胞处理浓度,依据此方法进而计算吗啡与顺铂药物联合处理后细胞的生长活力变化。
1.2.3 细胞处理后BCA法检测各组蛋白表达情况:蛋白样品制备分4组。①对照组:向培养液中加入1 mL 0.9%氯化钠溶液;②吗啡组:向培养液中加入500 μg/mL浓度的吗啡注射液1 mL;③吗啡联合顺铂组:吗啡和顺铂剂量同单独处理组,同时加入培养基中处理;④顺铂组:根据以往文献报道,顺铂药物浓度设定为30 μg/mL,每10 cm dish培养液中加入顺铂混悬液1 mL。药物处理细胞后于48 h时点收集细胞。加入适当体积的冰上预冷的RIPA裂解液(用时加入PMSF、Coctail蛋白酶抑制剂),冰上裂解30 min,中途颠倒混匀3次;4 ℃,12 000 r/min离心14 min;吸取上清至新预冷的离心管中,即为蛋白样品。取出25 μL蛋白样品待定量使用,剩余样品加入5×SDS loading buffer,沸煮10 min,瞬时离心。采用BCA蛋白定量试剂盒进行蛋白浓度测定,用1×SDS loading buffer补齐至各组同一浓度,即可上样电泳,用完的蛋白样品保存于-40 ℃冰箱中。
1.2.4 各实验组细胞提取的蛋白Western blot电泳:制备10%分离胶和5%浓缩胶灌注,电泳缓冲液中80 V电泳,至Marker到分离胶分开后,加压至120 V恒压至溴酚蓝跑完。转膜:根据分离胶的大小剪一块PVDF膜从负极到正极依次制作排列为海绵/滤纸/凝胶/膜/滤纸/海绵的折叠形状状,玻璃棒赶走胶与膜之间的气泡,170 mA恒流电转2 h。封闭:5%脱脂奶粉中,于60转摇床上室温封闭1 h。一抗孵育:5% BSA配制一抗(1∶3 000~1∶10 000),4 ℃缓慢摇动过夜。TBST于150转摇床上10 min/3次。加入二抗孵育液(1:4 000,生奶稀释),室温湿盒中孵育2 h。TBST于150转摇床上10 min/3次。观察结果:1∶1配制显影液和稳定剂,取200 μL试剂均匀覆盖于剪好的膜上,均匀孵育后生物发光影像分析仪扫描成像。
2 结果
2.1 CCK8法检测细胞增殖活力 从图1中看出,肺癌细胞使用吗啡100、200 μg/mL处理6 h和12 h后,抑制活性均在20%以下,随着时间延长,抑制效果增加。另外,图1也显示吗啡浓度的增加也能提高对肺癌A549增殖活力的抑制作用,尤其在48 h浓度为500 μg/mL的吗啡组能最大程度地提高这种细胞增殖的抑制效果,达到41.2%,与100 μg/mL和200 μg/mL吗啡处理组比较,差异有统计学意义(P= 0.0128)。如图2所示,在实验的第二阶段,我们采用已经筛选出的500 μg/mL吗啡联合顺铂30 μg/mL观察对肺癌细胞的增殖抑制能力,在处理48 h后上机检测,吗啡联合顺铂组对细胞的增殖抑制率达77.45%,与单用吗啡组相比,差异有统计学意义(P= 0.0037),而与单纯顺铂作用效果(细胞增殖抑制率为47.21%)相比,差异也具有统计学意义(P=0.0202),提示吗啡的处理明显增加顺铂的药物效力。

图1 不同浓度吗啡处理后的肺癌A549细胞增殖抑制率
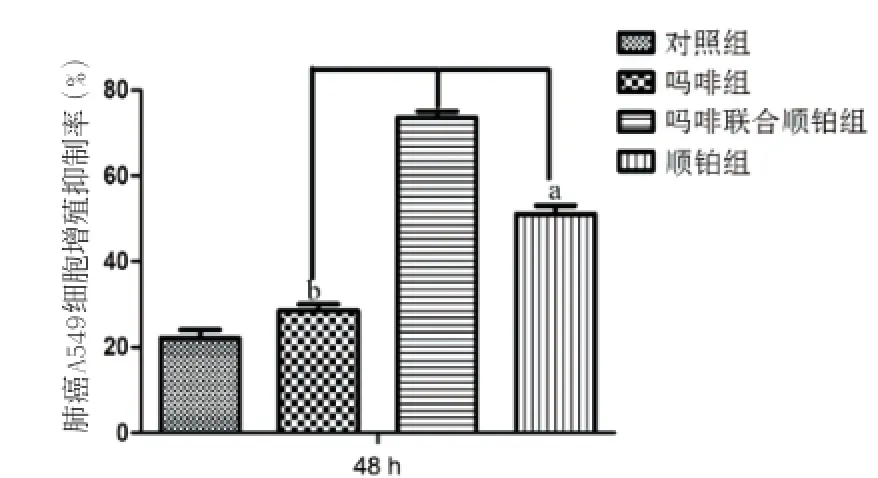
图2 不同实验因素处理后肺癌A549细胞增殖抑制率
2.2 各组肺癌A549细胞Bax、Bcl-2、Caspase-3、Survivin等蛋白表达量 从图3可见,吗啡联合顺铂组凋亡抑制性蛋白Bcl-2、survivin的表达明显下调,较吗啡组和对照组抑制效果明显,条带明显减弱,对于凋亡促进蛋白Bax、Casepase-3等,吗啡联合顺铂组和单独使用顺铂组,均能上调其表达。

图3 各组肺癌A549细胞Bax、Bcl2、Caspase-3、Survivin等蛋白表达量
3 讨论
肺癌目前通过传统的放化疗、手术切除、中医药以及靶向综合治疗后,有效率和生存率得到大幅度改善[7],近年患者在综合治疗以及出院后续治疗过程中多伴随以吗啡为代表的阿片类辅助药物的使用。有报道阿片受体抑制剂可影响肺癌细胞的生长、侵袭和转移[7-9],因此科学合理的选择阿片类药物可影响肺癌患者的预后。
吗啡作为应用广泛的癌症镇痛药物,研究发现在腺癌动物模型上,可以延缓肿瘤的生长速度,在临床上也发现术前和术后使用吗啡可以减少肺癌细胞扩散,其机制可能是加强了细胞介导的免疫反应,激活了阿片类受体,抑制了核因子κ,减少了一氧化氮的释放。最近,吗啡对肺癌细胞增殖和凋亡的的影响成为了研究的热点[10-11],并在一些细胞培养和体内实验中得以证实,细胞凋亡作为一种特征性的程序性细胞死亡模式,与机体发育、组织自稳定、肺癌、自身免疫疾病和神经退行性疾病的发生密切相关,是为维持内环境稳定,由基因控制的自主有序的主动死亡过程。其具体机制包含了一连串能量依赖级联分子事件,受到多种基因调控。其中凋亡过程中的中枢效应器Caspases是内外源性凋亡通路的核心,普遍认可的Caspase-3是酶级联反应的必经之路,可通过介导或影响其他凋亡抑制蛋白Bcl-2、c-Myc、p53、Rb,以及转化生长因子、核因子κ B通路发挥其功能作用[12]。Bcl-2蛋白质家族是线粒体凋亡通路的主要调节因子,包括抗凋亡蛋白和促凋亡蛋白。Bcl-2和Bcl-xl均可经半胱氨酸蛋白酶家族(Caspases)催化裂解。而Bax是受到凋亡信号刺激后,最早发生构象变化,诱导线粒体膜破裂从而使其功能异常的促凋亡成员。Survivin是发现最强的凋亡抑制蛋白家族的新成员,在凋亡发生中扮演重要角色,能促进细胞转化,跟增殖期癌细胞的有丝分裂和对化疗药物产生耐药性机制有联系。因此我们通过检测对细胞增殖调亡相关关键靶蛋白表达量变化来探讨吗啡联合使用顺铂的凋亡可能机制[13-15]。
我们的实验中,顺铂单独应用可以抑制Bcl-2蛋白的表达,激活共同凋亡通路的Caspase-3、Bax蛋白表达。吗啡500 μg/mL与顺铂30 μg/mL联合处理细胞后,survivin蛋白和抑制因子Bcl-2的表达抑制加强,考虑存在辅助增加癌细胞的杀伤机制,而单独使用吗啡药物处理并不能明显改变凋亡因子的明显升降,间接说明顺铂诱导的肺癌A549细胞凋亡,吗啡可以在恰当的浓度,恰当的时间(本实验为48 h)协同增强顺铂的整体促凋亡作用。其中变化最明显的当属Casepase通路和线粒体凋亡通路的激活表达而介导细胞凋亡,与顺铂早前研究的主要影响线粒体结构和功能引起的异常发生凋亡有共同的理论基础,线粒体DNA严重损伤,导致细胞能量的不足,从而促进内源性蛋白酶的释放,进一步活化Caspase-3相关凋亡途径,最终导致DNA片段的损失和不可逆修复。有国外报道[16],对顺铂化疗敏感的宫颈癌患者,癌组织蛋白定量显示Bax蛋白的表达量与Bcl-2蛋白的表达比值增加,而在本实验中吗啡通过促进顺铂作用肺癌细胞后,Bax/Bcl-2的蛋白灰度比值也是明显增加,引起细胞的凋亡活化。
Kuhar等[16]研究从基因水平验证了顺铂作用后Bax的mRNA表达水平上升,而Bcl-2的mRNA的表达水平下降,总体趋势与本实验一致。综上所述,本研究从细胞增殖、细胞凋亡相关蛋白的变化几个方面证实了吗啡协同顺铂诱导肺癌细胞凋亡作用,并初步探讨了这一机制。顺铂能单独抑制肺癌细胞的增殖和促进其凋亡,并且明显抑制细胞内Bcl-2、survivin蛋白的表达,激活Caspase-3,Bax的表达量显著增加。吗啡的联合处理明显增强了了顺铂的抑制增殖和促凋亡功能,与激活内源性凋亡途径和线粒体凋亡途径有关。
[1] Dalton JA,Higgins MK,Miller AH,et al.Pain intensity and pain interference in patients with lung cancer:a pilot study of biopsychosocial predictors[J].Am J Clin Oncol,2013 Sep 21.[Epub ahead of print].
[2] Cicero TJ,Shores CN,Paradis AG,et al.Source of drugs for prescription opioid analgesic abusers:a role for the Internet? [J].Pain Med,2008,9(6):718-723.
[3] Liu W,Xie S,Yue L,et al.Investigation and analysis of oncologists’ knowledge of morphine usage in cancer pain treatment[J].Onco Targets Ther,2014,7:729-737.
[4] Wiffen PJ,Derry S,Moore RA.Impact of morphine,fentanyl,oxycodone or codeine on patient consciousness,appetite and thirst when used to treat cancer pain[J].Cochrane Database Syst Rev,2014,5:CD011056.
[5] Liu X,Zhang J,Zhao H,et al.The effect of propofol on intrathecal morphine-induced pruritus and its mechanism[J].Anesth Analg,2014,118(2):303-309.
[6] Li Y,Wang LR,Chen J,et al.First-line gemcitabine plus cisplatin in nonsmall cell lung cancer patients[J].Dis Markers,2014,2014:960458.
[7] Kenmotsu H,Niho S,Ito T,et al.A pilot study of adjuvant chemotherapy with irinotecan and cisplatin for completely resected high-grade pulmonary neuroendocrine carcinoma (large cell neuroendocrine carcinoma and small cell lung cancer)[J].Lung Cancer,2014,84(3):254-258.
[8] Ozturk T,Karadibak K,Catal D,et al.[Comparison of TD-fentanyl with sustained-release morphine in the pain treatment of patients with lung cancer][J].Agri,2008,20(3):20-25.
[9] Komaki R,Paulus R,Ettinger DS,et al.Phase II study of accelerated high-dose radiotherapy with concurrent chemotherapy for patients with limited small-cell lung cancer:Radiation Therapy Oncology Group protocol 0239[J].Int J Radiat Oncol Biol Phys,2012,83(4):e531-536.
[10] Hatsukari I,Hitosugi N,Ohno R,et al.Induction of apoptosis by morphine in human tumor cell lines in vitro[J].Anticancer Res,2007,27(2):857-864.
[11] Yin D,Woodruff M,Zhang Y,et al.Morphine promotes Jurkat cell apoptosis through pro-apoptotic FADD/P53 and antiapoptotic PI3K/Akt/NF-kappaB pathways[J].J Neuroimmunol,2006,174(1-2):101-107.
[12] Butkiewicz D,Drosik A,Suwinski R,et al.Influence of DNA repair gene polymorphisms on prognosis in inoperable non-small cell lung cancer patients treated with radiotherapy and platinum-based chemotherapy[J].Int J Cancer,2012,131(7):E1100-E1108.
[13] Shoae-Hassani A,Sharif S,Tabatabaei SA,et al.Could the endogenous opioid,morphine,prevent neural stem cell proliferation?[J].Med Hypotheses,2011,76(2):225-229.
[14] Weber ML,Farooqui M,Nguyen J,et al.Morphine induces mesangial cell proliferation and glomerulopathy via kappa-opioid receptors[J].Am J Physiol Renal Physiol,2008,294(6):F1388- F1397.
[15] 林晓铭,程德志,蒋成榜,等.非小细胞肺癌患者循环肿瘤细胞和血管内皮生长因子的联合检测[J].温州医学院学报,2010,40(4):405-407.
[16] Kuhar M,Imran S,Singh N.Celecoxib enhances the chemotherapeutic response of cisplatin and TNF-alpha in SiHa cells through reactive oxygen species-mediated mitochondrial pathway[J].Int J Biomed Sci,2007,3(3):176-184.
(本文编辑:吴健敏)
The biological impaction of morphine on lung cancer A549 cells induced by cisplatin
WANG Qiandong1,WU Shujuan2,ZHU Guowen1.
1.Department of Anesthesiology,Ruian People’s Hospital,Wenzhou,325200; 2.Department of Pharmacy,Ruian People’s Hospital,Wenzhou,325200
Objective:To analyze the effect and mechanism of the proliferation inhibition and apoptosis in human lung carcinoma after using morphine combined with cisplatin chemotherapy.Methods:Human lung adenocarcinoma cell line A549 was cultured in conventional 1 640 medium.Cell proliferation activity for cisplatin alone or in combination with morphine after treatment for 6 h,12 h,24 h and 48 h were detected by CCK8.In addition,Western Blot electrophoresis was adopted to detect cisplatin alone or in combination with the optimal concentration of morphine after 48 h.Then changes of apoptosis related proteins Bax,Bcl-2 Caspase-3,survivin expression level were analyzed.Results:After 24 h,or 48 h,the concentration of 500 μg/mL morphine in combination with cisplatin group,compared to morphine and cisplatin alone group,could significantly increase cancer cell proliferation inhibitory effect (P<0.05).While combined with low-dose concentrations of morphine-treated group,compared with cisplatin alone,the difference was not statistically significant.By WB experiments,we found that the combination of drug treatment could inhibit Bcl-2,survivin protein expression induced by cisplatin,while enhancing the pro-apoptosis death proteins Bax,Caspase-3 expression.Conclusion:The best choice for morphine dosage can significantly enhance proliferation and apoptosis function of cisplatin on lung cancer cell.This may inhibit the proliferation of lung cancer cells by promoting key apoptotic protein Bax and Caspase-3 expression pathway.
morphine; cisplatin; lung cancer; cell biology
R73
A
10.3969/j.issn.2095-9400.2015.04.009
2014-04-15
王钱东(1973-),男,浙江瑞安人,副主任医师。
