罗红霉素对离体哮喘大鼠气道平滑肌细胞凋亡的影响及其机制
2015-12-27吴海亚戴元荣应斌宇
吴海亚,戴元荣,应斌宇
(温州医科大学附属第二医院,浙江 温州 325027,1.重症医学科;2.呼吸内科)
·论 著·
罗红霉素对离体哮喘大鼠气道平滑肌细胞凋亡的影响及其机制
吴海亚1,戴元荣2,应斌宇1
(温州医科大学附属第二医院,浙江 温州 325027,1.重症医学科;2.呼吸内科)
目的:观察罗红霉素对离体气道平滑肌细胞(ASMCs)凋亡的影响以及线粒体凋亡途径在ASMCs凋亡中的作用。方法:体外培养哮喘大鼠ASMCs,用不同浓度(0、10、25、50、100μg/mL分别对应R0组、R10组、R25组、R50组、R100组)的罗红霉素干预48 h。Annexin V/PI双标记流式细胞术检测早期细胞凋亡;JC-1染色流式细胞术分析线粒体跨膜电位(ΔΨm)的变化;Western blot法分析线粒体内和胞浆内细胞色素C(Cyt-c)的含量。结果:各实验组(R10组、R25组、R50组、R100组)ASMCs的早期凋亡率分别为(4.6±1.9)%、(5.8±2.9)%、12.0±5.6)%、(26.9±11.1)%,较R0组的(2.9±1.7)%高,其中R100组与R0组间差异有统计学意义(x2=13.30,P<0.01)。各实验组(R10组、R25组、R50组、R100组)低ΔΨm细胞所占比例分别为(27.88±13.10)%、40.35±9.19)%、(48.40±14.15)%、(52.90±15.88)%,较R0组的(19.78±9.85)%高,其中R100组和R50组ΔΨm显著低于R0组和R10组(P<0.05或0.01),R25组与R0组比较,差异有统计学意义(P<0.05),R10组与R0组比较差异无统计学意义(P>0.05);各实验组(R10组、R25组、R50组、R100组)胞浆Cyt-c的含量分别为(0.87±0.19)、(0.97±0.17)、(1.01±0.12)、(1.14±0.07),较R0组的(0.67±0.12)高,R100组与R0组比较差异有统计学意义(x2=9.075,P<0.05)。结论:罗红霉素可以通过激活线粒体凋亡通路促进离体ASMCs的凋亡。
罗红霉素;哮喘;气道重塑;平滑肌细胞;凋亡
上世纪50年代人们就发现大环内酯类抗生素除抗感染作用外还有较强的抗炎作用及免疫调节作用,其对弥漫性泛细支气管炎(diffuse pan-bronchiolitis,DPB)具有确切的疗效[1]。此后,人们开始探索大环内酯类抗生素对其他慢性炎症性疾病(如哮喘、囊性纤维化等)的治疗作用。罗红霉素是新一类的半合成的大环内酯类抗生素,可以降低气道高反应性[2],改善哮喘患者的症状和肺功能[3]。Tada等[4]发现罗红霉素可以抑制慢性哮喘豚鼠气道重塑的发生。有文献报道,罗红霉素可以抑制人冠状动脉平滑肌细胞的增殖[5],阿奇霉素可以促进气道平滑肌细胞(airway smooth muscle cells,ASMCs)的凋亡[6-7]。本课题组早期在体实验显示罗红霉索可部分通过促进ASMCs凋亡抑制气道平滑肌增厚,其促进ASMC凋亡的机制可能与上调P27表达及激活线粒体凋亡通路有关[8]。本实验以离体哮喘大鼠ASMCs作为研究对象,观察罗红霉素的干预作用,并进一步探讨线粒体凋亡通路在ASMCs凋亡中的作用。
1 材料和方法
1.1 材料 SPF级SD雄性大鼠20只,体质量120~140 g,购自上海斯莱克实验动物中心;SM α-actin单克隆抗体(Sigma,USA);小鼠免疫组织化学试剂盒(北京四正柏生物科技有限公司);RPMI1640培养基(HyClone,USA);优级胎牛血清(杭州四季青公司);罗红霉素(Sigma,USA);JC-1线粒体膜电位检测试剂盒(Pierce,USA);BCA蛋白浓度测定试剂盒、小鼠源性α-Tubulin单克隆抗体、辣根过氧化物酶标记山羊抗小鼠IgG、辣根过氧化物酶标记山羊抗兔IgG(江苏碧云天生物工程有限公司);Annexin VFITC/PI KIT(Biovision,USA);Agarose(Biowest,Spain);小鼠源性细胞色素C(cytochrome c,Cytc)单克隆抗体、兔源性VDAC1/Porin多克隆抗体(Abcam,USA)。
1.2 实验方法
1.2.1 ASMCs的体外培养及鉴定:SPF级雄性SD大鼠20只,参照Palmans等[9]的方法复制慢性哮喘模型。模型建立后,分离大鼠支气管树,采用改良组织贴块法[10]培养原代ASMCs,采用差速贴壁法纯化细胞[11]。SM α-actin免疫细胞化学SP法鉴定平滑肌细胞。
1.2.2 实验分组:取第3~第8代培养的细胞,随机分为R0组(不予罗红霉素)和4个实验组(即R10组、R25组、R50组、R100组,罗红霉素终浓度分别为10、25、50、100μg/mL)。用含不同浓度罗红霉素的完全培养基(含10% FBS)培养48 h后,换无血清的培养基培养24 h,然后收集细胞检测各项指标。
1.2.3 Annexin V/PI双标记流式细胞术检测早期凋亡细胞:收集约2×105个细胞及旧培养基,按照Annexin V-FITC/PI KIT说明书的步骤进行操作,经流式细胞仪检测。重复实验4次。
1.2.4 JC-1染色流式细胞术检测线粒体膜电位(Δ Ψm):收集2×105个细胞,按照JC-1线粒体膜电位检测试剂盒说明书进行操作,流式细胞仪检测。重复实验4次。
1.2.5 Western blot法检测胞浆内及线粒体内Cyt-c的蛋白水平:收集约5×107个细胞,按Pierce线粒体分离试剂盒抽提线粒体和胞浆蛋白,BCA法测定蛋白浓度。以每泳道50μg蛋白的量进行定量分析,化学发光法显示印迹条带,分别测定胞浆和线粒体Cyt-c的表达。胞浆Cyt-c以α-Tubulin为内参,线粒体Cyt-c以VDAC1/Porin为内参。重复实验3次。
1.3 统计学处理方法 应用SPSS 11.5统计软件进行分析。所有数据均为计量资料,以±s表示。正态分布资料的组间差异比较采用单因素方差分析,方差齐性者采用LSD法,方差不齐者采用Dunnett’s T3检验;非正态分布资料的组间差异比较采用Kruskal-Wallis H检验,组间两两比较采用Nemenyi法检验。P<0.05为差异有统计学意义。
2 结果
2.1 离体培养的ASMCs的鉴定 取第3代培养细胞制成细胞爬片,对平滑肌细胞特异的α-actin进行免疫细胞化学SP法染色,显微镜观察,95%以上细胞呈强阳性染色,胞浆呈棕黄色,胞核呈紫蓝色(见图1),证实为平滑肌细胞[11]。
2.2 细胞形态的变化情况 罗红霉素干预48 h后,倒置显微镜下观察,可见R100组细胞形态发生显著改变,绝大多数细胞收缩、变小,胞浆空泡化,颗粒物增多,部分细胞脱壁,符合凋亡细胞形态学改变[6,12];R50组和R25组可见少数细胞形态呈前述改变;R0组和R10组细胞倒置显微镜下观察未见明显形态改变。见图2。

图1 抗SMα-actin免疫细胞化学SP法鉴定ASMCs(×400)
2.3 细胞凋亡情况 实验组(R10组、R25组、R50组、R100组)ASMCs的早期凋亡率分别为(4.6±1.9)%、(5.8±2.9)%、(12.0±5.6)%、(26.9±11.1)%,较R0组的(2.9±1.7)%高。Nemenyi法检验结果显示,R100组与R0组之间差异有统计学意义(x2=13.30,P <0.01)。
2.4 线粒体ΔΨm变化情况 实验组细胞ΔΨm较R0组降低,且随着药物浓度的增加,ΔΨm降低越显著。LSD检验结果显示R100组和R50组显著低于R0组和R10组(P<0.05或0.01);R25组与R0组比较,差异有统计学意义(P<0.05);而R10组与R0组比较差异无统计学意义(P>0.05)。详见表1。

图2 倒置显微镜下各组细胞形态(×200)
表1 各组细胞线粒体ΔΨm比较(n=4,±s)
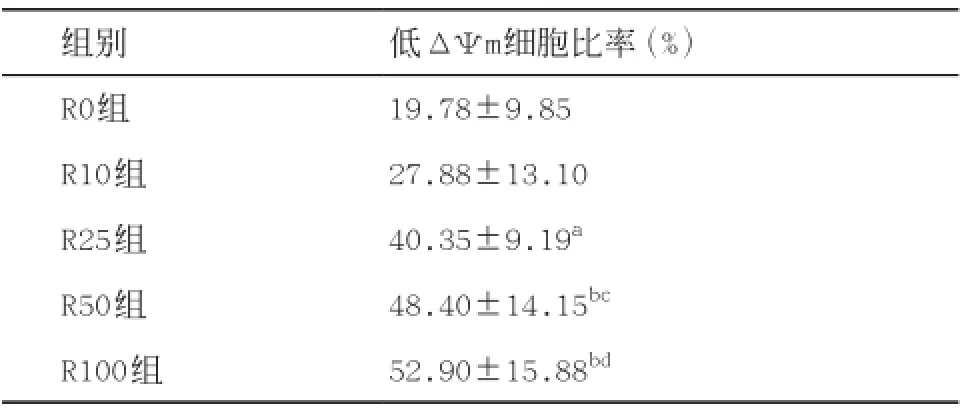
表1 各组细胞线粒体ΔΨm比较(n=4,±s)
与R0组比:aP<0.05,bP<0.01;与R10组比:cP<0.05,dP<0.01
组别 低ΔΨm细胞比率(%)R0组 19.78±9.85 R10组 27.88±13.10 R25组 40.35±9.19aR50组 48.40±14.15bcR100组 52.90±15.88bd
2.5 线粒体Cyt-c的释放情况 实验组细胞胞浆内Cyt-c的含量较R0组高,且随药物浓度的增高而增高,而线粒体内Cyt-c的含量较R0组降低,且随药物浓度的增高,降低越显著。Kruskal-Wallis H检验结果为x2=11.167,P=0.025。采用Nemenyi法进行组间两两比较,发现R100组与R0组之间差异有统计学意义(x2=9.075,P<0.05)。详见图3和表2。
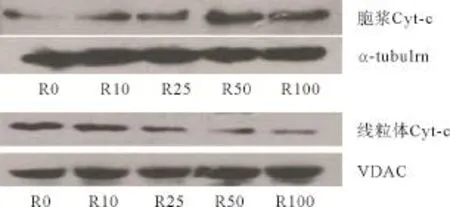
图3 罗红霉素对ASMCs线粒体内和胞浆内Cyt-c的影响
3 讨论
ASMCs增生和肥大直接导致气道壁增厚。此外,ASMCs能合成和分泌促炎症因子、黏附因子、趋化因子等,使气道炎症持续存在[13]。Johnson等[14]观察离体培养的ASMCs(来自肺部手术标本)的生物学特点发现,来自哮喘患者和无气道疾病患者的ASMCs在体外培养时,虽然细胞的形态相似,但前者增殖明显快于后者,说明离体培养的ASMCs保留或部分保留原有的生物学特性。本实验所采用的ASMCs来自慢性哮喘大鼠气道重塑模型,旨在模拟病理状态下的细胞生物学特性,使得研究结果更具临床指导意义。
表2 胞浆和线粒体Cyt-c含量的比较(n=3,±s)
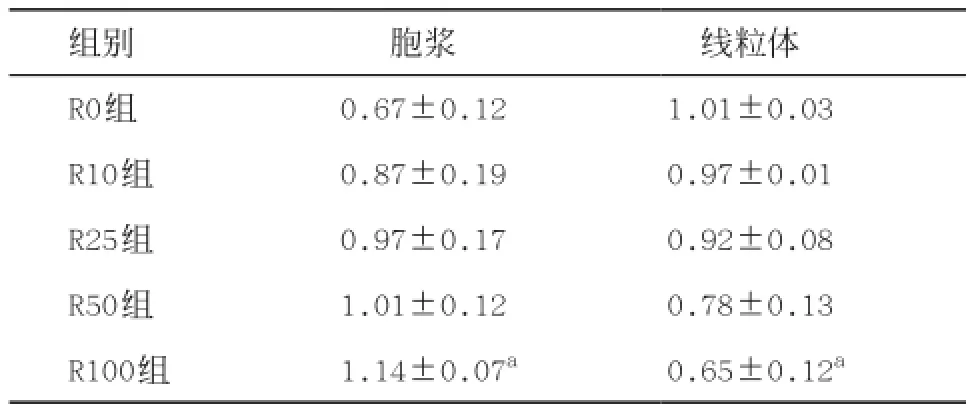
表2 胞浆和线粒体Cyt-c含量的比较(n=3,±s)
与R0组比:P<0.05
组别 胞浆 线粒体R0组 0.67±0.12 1.01±0.03 R10组 0.87±0.19 0.97±0.01 R25组 0.97±0.17 0.92±0.08 R50组 1.01±0.12 0.78±0.13 R100组 1.14±0.07a 0.65±0.12a
磷酯酰丝氨酸(phospholipid phosphatidylserine,PS)主要分布在细胞膜内侧,在细胞发生凋亡的早期,虽然细胞膜尚完整,但PS会外翻到细胞膜外侧[15],通过荧光探针标记的Annexin V与之结合能检测到PS的外翻[16]。而坏死或凋亡晚期细胞,由于细胞膜的完整性丧失,Annexin V能与PS结合,但同时细胞核会被碘化丙啶(PI)着色[16]。这样可以将凋亡细胞、坏死细胞和正常活细胞区别开来。本实验通过流式细胞仪检测Annexin V-FITC(+)和PI(-)细胞群所占比率(即早期凋亡率),R0组为(2.9±1.7)%,而4个实验组按罗红霉素浓度从低到高分别为(4.6±1.9)%、(5.8±2.9)%、(12.0±5.6)%、(26.9±11.1)%,均高于R0组,证实了罗红霉素能够诱导ASMCs发生凋亡,且呈量效关系,与倒置显微镜下所见细胞形态学改变相一致。
线粒体凋亡通路以线粒体ΔΨm下降和线粒体释放Cyt-c入胞浆为主要特征[17]。目前认为,线粒体释放Cyt-c入胞浆是线粒体凋亡通路的标志性事件[18]。本实验通过分离线粒体和胞浆蛋白,使用蛋白印迹分别对其Cyt-c的含量进行半定量测定,结果表明,各实验组胞浆内Cyt-c含量较R0组增多,而对应的线粒体内Cyt-c含量较R0组降低,且呈量效关系,提示罗红霉素呈浓度依赖性地促进线粒体释放Cyt-c入胞浆,与吴斌等[8]的研究结果一致。线粒体ΔΨm的下降被认为是细胞凋亡级联反应过程中最早发生的事件,它发生在细胞核凋亡特征出现之前[19]。线粒体ΔΨm的下降一旦进入不可逆过程,则引起线粒体膨胀及外膜的破裂,各种凋亡因子会通过线粒体通透转换孔(mitochondrial permeability transition pole,MPTP)或破裂的外膜直接泄漏入胞浆,而致细胞凋亡发生[20]。本实验通过JC-1染色检测线粒体ΔΨm的变化,结果发现实验组低ΔΨm细胞的比率较R0组增高,而高Δ Ψm细胞的比率较R0组减少,说明在罗红霉素作用下,ASMCs的线粒体ΔΨm降低,与线粒体Cyt-c释放结果一致。当罗红霉素浓度≥25μg/mL时,能引起线粒体ΔΨm显著下降(P<0.05或0.01)。结合预实验结果,当罗红霉素浓度达到150 μg/mL时,倒置显微镜下可见绝大多数细胞脱壁、肿胀、破碎,呈现出坏死征象,而当罗红霉素浓度为100μg/mL时并未见明显细胞坏死征象,提示25~100μg/mL可能为有效的药物组织浓度。
综上所述,罗红霉素能激活线粒体凋亡通路,且呈浓度依赖性,从而促进离体哮喘大鼠ASMCs发生早期凋亡。
[1] Labro MT.Anti-inflammatory activity of macrolides:a new therapeutic potential?[J].J Antimicrob Chemoth,1998,41 (Suppl 2):37-46.
[2] Koh Y,Lee M,Sun Y,et al.Effect of roxithromycin on airway responsiveness in children with bronchiectasis:a doubleblind,placebo-controlled study[J].Eur Respir J,1997,10(5):994-999.
[3] Shimizu T,Kato M,Mochizuki H,et al.Roxithromycin reduces the degree of bronchial hyperresponsiveness in children with asthma[J].Chest,1994,106(2):458-461.
[4] Tada M ,Saqara H,Okada S,et al.Effects of roxithromycin on a guinea pig model for chronic asthma [J].Jpn J Antibiot,2004,57(Suppl A):76-78.
[5] Tomita H,Osanai T,Toki T,et al.Roxithromycin is an inhibitor of human coronary artery smooth muscle cells proliferation:a potential ability to prevent coronary heart disease[J].Atherosclerosis,2005,182(1):87-95.
[6] Stamatiou R,Boukas K,Paraskeva E,et al.Azithromycin reduces the viability of human bronchial smooth muscle cells [J].J Antibiot,2010,63(2):71-75.
[7] Stamatiou R,Paraskeva E,Boukas K,et al.Azithromycin has an antiproliferative and autophagic effect on airway smooth muscle cells[J].Eur Respir J,2009,34(3):721-730.
[8] 吴斌,王秀芬,戴元荣.罗红霉素对支气管哮喘大鼠气道平滑肌细胞凋亡及P27KIP-1蛋白表达的影响[J].中华结核与呼吸杂志,2010,33(12):937-939.
[9] Palmans E,Kips JC,Pauwels RA.Prolonged allergen exposure induces structural airway changes in sensitized rats[J].Am J Resp Crit Care,2000,161(2):627-635.
[10] 吴海亚,戴元荣,尹娟.改良组织贴块法培养大鼠气道平滑肌细胞[J].温州医学院学报,2010,40(6):571-573.
[11] 卓致远,黄茂,崔学范,等.组织贴块法培养小鼠气道平滑肌细胞[J].中国组织化学与细胞化学杂志,2007,16(2):247-250.
[12] Ly JD,Grubb DR,Lawen A.The mitochondrial membrane potential (Δψm) in apoptosis; an update[J].Apoptosis,2003,8(2):115-128.
[13] Hirst SJ.Regulation of airway smooth muscle cell immunomodulatory function:role in asthma [J].Resp Physiol Neurobi,2003,137(2):309-326.
[14] Johnson PRA,Roth M,Tamm M,et al.Airway smooth muscle cell proliferation is increased in asthma[J].Am J Resp Crit Care,2001,164(3):474-477.
[15] Glander HJ.Binding of annexin V to plasma membranes of human spermatozoa:a rapid assay for detection of membrane changes after cryostorage[J].Mol Hum Reprod,1999,5(2):109-115.
[16] Vermes I,Haanen C,Steffens-Nakken H,et al.A novel assay for apoptosis flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled annexin V [J].J Immunol Methods,1995,184(1):39-51.
[17] Gulbins E,Dreschers S,Bock J.Role of mitochondria in apoptosis[J].Exp Physiol,2003,88(1):85-90.
[18] Garrido C,Galluzzi L,Brunet M,et al.Mechanisms of cytochrome c release from mitochondria[J].Cell Death Differ,2006,13(9):1423-1433.
[19] Susin SA,Lorenzo HK,Zamzami N,et al.Molecular characterization of mitochondrial apoptosis-inducing factor[J].Nature,1999,397(6718):441-446.
[20] Zamzami N,Marchetti P,Castedo M,et al.Reduction in mitochondrial potential constitutes an early irreversible step of programmed lymphocyte death in vivo[J].J Exp Med,1995,181(5):1661-1672.
(本文编辑:丁敏娇)
The effect and the mechanism of Roxithromycin on apoptosis of airway smooth muscle cells from asth- matic rats in vitro
WU Haiya1,DAI Yuanrong2,YING Binyu1.1.Intensive Care Unit,the Second AffiliatedHospital of Wenzhou Medical University,Wenzhou,325027; 2.Department of Respiratory Medicine,the Second Affiliated Hospital of Wenzhou Medical University,Wenzhou,325027
Objective:To observe the effects of Roxithromycin on apoptosis of airway smooth muscle cells ASMCs) in vitro and the role of mitochondrial pathway in apoptosis of ASMCs.Methods:ASMCs from asthmatic rats were cultured in vitro and intervened with various concentrations of Roxithromycin for 48 hours.Early apoptotic cells were detected through flow cytometry (FCM) after stained with Annexin V/PI; Alteration of mitochondrial membrane potential (ΔΨm) was also examined by FCM after stained with JC-1; Cytochrome C (Cyt-c) both in mitochondria and cytoplasm was analyzed by Western Blot.Results:Roxithromycin could induce the apoptotic death of ASMCs in vitro:Early apoptotic rate in experimental group (R10,R25,R50,R100) after 48 h intervention was (4.6±1.9)%,(5.8±2.9)%,(12.0±5.6)% and (26.9±11.1)%,respectively,compared to control 2.9±1.7)%.And there was a significant difference (x2=13.30,P<0.01) between the group R100 and the control.RXM induced loss of ΔΨm:The proportion of low ΔΨm cells of the experimental group (R10,R25,R50,R100) was (27.88±13.10)%,(40.35±9.19)%,(48.40±14.15)% and (52.90±15.88)%,respectively,compared to the conrol group (19.78±9.85)%.The indexes of group R100 and R50 were significantly lower than that of group R0 and R10 (P<0.05 or 0.01).The difference between group R25 and R0 was also statistically significance (P<0.05).But there was no statistical difference between group R10 and R0.Roxithromycin could induce Cyt-c release rom mitochondria into the cytosol:The content of cytosolic Cyt-c in group R10,R25,R50,R100 was respecively (0.87±0.19),(0.97±0.17),(1.01±0.12),(1.14±0.07),higher than that in the control group (0.67±0.12).Therewas a significant difference between the group R100 and R0 (x2=9.075,P<0.05).Conclusion:Roxithromycin can induce apoptosis of ASMCs in vitro via activating mitochondrial pathway.
Roxithromycin; asthma; airway remodeling; smooth muscle cells; apoptosis
R562.2
A
10.3969/j.issn.2095-9400.2015.04.005
2014-08-07
浙江省自然科学基金资助项目(Y2080466);浙江省医药卫生科技计划项目(2009A144)。
吴海亚(1981-),女,浙江永嘉人,主治医师,硕士。
戴元荣,教授,主任医师,硕士生导师,Email:daiyr@126.com。
