黄酒中生物胺的检测方法改进
2015-12-27彭金龙张凤杰叶小龙
彭金龙,胡 健,张凤杰,肖 蒙,叶小龙,倪 斌
(1.上海金枫酒业股份有限公司,上海201501;2.上海石库门酿酒有限公司,上海201501;3.中国食品发酵工业研究院,北京100027)
黄酒中生物胺的检测方法改进
彭金龙1,2,胡 健1,2,张凤杰3,肖 蒙1,2,叶小龙1,2,倪 斌1,2
(1.上海金枫酒业股份有限公司,上海201501;2.上海石库门酿酒有限公司,上海201501;3.中国食品发酵工业研究院,北京100027)
本研究在国标GB/T 5009.208—2008基础上简化了样品前处理条件和步骤,改进了检测黄酒中生物胺的方法。经方法学验证,8种生物胺得到了较好分离,标准品线性关系良好,相对标准偏差(RSD)值均<2%,回收率均在92.0%~106.0%,方法具有良好的重复性和回收率。与国标生物胺的检测方法相比,本检测方法操作简单、快速,并且检测结果可靠。
黄酒;生物胺;高效液相色谱法;检测
生物胺(biogenic amines,BA)是一类含氮的低分子质量碱性有机化合物的总称。生物胺存在于多种食品尤其是发酵食品中,如葡萄酒、啤酒、发酵香肠和黄酒等[1-2]。它是动物、植物和多数微生物体内活性细胞中必不可少的组成部分,但是,高浓度的生物胺不仅会严重影响食品的风味甚至改变其成分,还会对人体有着严重的毒害作用,如引起诸如头痛、恶心、人神经系统和心血管系统损伤等,严重的可危及生命[3-4]。现有研究表明,黄酒在发酵过程中产生生物胺,每个批次每个品种的黄酒中生物胺种类和含量有很大不同[5-6],鉴于生物胺具有毒性,因此对于黄酒生产企业追踪检测每批次黄酒中生物胺的含量必不可少。
根据现有报道,生物胺含量的测定方法有很多,如高效液相色谱法(high performance liquid chromatography,HPLC)、离子色谱法(ion chromatography,IC)、气相色谱法(gas chromatography,GC)、毛细管电泳法(capillary electrophoresis,CE)、薄层色谱法(thin layer chromatography,TLC)、生物传感器法(biosensor method)、酶联免疫法(enzyme linked immunosorbent assays,SLISA)等[7-9]。目前,食品中生物胺含量的测定国标GB/T 5009.208—2008《食品中生物胺含量的测定》中采用HPLC法[10]。用国标法测定黄酒中生物胺含量,由于国标法是针对所有食品中生物胺测定而制定的,实际操作时发现,国标法制备样品操作复杂、步骤繁琐、非常耗时,测定一个样品需要一个工作日时间,用此方法对于一个每日都生产黄酒的企业追踪检测酒中生物胺含量非常不便。专门针对黄酒中生物胺的检测方法,虽然现已有几篇相关研究报道,但是都存在可以改进的地方。谢铭[11]采用HPLC法检测黄酒中生物胺含量,但是其衍生后萃取、旋转蒸发等步骤费时复杂,并且仅对4种生物胺进行分析。陆永梅等[12]仅对5种生物胺进行分析检测。玉澜等[13]所述方法离子液体萃取和样品处理方法比较费时。彭祺等采用液质联用法检测生物胺,虽然不需要衍生步骤,但是样品前处理更加费时。华永有等[14-15]采用荧光法检测生物胺,但是样品处理与现行报道的国标法相似。
鉴于此,本研究在《食品中生物胺含量的测定》国标法基础上修改部分处理方法,建立一种黄酒中8种常见生物胺的检测方法。主要修改如下:首先将国标法中样品前处理中的净化和萃取步骤删除,改为将黄酒稀释的方式,简化了前处理步骤;其次,待样品衍生步骤完成之后,本研究删除了国标方法中氮气吹干和萃取的步骤(不影响后续色谱分析),节省了部分操作时间;同时,对衍生时试剂添加量进行了调整,使反应体系在最佳pH和浓度下进行,并对后续色谱分离条件进行了修改,旨在前人研究和国标法的基础上简化前处理条件和步骤,建立一种简单、快速、准确、安全的黄酒中主要的8种生物胺的检测方法。
1 材料与方法
1.1 材料与试剂
黄酒:上海金枫酒业股份有限公司;纯净水:杭州娃哈哈集团有限公司。
色胺(try)、β-苯乙胺(phe)、腐胺(put)、尸胺(cad)、组胺(his)、酪胺(tyr)、亚精胺(spd)、精胺(spm)标样(色谱纯)、丹磺酰氯(色谱纯)、1,7二氨基庚烷(色谱纯)、乙腈(色谱纯):美国Sigma公司。无水碳酸钠、氢氧化钠、碳酸氢钠、盐酸、谷氨酸钠(分析纯):国药集团药业股份有限公司。
1.2 仪器与设备
Waters 2695高效液相色谱仪(配紫外检测器):美国Waters公司;XW-80A旋涡混合器:上海青浦沪西仪器厂;DKZ系列电热恒温:上海一恒科技有限公司;BS210S分析天平:北京赛多利斯天平有限公司;0.45 μm针头微孔滤膜过滤器:上海安谱科学仪器有限公司。
1.3 方法
1.3.1 色谱条件
色谱柱:安捷伦C18柱(5 μm,150 mm×4.6 mm);柱温:30℃;流速:1.0 m L/min;进样10.0 μL;紫外检测波长为254 nm;流动相A乙腈溶液,B超纯水;采用梯度洗脱,洗脱程序见表1。

表1 HPLC梯度洗脱程序Table 1 Gradient elution program of HPLC
1.3.2 样品的衍生
1 m L预处理好的样品,加入50 μL 1,7-二氨基庚烷(0.1 g/L,0.1 mol/L HCl溶液配制)内标工作液,然后加入0.5 m L的饱和NaHCO3溶液进行缓冲,再加入1 m L的衍生试剂丹磺酰氯溶液(10 g/L,丙酮溶液配制),混匀后,避光置于60℃的水浴中保温30 m in,中间取出振荡一次。衍生完后,加入100 μL谷氨酸钠(50 g/L,饱和碳酸氢钠溶液配制)溶液中断反应,并置于60℃水浴锅中继续保温15 min去除多余的丹磺酰氯。最后用乙腈调整至5 m L,再将其用0.45 μm有机滤膜过滤,待测。
1.3.3 标准溶液的制备
准确称取各种生物胺标准品,用0.1 mol/L HCl溶液配制成质量浓度为1 000 mg/L(以生物胺单体计)的标准储备液,4℃冰箱保存。使用前,分别吸取各生物胺单组分标准储备液1 m L,置于10 m L容量瓶中,用0.1 mol/L HCl溶液定容,配制成100mg/L的8种生物胺混合标准品工作液,4℃保存待用。
1.3.4 样品预处理
将黄酒酒样5 m L(黄酒发酵醪液需过滤)与5 m L 0.1 mol/L HCl混合均匀,取1 m L混合好的样品液按照以上方法衍生待测(稀释倍数为2倍)。
1.3.5 标准曲线的制作和检出限
100 mg/L的混合标准品工作液,用0.1 mol/L HCl分别稀释至0.1 mg/L、0.5 mg/L、1.0 mg/L、2.0 mg/L、5.0 mg/L、10.0 mg/L、20.0 mg/L、40.0 mg/L,然后按照上述方法衍生,待测。按照各标准品峰面积与内标峰面积的比值对相应的标准溶液质量浓度作标准曲线,计算标准曲线的回归方程及相关系数。
对质量浓度为0.1 mg/L的混合标准品衍生物用乙腈适当稀释,以信噪比(S/N)>3作为检出限的判断标准。1.3.6精密度和加标回收率试验
取某一种黄酒样品,先用本研究所述的方法测定其生物胺的含量,再取5 m L此黄酒样品置于10 m L容量瓶中,再加入8种生物胺标准混合溶液0.05 m L(单体质量浓度为100 mg/L),相当于添加5 mg/L的含量,用0.1 mol/L HCl溶液定容至刻度,进行5次重复回收试验,扣除样品中空白试验生物胺的含量,求得其添加回收率,并计算添加相对标准偏差(relative standard deviation,RSD),即重复性。
1.3.7 样品生物胺的检测
将黄酒样品按照国标GB/T 5009.208—2008《食品中生物胺含量的测定》中所述方法测定其生物胺含量,平行测定3次,并与本研究所述方法的测定结果相对比。
1.3.8 数据处理
利用SPSS Statistics 17.0和Excel 2010等软件进行数据分析,检测结果采取均值±标准差形式。本文检测结果表中,同一列数据上不同字母上标标记表示在P<0.05水平上进行方差检验,差异显著。
2 结果与分析
2.1 标准曲线的回归方程和检出限
按1.3.3中所述方法配制标准溶液,再按照1.3.2所述方法衍生,通过HPLC分析,生物胺分离高效液相色谱如图1所示,以生物胺质量浓度(X)为横坐标,峰面积为(Y)为纵坐标,求得标准曲线的回归方程和相关系数如表2所示。
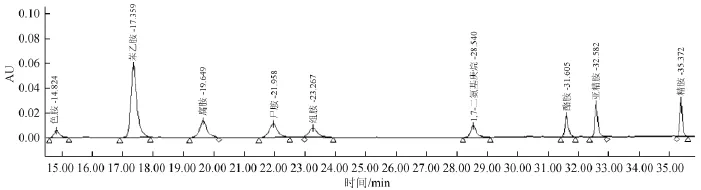
图1 生物胺标准品高效液相色谱图Fig.1 HPLC chromatogram of biogenic amine standards

表2 生物胺标准曲线的回归方程、相关系数、线性范围和检出限Table 2 Regression equations,correlation coefficients,linearity range and detection limits o f biogenic amine
由图1可知,8种生物胺得到较好分离,并且其与内标峰无重叠。由表2可知,8种生物胺的峰面积与其相应质量浓度呈线性关系,相关系数均>0.998 0,其中色胺和苯乙胺的相关系数R达到0.999 9,线性范围为0.1~40.0 mg/L,结果表明,可以满足样品测定的要求。
以信噪比(S/N)>3作为检出限的判断标准,尸胺的检出限为0.01mg/L,色胺、亚精胺、精胺的检出限为0.03mg/L,苯乙胺的检出限为0.04 mg/L,组胺的检出限为0.05 mg/L,腐胺和酪胺的检出限为0.06 mg/L。结果表明,该方法的灵敏度高,可以满足测定样品的要求。
2.2 精密度和加标回收率试验
8种生物胺的添加回收率的测定结果见表3。由表3可知,8种生物胺的回收率分别为色胺96.0%、苯乙胺98.0%、腐胺102.0%、尸胺104.0%、组胺98.0%、酪胺100.0%、亚精胺92.0%、精胺106.0%,可见该方法的准确度高。对添加标准样品后的黄酒样品连续进样5次的试验中,色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺测定结果的RSD值为0.14%~1.64%,8种生物胺的RSD值均<2%,故测量方法的重复性好,精密度符合样品检测的要求。
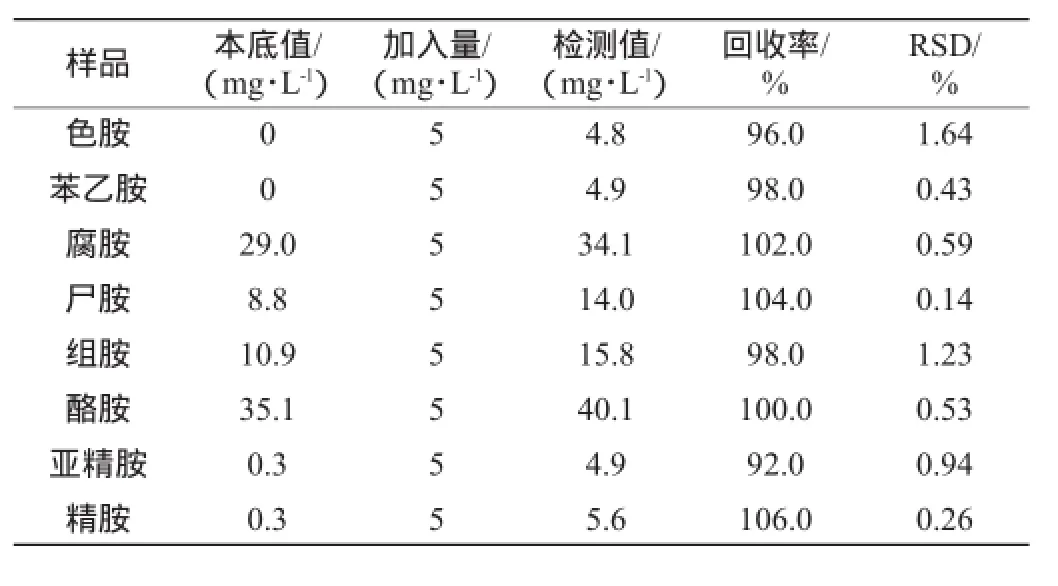
表3 8种生物胺的精密度及回收率试验结果Table 3 Results of precision and recovery rate tests for eight kinds of biogenic amine
2.3 样品的检测试验
对某一黄酒样品,将国标法测定的生物胺结果与本研究所述方法测定生物胺的结果相比较,结果见表4。

表4 国标法与本方法测定黄酒样品中生物胺的含量Table 4 Determination of biogenic amine content in Chinese rice wine by National Standard method and the improved method mg/L
由表4可知,通过两种方法所测得的此黄酒样品只含有6种生物胺,分别是腐胺、尸胺、组胺、酪胺、亚精胺、精胺。对比两种方法检测的生物胺含量,通过ANOVA检验可知,两种方法测定样品中的生物胺含量,所测结果差异不显著,并且所有结果的标准差均在0.5以内,说明此色谱工作性能稳定。
3 结论
采用国标法GB/T 5009.208—2008《食品中生物胺含量的测定》检测黄酒中生物胺,黄酒样品需要进行净化、萃取,并且衍生完后还需去杂质等步骤,这需要耗费大量时间以及需要用到有毒试剂,这不利于黄酒企业生产实时追踪检测产品中的生物胺。本研究在前人研究基础上,以丹磺酰氯为衍生试剂,1,7-二氨基庚烷为内标,采用HPLC法,通过稀释简化样品前处理条件和步骤,改进了检测黄酒中生物胺的方法。
通过本研究所述方法分析主要的8种生物胺,结果表明,8种生物胺可得到较好分离,各生物胺标准品的衍生物线性关系良好(R>0.998 0),各生物胺回收率在92.0%~106.0%,本方法具有良好的准确度、重复性和精密度。对于检测黄酒样品中的生物胺,与国标GB/T 5009.208—2008《食品中生物胺含量的测定》中所述的生物胺检测方法相比,本检测方法操作更简单、快速,并且检测结果可靠。
[1]孔维府,范春艳,张翛翰.论葡萄酒中生物胺生成的影响因素及其检测方法[J].中国酿造,2010,29(6):18-21.
[2]王颖,邱璠,韩北忠,等.食品中的生物胺及其检测方法[J].中国酿造,2011,30(10):1-5.
[3]ONAL A.A review:current analytical methods for the determination of biogenic amines in foods[J].Food Chem,2007,103(7):1475-1486.
[4]何庆华,吴永宁,印遇龙.食品中生物胺研究进展[J].中国食品卫生杂志,2007,19(5):451-454.
[5]LU Y M,LU X,CHEN X H,et al.A survey of biogenic amines in Chinese rice wines[J].Food Chem,2007,100(4):1424-1428.
[6]栾同青.黄酒酿造过程生物胺变化规律及其产生菌株研究[D].济南:齐鲁工业大学硕士论文,2013.
[7]范春艳,孔维府,潘秋红,等.葡萄酒中8种生物胺的RP-HPLC检测方法的研究[J].中国酿造,2010,29(11):168-171.
[8]LOUKOU Z,ZOTOU A.Determination of biogenic amines as dansyl derivatives in alcoholic beverages by high-performance liquid chromatography with fluorimetric detection and characterization of the dansylated amines by liquid chromatography-atmospheric pressure chemical ionization mass spectrometry[J].J Chromatography A,2003,996(1): 103-113.
[9]ANLI R E,VURAL N,YILMAZ S.The determination of biogenic amines in Turkish red wines[J].J Food Compos Anal,2004,17(1): 53-62.
[10]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.208—2008食品中生物胺含量的测定[S].北京:中国标准出版社,2008.
[11]谢铭.黄酒中生物胺的分析研究[J].广州化工,2010,38(4):139-141.
[12]陆永梅,董明盛,吕欣,等.高效液相色谱法测定黄酒中生物胺的含量[J].食品科学,2006,27(1):196-199.
[13]玉澜,谢济运,蓝峻峰.黄酒中生物胺的测定[J].安徽农业科学,2012,40(11):6498-6500.
[14]华永有,周芬霞,林宏琳,等.HPLC-FLD法检测黄酒中9种生物胺[J].中国卫生检验杂志,2014,24(6):761-764.
[15]张凤杰,薛洁,王异静,等.黄酒中生物胺的形成及其影响因素[J].食品与发酵工业,2013,39(2):62-68.
Improvement of biogenic amine detection method in Chinese rice wine
PENG Jinlong1,2,HU Jian1,2,ZHANG Fengjie3,XIAO Meng1,2,YE Xiaolong1,2,NI Bin1,2
(1.Shanghai Jinfeng Wine Co.,Ltd.,Shanghai 201501,China;2.Shanghai Shikumen Wine Co.,Ltd.,Shanghai 201501,China; 3.China National Research Institute of Food and Fermentation Industries,Beijing 100027,China)
In this study,the detection method of biogenic amines in Chinese rice wine was improved by simplifying the pre-processing conditions and steps of sample on the basis of the National Standard 5009.208—2008.By the verification of methodology,eight biogenic amines got a better separation,the standard showed good linear relationship,the relative standard deviation was less than 2%,the recovery was 92.0%-106.0%.This improved method had good linearity,repeatability and recovery rate.Compared with the detection method of biogenic amines in the National Standard,this detection method was simpler,faster,and the detection results were more accurate.
Chinese rice wine;biogenic amine;HPLC;detection
O657.7
A
0254-5071(2015)03-0141-04
10.11882/j.issn.0254-5071.2015.03.034
2015-02-03
国家科技支撑项目(2012BAK17B11)
彭金龙(1987-),男,助理工程师,硕士,研究方向为食品检测与产品开发。
