金纳米簇荧光猝灭型探针高灵敏检测精胺
2017-08-14安晓刚杜捷齐伟男刘璐李小燕甘海
安晓刚+杜捷+齐伟男+刘璐+李小燕+甘海玲+卢小泉


摘 要 以紫脲酸铵(Murexide,MU)为还原剂及保护剂,采用水热合成法,合成了紫脲酸铵保护的荧光金纳米簇(MU-Au NCs),合成方法简单、快速。基于精胺对MU-Au NCs的荧光猝灭现象,建立了快速、超灵敏检测精胺的“Turn off”型荧光分析方法,在优化的条件下,本方法检测精胺的线性范围为0.003~300 μmol/L,检测限为1 nmol/L(S/N=3)。本方法为构建精胺生物传感器及实际样品检测提供了理论基础和参考。
关键词 紫脲酸铵; 金纳米簇; 荧光猝灭; 精胺; 生物胺
1 引 言
生物胺(Biogenic amines, BA)主要包括精胺(Spermine, SPM)、腐胺(Putrescine, PUT)和亚精胺(Spermidine, SPD), 通过微生物产生的活性物质在食物的储存和加工过程中形成[1,2], 广泛存在于食品中[1,3], 易对生物胺敏感人群健康造成危害[1,3,4]。研究发现, 癌症患者体内 SPM 水平会显著增加[5], 临床上将 SPM 水平作为早期诊断肿瘤的标志物和治疗效果的评价指标之一, 但对于SPM代谢改变的具体机制尚不完全清楚。因此, 检测生物胺含量对于保证消费者的健康具有重要意义。然而, 除个别规定外[1], 我国以及欧洲对于食物中生物胺含量均未做出明确限定和要求。近年来, 由于食品安全问题频频发生, 引起了人们对食品安全的高度重视, 食品中生物胺含量检测成为近年研究热点。目前, 生物胺检测分析方法主要包括高效液相色谱法(HPLC)[6,7]、毛细管电泳法[8,9]等, 这些方法对操作人员的技术要求较高, 操作繁琐。因此, 灵敏、有效的检测方法, 对于食品质量监测、保护消费者健康具有重要的现实意义。
灵敏度是衡量检测方法性能的重要指标。近些年出现的一些生物分子超灵敏检测方法, 因其简单、高效、灵敏, 在临床诊断[10]、食品质量控制[11]和环境监测等领域得到广泛应用。传统的标记物包括电化学活性分子[12]、荧光染料[13]、高量子产率的聚合物[14]以及酶如辣根过氧化物酶(HRP)[15]等, 但这些材料通常存在荧光性质不稳定、容易光漂白等不足。贵金属纳米簇是近年来兴起的荧光标记材料, 具有低毒、荧光性质稳定、生物相容性好等优点, 极大提高了检测的灵敏度[16,17], 弥补了传统标记物的不足, 而且提高了信号放大能力和分子检测的灵敏度, 且方法简便。
紫脲酸铵(Murexide, MU)是一种红紫酸铵盐, 微溶于冷水, 能与很多阳离子形成不同颜色的络合物, 常被作为一种络合滴定指示剂用于分析化学络合滴定[18]、电极表面修饰[18~21]及生物分子检测[22~26]。由于其具有分子量小、对pH值敏感、还原性强, 能与很多阳离子形成不同颜色的络合物的优点, 常作为生物分子检测指示剂[24]。如Grudpan等[24]将 MU 作为流动注射法检测 Ca2+的颜色指示剂; Shamsipur等[27]将 MU 用于制备铜镍配合物。
本研究以紫脲酸铵为还原剂及保护剂, 采用简单、快速的水热法, 合成了具有蓝色荧光、荧光性质稳定、生物相容性好、分散性以及水溶性好的金纳米簇(MU-Au NCs)。基于精胺对其的荧光猝灭现象, 建立了快速、超灵敏检测精胺的“Turn Off”型荧光分析方法, 对精胺线性检测范围为0.003~300 μmol/L, 检出限为 1 nmol/L。本研究不仅拓展了金纳米簇的种类, 而且建立了简单、超灵敏检测精胺的分析方法, 为生物实际样品及食物中生物胺含量检测提供了理论依据和技术参考。
2 实验部分
2.1 仪器与试剂
安捷伦-G9800A 荧光分光光度计(美国Agilent公司); TENSOR-37 型傅立叶变换红外光谱仪(德国布鲁克公司); JEM-2100 高分辨率透射电子显微镜(日本电子株式会社); Veeco Nanoscope 3D 原子力显微镜(美国 Veeco Nanoscope公司); FLS 920 稳态/瞬态荧光光谱仪(美国 Edinbergh 公司); PB-10 PH 计(德国 Sartorius 公司); FA 2004型分析电子天平(上海良平仪器仪表有限公司); ZD-A 21 真空冷冻干燥机(南京载智自动化设备有限公司);
氯金酸(HAuCl4, 分析纯, 金含量> 47.8%, 天津市光复精细化工研究所); 精胺(纯度 98%, Aladdin公司); 紫脲酸铵(分析纯, Aladdin 公司); 谷胱甘肽(纯度 99%, 北京百灵威科技有限公司); 透析袋(MWCO 500~1000 Da, 上海源叶生物科技有限公司); 其余试剂均购于国药集团化学试剂有限公司, 纯度均大于 99%; 实验用水为二次蒸馏水。
2.2 实验方法
2.2.1 紫脲酸铵保护的金纳米簇(MU-Au NCs)的合成 在4.48 mL 二次蒸馏水中加入 520 μL 48 mmol/L氯金酸溶液, 30℃恒溫水浴和磁力搅拌下, 将 5 mL 10 mmol/L紫脲酸铵溶液逐滴加到上述溶液中, 反应 30 min后取出, 14000 r/min离心20 min, 取上清液, 透析 48 h, 收集透析内液, 即得到紫脲酸铵保护的金纳米簇(MU-Au NCs), 4℃保存, 备用。
2.2.2 MU-Au NCs性质表征 采用荧光光谱、傅里叶变换红外光谱、荧光寿命分析及高分辨透射电子显微镜对制备的 MU-Au NCs 形貌、粒径大小及光学性能进行了表征。荧光光谱采用 Agilent G 9800A 荧光分光光度计测定, 激发、发射狭缝宽度均设定为5; 荧光寿命分析采用 FLS 920 稳态/瞬态荧光光谱仪测定, 参比溶液为LUDOX 硅溶胶(30% 硅胶水溶液); 原子力显微镜(AFM)图谱采用美国 Veeco Nanoscope 3D 原子力显微镜测得, 将样品分散在无水乙醇中, 用表面打磨干净云母片(或硅片)沾取, 自然晾干, 进行样品扫描。
2.2.3 对精胺的检测 取 2 mL MU-Au NCs 溶液用 pH 7.0 的 PBS 缓冲液稀释至 3 mL, 分别加入500 μL不同浓度的标准精胺溶液(以二次蒸馏水为空白样品), 混合均匀, 反应 30 min 后进行荧光检测。空白样与待测样品荧光强度差值用ΔF(ΔF=F0-F1)表示, 荧光猝灭程度用(F0-F1)/F0表示, 其中F0和 F1分别代表空白溶液和样品溶液的荧光强度。
2.2.4 样品处理与分析 取5 g 待测冷鲜猪肉样品加入20 mL 的0.4 mol/L 的HClO4, 经匀浆机粉碎匀浆, 4℃, 2500 r/min离心10 min, 收集上清液[28]。对沉淀部分进行再次提取, 方法同上。混合两次提取的上清液, 用0.4 mol/L HClO4定容至25 mL, 然后加入pH 7.0 的 PBS(0.12 mol/L)缓冲液。
取 2 mL MU-Au NCs 溶液, 加入上述样品提取液 1 mL, 分别加入 300 μL浓度为1×108 mol/L, 1×107 mol/L, 1×106 mol/L的标准精胺溶液, 反应 30 min后检测荧光, 平行3次实验, 计算RSD值。
3 结果与讨论
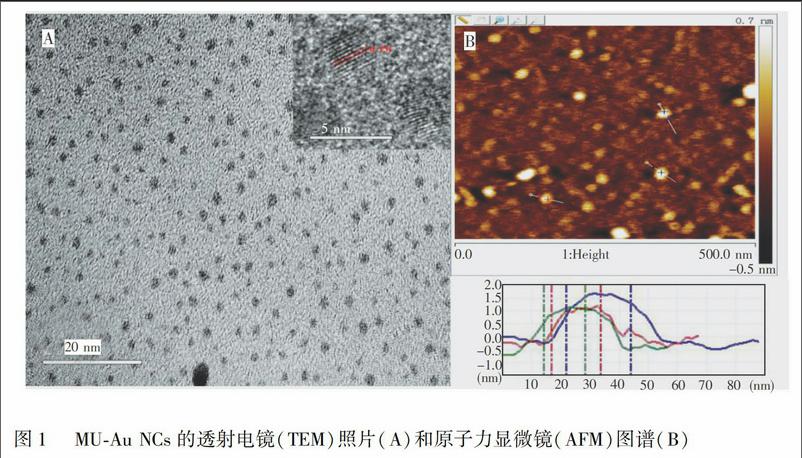
3.1 MU-Au NCs的微观形貌表征
高分辨透射电子显微镜(TEM)及原子力显微镜(AFM)表征结果如图 1所示。透射电镜图谱(图1A)表明, MU-Au NCs 具有良好的分散性, 平均粒径为 2 nm, 晶格明显, 为 0.23 nm, 间距几乎相同, 与金纳米簇的典型特征一致, 证明制备得到的是金纳米簇。AFM图(图1B)显示 MU-Au NCs 呈球形, 高度小于 2 nm。
3.2 MU-Au NCs的红外光谱分析
化学反应前后物质中化学键及官能团的变化可以间接反映化学反应机理。不同物质的傅里叶变换红外光谱图如图2所示。
在紫脲酸铵的红外光谱中, 3658 cm1处为NH 的伸缩振动, 3041 cm1处为 CC 的伸缩振动, 2838 cm1处为CH的伸缩振动, 1690 cm1处为CO的伸缩振动, 1291 cm1处为CO的弯曲振动。对于紫脲酸铵与氯金酸反应制备的金纳米簇(MU-Au NCs), 3735 cm1处为NH的伸缩振动, 3421 cm1处为OH的伸缩振动, 2896 cm1处为CH的伸缩振动, 1632 cm1处为CO的伸缩振动, 1060 cm1处可能为COAu的弯曲振动。对比发现, 紫脲酸铵与氯金酸反应后, NH伸缩振动减弱, 紫脲酸铵于3041 cm1处的CC伸缩振动及 1291 cm1处的CO弯曲振动消失, 1690 cm1处的CO伸缩振动减弱, 于3421 cm1处产生了剧烈的OH的伸缩振动, 并于 1060 cm1处产生了一个新的弯曲振动特征峰, 可能为 COAu的弯曲振动。以上变化表明, 紫脲酸铵与氯金酸发生了相互作用, 紫脲酸铵分子修饰到Au NCs表面。
3.3 MU-Au NCs 的光学性质表征
荧光性质是贵金属纳米簇的主要性质之一。如图 3A 所示, MU-AuNCs 在 330 nm处有紫外吸收峰, 在 280和 335 nm 有荧光激发峰, 在 445 nm 处有荧光发射峰。此金纳米簇溶液在可见光下呈无色透明, 在 365 nm 波长紫外灯下发出蓝色荧光(图3A插图)。荧光寿命分析结果如图3B 所示, MU-Au NCs的荧光寿命持续时间约20 ns, 与参比溶液 LUDOX 相比, 荧光寿命持续时间约是其 3 倍。荧光稳定性实验结果如图3 C所示, 此金簇在1~12月内荧光性质较稳定, 具有良好的荧光性质。
3.4 精胺对MU-Au NCs 荧光猝灭响应
样品检测的特异性对于荧光探针检测的实际应用是非常重要的。为了探究构建的金纳米簇荧光猝灭型探针检测精胺的特异性, 选择精胺测定常见的干扰物谷胱甘肽(GSH)、半胱氨酸、组氨酸(His)、赖氨酸(Lys)等、评价此荧光探针的特异性, 取高于最高检測限浓度10 倍的干扰物加入MU-Au NCs溶液中, 观察干扰物对精胺检测的影响, 计算荧光强度差值ΔF值和荧光猝灭程度。如图 4A所示, 测试的干扰物对精胺检测影响较小, 说明此探针对精胺检测的选择性和特异性比较好。图4B的结果说明, 不同浓度的精胺对MU-Au NCs 荧光猝灭强度不同, 可利用此原理进行精胺的检测。
3.5 实验条件优化
pH值及离子强度是主要影响因素, 对实验结果影响较大。由图5A可见, 当 pH=7时, 对精胺检测有一定的影响, 但总体影响较小, 为后续实验及应用方便, 故选择最适 pH=7。图5B表明, 在测试的范围内, 离子强度对精胺猝灭金纳米簇荧光强度的影响也较小。综合上述实验结果, pH值 及离子强度对精胺检测的影响较小, 后续实验中离子干扰影响可以忽略。
3.6 方法的检测性能
不同浓度的精胺存在时, MU-Au NCs 的荧光光谱如图6所示, 随着精胺浓度增大, MU-Au NCs 的荧光猝灭程度增大。荧光猝灭程度(F0-F1)/F0与精胺浓度在0.003~300 μmol/L范围内呈线性关系,线性方程为y=0.0023x+0.0356(r=0.9982), 检出限为 1 nmol/L(S/N=3)。
将本方法与文献报道的其它方法进行比较(表1)可知, 本方法对精胺的检测范围较宽, 且检出限相对较低。尽管本方法与文献报道的超高液相色谱-三重四极杆质谱(UHPLC-TQMS)方法相比, 灵敏度(检测限)稍低, 但本方法操作简单、快速, 适于常规的快速检测。
3.7 实际样品分析
为了评价所构建的荧光探针对实际样品中 SPM 检测的实用性, 检测了市售冷鲜猪肉在贮藏过程中的精胺含量。采用标准加样回收法对猪肉提取液中的 SPM 含量进行了测定, 结果见表 2。猪肉中 SPM 的平均回收率为 97.1%~105.6%, 表明此荧光探针能够适用于实际样品中精胺的检测要求。
4 结 论
以紫脲酸铵作为还原剂及保护剂, 采用水热合成法, 简单、快速合成了直径<2 nm的荧光金纳米簇(MU-Au NCs)。基于精胺对紫脲酸铵保护的金纳米簇的熒光猝灭现象, 建立了快速、超灵敏检测精胺的“Turn off”型荧光分析方法, 对精胺线性检测范围为0.003~300 μmol/L, 检出限为 1 nmol/L。本研究拓展了金纳米簇的种类, 为构建基于贵金属纳米簇的生物传感器及生物样品检测提供了基础和参考。
References
1 Ordóez J L, Troncoso A M, García-Parrilla M D C, Callejón M R. Anal. Chim. Acta, 2016, 939: 10-25
2 Jastrzebska A, Piasta A, Kowalska S, Krzemiński M, Szyk E. J. Food Compos. Anal., 2016, 48: 111-119
3 Su H H, Chuang L Y, Tseng W L, Lu C Y. J. Chromatogr. B, 2015, 978-979: 131-137
4 Chatzimitakos T, Exarchou V, Ordoudi S A, Fiamegos Y, Stalikas C. Food Chem., 2016, 202: 445-450
5 Tsuchiya H, Takagi N. J. Gifu Dental Soc., 1983, 10(2): 426-400
6 Herrero A, Sanllorente S, Reguera C, Ortiz M C, Sarabia L A. Anal. Chim. Acta, 2016, 945: 31-38
7 Ibarra A A G, Wrobel K, Escobosa A R C, Elguera J C T, Garay-Sevilla M E, Wrobel K. J. Chromatogr. B, 2015,1002: 176-184
8 YANG Shan-Shan, YANG Ya-Nan, LI Xue-Lin, ZHANG Yan. Chinese J. Anal. Chem., 2016, 44(3): 396-402
杨姗姗, 杨亚楠, 李雪霖, 张 燕. 分析化学, 2016, 44(3): 396-402
9 Jastrzbska A, Piasta A, Szyk E. Food Addit. Contam., 2014, 31(1): 83-92
10 Naji G, Nagi M, ElSheikh A M, Gao S, Kianmehr K, zyer T, Rokne J, Demetrick D, Ridley M, Alhajj R. Springer Vienna, 2011: 285-313
11 Khan M R, Anjum F M, Din A, Hussain S, Shabbir M A, Nadeem M. Food Agr. Immunol., 2010, 21(4): 279-294
12 Tsai T S, Pillay V, Choonara Y E, Toit L C, Modi G, Naidoo D, Kumar P. Polymers, 2011, 3(1): 150-172
13 Demchenko A P. Anal. Biochem., 2005, 343: 1-22
14 Steinkamp T, Karst U. Anal. Bioanal. Chem., 2004, 380(1): 24-30
15 Li X M, Yang X Y, Zhang S S. TRAC-Trend Anal. Chem., 2008, 27(6): 543-553
16 Wagner M K, Li F, Li J J, Li X F, Chris L X. Anal. Bioanal. Chem., 2010, 397(8): 3213-3224
17 DING Liang, YANG Hui, XI Ya-Nan, ZHANG Jin-Chao, SHEN Shi-Gang. Spectrosecopy and Spectral Analysis, 2015, 35(1): 146-150
丁 良, 杨 慧, 席亚楠, 张金超, 申世刚. 光谱学与光谱分析, 2015, 35(1): 146-50
18 Mahanthesha K R, Swamy B E K, Chandra U, Shankar S S, Pai K V. J. Mol. Liq., 2012, 172(8): 119-124
19 Sadeghi S, Sheikhzadeh E. J. Hazard. Mater., 2009, 163(2): 861-868
20 Jain S, Gupta-Bhaya P. Talanta, 1992, 39(12): 1647-1652
21 Grochala W, Bukowska J. Vib. Spectrosc., 1998, 17(2): 145-154
22 Scarpa A. Method. Enzymol., 1972, 24: 343-351
23 Blayney L, Thomas H, Muir J, Henderson A. BBA-Biomembranes, 1977, 470(1): 128-133
24 Grudpan K, Jakmunee J, Vaneesorn Y, Watanesk S, Maung U A, Sooksamiti P. Talanta, 1998, 46(6): 1245-1257
25 Scott I G, Jeacocke R E. FEBS Lett., 1980, 109(1): 93-98
26 Parham H, Shamsipur M. Polyhedron, 1992, 11(8): 987-991
27 Shamsipur M, Esmaeili A, Amini M K. Talanta, 1989, 36(12): 1300-1302
28 nal A. Food Chem., 2007, 103(4): 1475-1486
29 Fu Y Q, Zhou Z H, Li Y L, Lu X, Zhao C X, Xu G W. J.Chromatogr. A, 2016, 1465: 30-37
30 Fletcher J T, Bruck B S. Sens. Actuators B, 2015, 207(Part A): 843-848
31 Rawat K A, Bhamore J R, Singhal R K, Kailasa S K. Biosens. Bioelectron., 2016, 88: 71-77
