贯筋藤鲜茎中凝乳酶的提取工艺研究
2015-12-27王红燕黄艾祥
王红燕,陶 亮,2,陈 森,李 涛,黄艾祥*
(1.云南农业大学食品科学技术学院云南昆明650201;2.云南农业大学植物保护学院云南昆明650201)
贯筋藤鲜茎中凝乳酶的提取工艺研究
王红燕1,陶 亮1,2,陈 森1,李 涛1,黄艾祥1*
(1.云南农业大学食品科学技术学院云南昆明650201;2.云南农业大学植物保护学院云南昆明650201)
以云南西北部地区的野生植物贯筋藤的鲜茎为原料,在单因素的试验基础上,采用L9(33)正交试验方法,以贯筋藤鲜茎中凝乳酶活力为评价指标,研究了不同的预处理方式、料液比、浸泡时间、浸泡温度对其提取工艺的影响,确定了贯筋藤鲜茎中凝乳酶的最佳提取条件和提取率。结果表明,贯筋藤鲜茎中凝乳酶的提取最佳条件为料液比1∶20(g∶m L),提取时间40 m in,提取温度65℃,在此条件下得到的凝乳酶活力为260.984 SU/m L,提取率为31.35%。
贯筋藤;凝乳酶;提取工艺;酶活力;提取率
贯筋藤(Dregea sinensis Hemsl.var.corrugata(Schneid.)Tsiang et P.T.[1]为萝藦科(Asclepiadaceae)南山藤属(Dregea E.Mey.,nom.cons.)植物,攀援木质藤本,俗称“奶浆藤”。贯筋藤生长于海拔500~3 000 m山地森林中或灌木丛中,主产于云南大理、丽江、昆明等地方[2]。据调查,在云南剑川县、鹤庆县用“奶浆藤”作为凝乳剂已有多年的历史,贯筋藤在民间已作为一种天然凝乳剂应用羊奶乳饼的生产。长期以来在加工乳饼(有人称之为“中国式奶酪”)时,其凝乳剂不是选用通常使用的酸水,而是使用野生植物贯筋藤茎杆水溶液作为凝乳剂,产品较常规酸凝法生产的乳饼具有更浓郁的清香风味和较高的成品率。
随着乳品行业的高速发展,人们对发酵乳制品的需求也日益增加。在干酪生产中,凝乳酶因其可以专一地切割乳中k-酪蛋白的苯丙氨酸(Phe)105-蛋氨酸(Met)106之间的肽键[3],破坏酪蛋白胶束使牛奶凝结,并由蛋白水解作用产生特有风味,成为重点研究的酶制剂。但由于小牛凝乳酶无法满足现代工业的需求且成本较高,国内外学者致力于寻找植物源凝乳酶的替代品,近年来,关于凝乳剂的研究较多,菠萝蛋白酶[4]、刺菜蓟[5]、生姜蛋白酶[6]等植物凝乳酶及其他凝乳剂[7-8]相继被研究。
黄艾祥等[9-10]发明了贯筋藤天然植物凝乳剂,孙海蛟等[11-12]研究了贯筋藤中的凝乳活性物质,都是以贯筋藤干茎为实验材料。本研究以贯筋藤鲜茎为原料,以其酶活力和提取率为指标,通过正交试验优化贯筋藤凝乳酶的提取工艺,确定贯筋藤鲜茎中凝乳酶的最佳提取条件和提取量,为寻找一种天然绿色植物凝乳剂及其替代品提供参考和理论依据,这对云南地方资源的开发利用具有一定的推动作用,同时对我国干酪产业的发展也具有重大而深远的理论和现实意义[13]。
1 材料与方法
1.1 材料与试剂
贯筋藤鲜茎:采自云南大理州剑川县,海拔2 000~3 000 m山地森林中或灌木丛中;山羊奶:昆明市易兴恒畜牧科技有限公司种羊胚胎基地。
硫酸铵(分析纯):天津市风船化学试剂科技有限公司。
1.2 仪器与设备
UV-1700紫外可见光谱仪:日本岛津公司;HH-6数显恒温水浴锅:国华电器有限公司;CP153电子天平:奥豪斯仪器有限公司;TDL-5-A离心机:上海安亭科学仪器厂;HI99161 pH计:意大利哈纳仪器有限公司;RE-52A旋转蒸发仪:上海亚荣生化仪器厂;FD-1A-50真空冷冻干燥机:上海比朗仪器有限公司;78-2型磁力搅拌器:常州国华电器有限公司。
1.3 试验方法
1.3.1 贯筋藤凝乳酶的提取工艺流程
贯筋藤鲜茎→洗涤→敲碎→浸泡→抽滤→离心→浓缩→盐析→分级→透析→冷冻干燥→贯筋藤凝乳酶干粉→低温保藏(-20℃)。
1.3.2 操作要点
(1)贯筋藤凝乳酶水提液的制备
选取新鲜的粗细均匀的贯筋藤茎洗净,均匀敲碎放入一定温度的超纯水中浸泡一段时间后取出,放置室温条件下冷却10 min,将水提贯筋藤后的浸泡液过120目4层纱布,过滤两次,所得上清液即为含有凝乳成分的贯筋藤水提液。
(2)贯筋藤凝乳酶水提液的浓缩
贯筋藤水提液经5 000 r/min离心15 min除杂后,使用旋转蒸发仪对不同料液比提取的贯筋藤蛋白酶原液浓缩,得到10倍原贯筋藤质量浓缩酶液,4℃冷藏24 h。
(3)贯筋藤凝乳酶的分级提取
取出冷藏24 h后的贯筋藤浓缩液,采用硫酸铵分级沉淀,4 000 r/min离心20 min。
(4)贯筋藤凝乳酶的透析除杂
样品分别加入截留分子质量(molecular weight cut off,MWCO)3 500 u的透析袋中,放置于大烧杯内透析20 h,多次更换透析液。塑料烧杯收集透析后溶液放入-80℃冰箱迅速冷冻,然后放入真空冷冻干燥机中冷冻干燥,制得贯筋藤凝乳酶干粉。
1.3.3 单因素试验
分别设置对贯筋藤鲜茎的预处理方式为粉碎、切片、敲断、料液比分别为1∶10、1∶15、1∶20、1∶25、1∶30(g∶m L)、浸泡温度分别为35℃、45℃、55℃、65℃、75℃,浸泡时间分别为10 min、20 min、30 min、40 min、50 min、60 m in,以凝乳酶活力作为评价指标,考察各因素变量对贯筋藤鲜茎中凝乳酶活力的影响。
1.3.4 贯筋藤鲜茎中凝乳酶提取最佳条件的优化
利用单因素试验探究不同的预处理方式、料液比例、浸泡时间、浸泡温度对提取的贯筋藤鲜茎中凝乳酶活力的影响。在此基础上选择料液比、浸泡时间、浸泡温度,进行3因素3水平的正交试验,以凝乳酶活力为评价指标,通过方差分析优化凝乳酶的最佳提取条件,正交试验因素及水平见表1。

表1 提取条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for extraction conditions optimization
1.3.5 贯筋藤凝乳酶活力的测定
采用修正ARIMA K等[14]法,取50 m L新鲜山羊乳,加热至85℃后恒温下水浴,加入为羊奶体积35%(17.5 m L)的贯筋藤溶液,充分混合后继续水浴。准确记录从加入贯筋藤溶液到羊乳凝固的时间。凝乳酶活力定义为:40 min凝固1 m L山羊乳的酶量(贯筋藤溶液用量)为1个索氏单位(Soxhelt unit,SU)。凝乳酶活力计算公式如下:
X=2 400×50×D/(t×17.5)
式中:X为凝乳酶活力,SU/m L;t为凝乳时间,m in;D为贯筋
藤溶液或粗酶液的稀释倍数。
2 结果与分析
2.1 单因素试验
2.1.1 贯筋藤浸泡前预处理方式对凝乳酶活力的影响
选取粗细均匀的贯筋藤鲜茎,将其清洗干净,分别经过粉碎、切片、敲碎预处理后,测其水提液的凝乳酶活力,结果如图1所示。

图1 不同的处理方式对贯筋藤凝乳酶活力的影响Fig.1 Effect of different pretreatments methods on rennet activities
由图1可知,不同的预处理方式对贯筋藤鲜茎的凝乳酶活力的影响不同,粉碎处理制作的贯筋藤水提液的凝乳酶活力为74.696SU/m L,明显低于切片和敲碎的,其中敲碎处理的贯筋藤水提液凝乳酶活力最高,其活力为198.740SU/m L。由于快速粉碎处理会破坏贯筋藤鲜茎中的内溶物,切片处理封闭、堵塞了贯筋藤植物茎秆的导管和筛管,导致在浸泡时凝乳酶浸出率低,凝乳酶活力低。为提高凝乳酶的活力,选择贯筋藤鲜茎的预处理方式为敲碎。
2.1.2 料液比对贯筋藤凝乳酶活力的影响
料液比对贯筋藤凝乳酶活力的影响结果如图2所示。

图2 料液比对凝乳酶活力的影响Fig.2 Effect of solid-liquid ratio on rennet activities
由图2可知,贯筋藤鲜茎中凝乳酶的活力随料液比的增大而增加,当料液比增大至1∶20(g∶m L)时,凝乳酶的活力达到220.009 SU/m L,继续增大料液比,凝乳酶的活力略有增大,但变化较小,基本趋于稳定,这是因为当料液比达到1∶20(g∶m L)时,酶已全部浸提出。因此选择1∶20(g∶m L)的料液比为宜。
2.1.3 浸泡时间对贯筋藤凝乳酶活力的影响
浸泡时间对贯筋藤凝乳酶活力的影响结果如图3所示。

图3 浸泡时间对凝乳酶活力的影响Fig.3 Effect of extraction time on rennet activities
由图3可知,贯筋藤鲜茎中凝乳酶的活力随浸泡时间的延长而增大,当浸泡时间达到40 m in时凝乳酶的活力最高为285.011 SU/m L,浸泡时间>40 min凝乳酶的活力开始降低。原因可能是浸泡时间过短,凝乳酶没有完全溶解,当时间延长到一定程度时才全部溶解,继续延长时间,凝乳酶的活力会在长时间的保温过程中逐渐减小,即酶的活力与在一定温度下保持的时间长短有关[15],因此浸泡时间选择40 min为宜。
2.1.4 浸泡温度对贯筋藤凝乳酶活力的影响
浸泡温度对贯筋藤凝乳酶活力的影响结果如图4所示。

图4 浸泡温度提取凝乳酶活力的影响Fig.4 Effect of extraction temperature on rennet activities
由图4可知,在一定温度范围内,凝乳酶的活力随着温度的升高而增加。当浸泡温度达到65℃时,凝乳酶的活力最高为289.993 SU/m L,浸泡温度>65℃后凝乳酶的活力又随温度的升高而降低。这主要是因为随着温度的升高,分子间的运动速度加快,凝乳酶易于溶解出来,但温度过高会使凝乳酶变性,影响凝乳酶的活力[9]。所以65℃为凝乳酶提取的适宜温度。
2.2 贯筋藤鲜茎中凝乳酶提取最佳条件的确定
在单因素试验的基础上,对贯筋藤鲜茎的凝乳酶提取条件进行正交试验设计,分别选取料液比,浸泡时间和浸泡温度,进行3因素3水平L9(33)正交试验,正交试验结果与分析见表2,方差分析见表3。

表2 提取条件优化正交试验结果及分析Table 2 Results and analysis of orthogonal experiments for extraction conditions optimization
由表2可知,3个因素中影响贯筋藤鲜茎中凝乳酶活力最主要的因素是浸泡温度,其次是浸泡时间和料液比,即影响贯筋藤凝乳酶活力的因素次序为C>B>A,提取凝乳酶的较优水平组合是A2B2C3,即提取贯筋藤鲜茎中凝乳酶的最佳条件为料液比1∶20(g∶m L),浸泡时间40 min,浸泡温度65℃,在此条件下,进行3次重复的验证试验,测得贯筋藤凝乳酶活力为260.984 SU/m L。

表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experiments results
由表3可知,方差分析结果表明,在进行贯筋藤鲜茎中凝乳酶的提取试验过程中,料液比、浸泡时间、浸泡温度对贯筋藤鲜茎中凝乳酶活力的影响均不显著。
2.3 贯筋藤鲜茎中凝乳酶提取率与酶活力相关性
贯筋藤鲜茎中的凝乳酶活力与对应组别的凝乳酶提取率关系结果如图5所示。
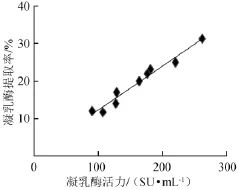
图5 凝乳活力与提取率的关系Fig.5 Correlation of milk clotting activity and extraction rate
由图5可知,贯筋藤鲜茎中凝乳酶的提取率随着凝乳酶活力的增大而升高,对这两组数据进行相关性分析,两者的Person相关系数为0.932,显著水平P<0.01,两者存在极显著的正线性相关,即凝乳酶活力最高时,相应的提取率也最高[10],因此在最佳提取条件下,进行3次重复试验,取其平均值,测得贯筋藤鲜茎中凝乳酶的提取率为31.35%。
3 结论
结果表明,贯筋藤的鲜茎中也含有凝乳酶。考察不同的预处理方式、料液比、浸泡时间、浸泡温度对凝乳酶活力的影响,最终对贯筋藤鲜茎采用敲碎的预处理方式,以此为基础,设计3因素3水平的正交试验,分析得出凝乳酶提取的最佳条件为料液比1∶20(g∶m L),浸泡时间40 min,浸泡温度65℃。在此条件下,测得的凝乳酶活力为260.984 SU/m L,提取率为31.35%。
相关性试验结果表明,凝乳酶活力与提取率呈正线性相关。
[1]张丽琴,杨敏杰,秦荣,等.云南民间食花野菜[J].北方园艺,2003(4):24-25.
[2]吴征镒.云南植物志[M].北京:科学出版社,2005.
[3]刘佟,崔艳华,张兰威,等,凝乳酶的研究进展[J].中国乳品工业,2011,39(8):40-41.
[4]黄志坚,董瑞兰,罗刚,等.菠萝蛋白酶部分酶学性质的研究[J].福建农业学报,2014,29(1):62-66.
[5]GALÁN E,PRADOS F,PINO A,et al.Influence of different amounts of vegetable coagulant from cardoon Cynara cardunculus and calf rennet on the proteolysis and sensory characteristics of cheeses made with sheep milk[J].Food Res Int,2008,18(1):93-98.
[6]HUANG X W,CHEN L J,LUO Y B,et al.Purification,characterization, and milk coagulating properties of ginger proteases[J].J Dairy Sci,2011, 94(5):2259-2269.
[7]KUMAR A,GROVER S,SHARMA J,et al.Chymosin and other milk coagulants:Sources and biotechnological interventions[J].Crit Rev Biotechnol,2010,30(3):243-258.
[8]MERHEB-DINI C,GOMES E,BOSCOLO M,et al.Production and characterization of a milk-clotting protease in the crude enzymatic extract from the newly isolated Thermomucor indicae-seudaticae N31[J].Food Chem,2010,120(1):87-93.
[9]黄艾祥.一种天然植物凝乳剂及其应用:中国,专利号ZL200810233569 [P].2009.
[10]陶亮.贯筋藤蛋白酶的特性及其凝乳机理初探[D].昆明:云南农业大学硕士论文,2014.
[11]孙海蛟.乳饼加工技术及其凝乳剂的研究[D].昆明:云南农业大学硕士论文,2009.
[12]马元元.贯筋藤凝乳剂及其凝乳特性的研究[D].昆明:云南农业大学硕士论文,2013.
[13]曾剑超.姜汁凝乳的研究和展望[J].酿酒,2007,34(5):57-59.
[14]刘振民,刘辉,骆承庠.酒药中凝乳酶菌株筛选及产酶条件研究[J].食品与发酵工业,2000,26(5):8-11.
[15]王艳萍,闵军涛,姚四平,等.印度毛霉MJ229固态发酵产凝乳酶的研究[J].中国酿造,2013,32(1):17-21.
[16]PONTUAL E V,CARVALHO B E,BEZERRA R S,et al.Caseinolytic and milk-clotting activities from Moringa oleifera flowers[J].Food Chem,2012,135(3):1849-1852.
Extraction process of rennet from fresh stalk of Dregea sinensis Hemsl
WANG Hongyan1,TAO Liang1,2,CHEN Sen1,LI Tao1,HUANG Aixiang1*
(1.College of Food Science and Technology,Yunnan Agricultural University,Kunm ing 650201,China; 2.College of Plant Protection,Yunnan Agricultural University,Kunming 650201,China)
The fresh stalk of wild Dregea Sinensis Hemsl from the northwest of Yunnan province was researched.On the basis of single factor test,using rennet activity as evaluation index,the effects of different pretreatments,solid-liquid ratio,extraction time and temperature on enzyme activity of D.sinensis Hemsl fresh stalk was studied.Optimal extraction conditions were determined by three factors and three levels orthogonal experiment. The results showed that the optimal extraction process of rennet from D.sinensis Hem sl was solid-liquid ratio 1∶20(g∶m l),extraction time 40 m in,extraction temperature 65℃.Under this condition,the rennet activity was 260.984 SU/m l,the rennet extraction rate was 31.35%.
Dregea sinensis Hemsl;rennet;extraction process;enzyme activity;extraction rate
TS202.3
A
0254-5071(2015)03-0034-04
10.11882/j.issn.0254-5071.2015.03.008
2015-01-18
国家自然科学基金资助项目(31160331);云南省高校食品加工与安全控制重点实验室项目(云教科(2014)16号)
王红燕(1989-),女,硕士研究生,研究方向为乳制品加工与质量安全。
*通讯作者:黄艾祥(1963-),男,教授,博士,研究方向为乳制品加工。
