匍枝根霉cbh2基因的克隆表达与结构分析*
2015-12-25张庆庆谢志皓李松孙全霞汤斌
张庆庆,谢志皓,李松,孙全霞,汤斌
(安徽工程大学生物与化学工程学院,安徽芜湖,241000)
纤维素酶,由3种主要组分组成,即内切葡聚糖酶(EG,EC 3.2.1.4)、外切葡聚糖酶(CBH,EC 3.2.1.91)和 β-葡萄糖苷酶(BG,EC 3.2.1.21)[1]。CBH包括CBHI和CBHII两种异构酶,CBHI作用于纤维素的还原端,CBHII作用于纤维素的非还原端[2],生成纤维二糖。在真菌中 CBHII分泌量没有CBHI高,但其降解微晶纤维素的效率是CBHI的2倍[3],CBH 酶活影响结晶纤维素的降解效率[4],是破坏结晶纤维素的关键酶[5]。近年来,已有许多关于GH6、GH7 家族 CBH 的报道,Wang 等[6]通过将黑曲霉cbh结合到里氏木霉强启动子Pcbh1质粒上,使用PEG-CaCl2方法转化到里氏木霉中,重组子的酶活提高106倍;Takashima等[7]将CBH的结合域关键氨基酸位点进行突变来提高酶活;Tavagnacco等[8]研究结合域上糖基化位点对其结合效率的影响;Gao等[9]发现CBH的结合域具有破坏纤维素氢键结构。
目前对匍枝根霉的研究主要集中在γ-亚麻酸和脂肪脱氢酶等的研究[10];在木质素降解酶系中,对匍枝根霉的研究主要在木聚糖酶[11]和纤维素酶[12]的研究,Tang等[13-14]将匍枝根霉中克隆表达 eg、bg基因,研究其结构与功能,并对匍枝根霉纤维素酶发酵条件进行优化,建立分批发酵动力学模型。目前,已经在黑曲霉、里氏木霉、康宁木霉、斜卧青霉等真菌中克隆出cbh2(外切葡聚糖酶II)基因,根霉属的米根霉能分泌碳水化合物酶(CAZy),但在基因组基因的研究中,其不含有GH6和GH7家族的基因[15]。本研究从匍枝根霉中克隆的cbh2基因,属于GH6家族。cbh2基因已经成功在酿酒酵母、毕赤酵母、大肠杆菌等宿主中进行克隆表达,在大肠杆菌表达系统中,Wu等[16]将Thermobifida fusca菌中的cbh2在大肠杆菌中表达,并研究水解过程中的降解机制;Wang等[17]将Neocallimastix patriciarum J11菌中的cbh在大肠杆菌中表达,且具有耐热和pH稳定性。本研究通过反向PCR技术获得cbh2基因,该基因表达的CBHII酶能水解纤维素链非还原端生成纤维二糖,通过在E.coli BL21(DE3)克隆表达、分离纯化获得46 kDa的蛋白并研究酶的基本特性发现,CBHII具有很好的pH稳定性,能降解微晶纤维素,为进一步优化匍枝根霉的纤维素酶系,增强纤维素酶复合酶系的协同降解效率的研究奠定基础。
1 材料与方法
1.1 菌株和质粒
匍枝根霉 TP-02(Rhizopus stolonifer TP-02)、E.coli DH5α 和E.coli BL21(DE3)、pET22-b(+)Vector为本实验室保藏;克隆质粒pMD18-T购自Takara。
1.2 试剂和培养基
Taq 酶、dNTP、T4DNA Ligase、EcoRI、NotI购自Takara;胰蛋白胨、酵母粉、UNIQ-10柱式 Trizol总RNA抽提试剂盒、IPTG、氨苄硫酸盐试剂、Acrylamide、Bis-acrylamide、AP、TEMED 引物设计购自上海Sangon 公司;BSA、Avicel购自 Sigma;HiTrap Ni,Hi-Trap DEAE FF,HiTrap Desalting,SephadexTMG-75 购自GE公司;其他药品均为国药分析纯。
诱导培养基和LB培养基[13]
1.3 cbh2的克隆表达
1.3.1 引物设计
根据NCBI报道的cbh2基因进行比对分析,结合生物信息学分析手段和测序结果,设计引物如表1所示。

表1 PCR各引物序列Tabel 1 The sequences of primers for PCR
1.3.2 cbh2基因的克隆
将Rhizopus stolonifer接种在土豆培养基中活化24 h,以10%接种量转接到诱导培养基中30℃ 180 r/min培养匍枝根霉60~72 h,收集菌体,清洗,冷冻干燥。用UNIQ-10柱式Trizol总RNA抽提试剂盒提取Rhizopus stolonifer的总RNA,以提取的总RNA为模板,Oligo dT-Adaptor为引物,逆转录合成cDNA的第一条链,以所合成的链为模板,以cbh2-AF/cbh2-AR引物扩增cbh2的核心cDNA序列。利用反向PCR技术[18],根据获得的cbh2的核心cDNA序列,设计反向引物,将逆转录合成的cDNA利用槽式引物进行扩增并用EcoRI切割,取单链cDNA 8 μL在T4连接酶的作用下16℃连接12 h,连接产物在65℃灭酶处理10 min。以环化好的cDNA为模板,cbh2-BF/cbh2-BR引物扩增cbh2的侧翼序列,并通过胶回收与pMD18-T载体连接,蓝白斑筛选送测序,获得侧翼序列。利用DNAStart软件分析并设计cbh2-CF/cbh2-CR引物扩增出cbh2的全基因序列。根据CTAB的方法提取基因组DNA,并以基因组DNA为模板cbh2-CF/cbh2-CR为引物扩增cbh2的DNA序列。
1.3.3 cbh2表达载体的构建和诱导表达
把去掉信号肽的cbh2基因和表达载体pET22-b用EcoRI和NotI双酶切,连接转化到 E.coli BL21(DE3)进行克隆。挑取阳性克隆子验证并测序,在LB培养基中,以未添加诱导剂的为对照,设计不同浓度的IPTG、诱导时间和诱导温度对产酶进行表达研究。
1.4 氨基酸序列分析和同源建模
通过生物信息学的方法,利用PDB数据库分析CBHII蛋白序列,选取最低的E-Value蛋白作为模板,其登录号分别为:1QJW、4I5R、3CBH、1OC5、1OCN、1GZ1。通过DS 2.5软件进行同源建模,并进行分子对接分析关键氨基酸与底物之间氢键的变化,及在催化过程中的重要性。
1.5 CBH 活性的测定[19]
在50℃的反应体系中,以微晶纤维素为底物,将0.5 mL适当稀释的酶液加入试管中,混匀后于50℃水浴中反应30 min,终止反应,离心,加入DNS在沸水浴中显色,测定上清液中的还原糖,每分钟水解生成1 μmol葡萄糖所需的酶量为1个酶活国际单位(IU)。
1.6 CBHII酶的纯化
1.6.1 粗酶液的制备
在3 L自动发酵罐中以最佳条件培养重组大肠杆菌并收集菌体,清洗并超声破碎获得粗酶液,10 000×g离心10 min,上清液中加入饱和度为50%的固体(NH4)2SO4,盐析过夜,4℃ 10 000×g离心10min,取沉淀物用适量缓冲液 A(20 mmol/L Tris-HCl+500 mmol/L NaCl+20 mmol/L C3H4N2,pH 7)溶解,并在此缓冲液中透析24 h,通过0.45 μm膜过滤后保存备用。
1.6.2 CBHII酶的3步纯化
利用ÄKTA prime plus纯化系统,Ni柱用缓冲液A平衡后,将样品吸附在Ni柱上并平衡,用缓冲液B(20 mmol/L Tris-HCl+500 mmol/L NaCl+200~500 mmol/L C3H4N2,pH 7)进行线性洗脱,收集洗脱峰并测酶活。收集酶活样品,使用HiTrap Desalting脱盐后上样于经过缓冲液C(20 mmol/L Tris-HCl,pH 7.0)平衡的HiTrap DEAE FF,用缓冲液D(20 mmol/L Tris-HCl+0 ~500 mmol/L NaCl,pH 7.0)进行梯度洗脱,收集洗脱峰并测酶活;合并酶活样品使用HiTrap Desalting脱盐后上样5%于经缓冲液E(50 mmol/L HAc-NaAc,pH 4.8)平衡的G-75分离目的蛋白,收集洗脱峰并测酶活,并通过SDS-PAGE分析。
1.7 酶特性研究
1.7.1 温度对酶活性的影响
在不同温度(30~80℃)下,按1.5的方法测定CBHII的活性,最适温度定义为最高酶活性(以相对活性100%计)所对应的温度。将适量酶液与50 mmol/L、pH值为5.0的HAc-NaAc缓冲液在不同的温度下(55~80℃)分别保温不同时间后,立即在0℃冰箱中冷却,然后在50℃下测酶的活性,以未经过保温处理的酶活性作为评价热稳定性的指标。
1.7.2 pH对酶活性的影响
在不同 pH值(pH 3.0~6.0、50 mmol/L HAc-NaAc;pH 6.1~8.0、50 mmol/L PBS)缓冲液配制2%的微晶纤维素底物,按1.5的方法测定酶活性,最适pH定义为最高酶活性所对应的pH值。将酶液在不同pH值的缓冲液中50℃保温30 min测定残余酶活性。酶的pH稳定性定义为残余酶活性在85%以上的pH范围。
1.7.3 动力学参数的测定
用50 mmol/L、pH为5.0的HAc-NaAc缓冲液配制不同质量浓度的微晶纤维素底物,按照1.5的方法测定,依据Hanes woolf plot的方法以[S]和[S]/V作图,计算出CBHII的Km和Vmax值。
2 结果和分析
2.1 cbh2基因的分离和序列分析
利用反向PCR技术从匍枝根霉中获得cbh2基因,并在基因组中获得cbh2的DNA。该基因的DNA通过测序编码1647 bp,cDNA通过测序编码1323 bp;cbh2基因编码含有3个内含子,获得GenBank的登陆号KF916016.1。cbh2编码440个氨基酸,其分子式为C2005H3083N539O658S17,分子质量(MW)约为46 kDa,等电点(pI)约为 4.81。1~33为结合区域(CBM),34~85为连接区域(Linker),86~440为催化区域(CD)。通过CDD数据库比对分析,纤维二糖水解酶cbh2属于糖苷水解酶第6家族。
2.2 cbh2催化过程的关键位点分析
将CBHII蛋白序列与PDB数据库比对,选取最低E-Value的蛋白结构作为模板,催化域与1QJW的同源性为68.5%。结合DS 2.5软件对匍枝根霉CBHII蛋白进行同源模拟,模型的PDF Total Energy最低值为9 303.7,DOPE值最低为-40 612.6,表明此模型可信度较高,并根据Ramanchandran Plot分析氨基酸的构象,表现出所建立模型的合理性。结构如图1所示,CBM上保守的芳香族氨基酸残基(Tyr和Trp)形成平坦的疏水性平面,与报道的T.reesei纤维二糖水解酶CBM的研究类似[20]。通过分子动力学研究,在催化过程中CBM首先与纤维素表面结合,CBM上3个平行的Tyr基团结合纤维素表面,增加其表面的亲和力,结合域与纤维表面的结合是纤维酶解的必需和限速步骤;纤维六糖在CBHII催化隧道中主要与Arg179,Trp371,Lys399和 His418产生氢键,如图2所示,在CD区的催化隧道中,由上述关键氨基酸对底物进行作用。通过动力学模拟整个催化过程的氢键分析,在底物不断运动的过程中,氢键的大小和成键的基团都在不断的变化,尤其是在His418上,是酶酸碱催化过程中最活泼的一个催化官能团,是影响催化反应速度的因素之一,His上咪唑基解离下来的质子浓度与水中的[H+]相近,在中性环境下一半以酸形式存在,一半以碱形式存在,既是供氢体又是受氢体,供出和接受质子的速度是相等的,结合其他的作用力通过纤维素链的移动降解β-1,4糖苷键,水解产生纤维二糖。

图1 CBHII结构同源模拟和CBM的关键位点分析Fig.1 The structure homology modeling of CBHII and analysis of key sites in CBM

图2 CD区催化隧道内关键位点分析Fig.2 Analysis of Catalytic Domain key sites in the tunnel
2.3 cbh2的克隆表达和纯化
2.3.1 cbh2的克隆表达
cbh2基因与pET22b质粒进行双酶切连接转化到E.coli BL21(DE3)中,在Amp抗性平板上挑取阳性克隆子过夜培养,提取质粒进行酶切鉴定,并送测序。结果表明,重组菌E.coli BL21(DE3)/pET22bcbh2构建正确。
2.3.2 CBHII蛋白的诱导表达和纯化
在摇瓶中以不同浓度的IPTG、不同的诱导时间和不同的诱导温度进行产酶优化,最佳的条件:在LB液体培养基中,接种5%在37℃培养至OD600为0.6~0.8左右,加入IPTG使终浓度达到0.2 mmol/L并在25℃诱导14 h。以摇瓶的最佳产酶条件为基础,在3 L全自动发酵罐中培养,溶氧控制在30%,发酵结束收集菌体,通过超声破碎细胞,离心获得粗酶液。
利用ÄKTA prime plus纯化系统选择镍柱层析、DEAE FF层析和G-75层析分离带标签的目的蛋白,纯化过程见表2,纯化倍数提高了8.19倍,比活力达到4.67I U/mg。诱导表达和纯化过程SDS-PAGE电泳图见图3所示,获得46 kDa的酶蛋白。

表2 CBHII纯化过程Table 2 The purification process of CBHII
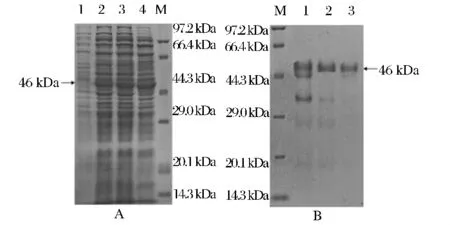
图3 CBHII分离纯化SDS-PAGE凝胶电泳分析Fig.3 Purification and SDS-PAGE analysis of CBHII
2.4 CBHII酶的特性研究
2.4.1 酶的最适温度
利用纯化的CBHⅡ酶蛋白,在不同温度(30~80℃)下,测定酶的最适反应温度,结果如图4(A)所示,CBHⅡ的最适反应温度为50℃;通过不同的温度下分别保温不同时间研究酶的热稳定性,结果如图4(B)所示,在60℃以下酶的稳定性较好,温度降低后酶活性就恢复正常,在50℃以上催化活力趋于下降,在50~60℃呈现可逆失活,65~70℃出现不可逆变性。(酶学性质研究的酶活测定数据根据5组平行实验,分别去除最高值和最低值,以平均值计,下同)

图4 CBHII的最适反应温度及温度稳定性Fig.4 The optimum temperature and thermostability of CBHII
2.4.2 酶的最适pH
CBHII的最适反应pH和pH稳定性研究结果如图5所示。可知,CBHII的最适反应pH为5,当pH低于4和高于7时,酶的催化活性丧失较快,通过pH稳定性曲线发现,其在pH为4~7之间具有较好的稳定性;pH为5条件下30 min仍能保持原来的95%酶活,与最适反应pH也是一致的。

图5 CBHII的最适pH和pH稳定性Fig.5 The optimum pH and pH stability of CBHII
2.4.3 酶反应动力学曲线
CBHII酶液与不同浓度的底物反应,在标准条件下测定酶活力,根据Hanes woolf plot作图法以不同浓度的微晶纤维素为底物,求得米氏方程结果如图6所示,求得 Km为 7.358 mg/mL,Vmax为 6.501 7[mg/(min·mL)]。
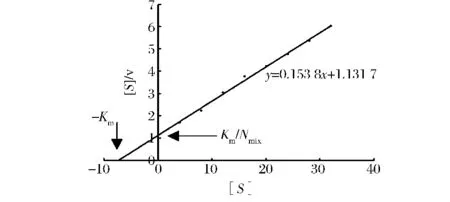
图6 CBHII的 Hanes woolf plot图Fig.6 Hanes woolf plot of CBHII
3 讨论
利用反向PCR技术从匍枝根霉中克隆cbh2基因,其属于GH6家族。本文就cbh2基因做了克隆表达、纯化与酶性质方面的研究,并用同源建模和分子动力学的方法对其结构和催化机理进行探讨研究,旨在为CBHII的应用提供数据参考和理论支持。采用E.coli BL21为宿主,将去除信号肽的cbh2基因整合到表达载体上,获得E.coli BL21(DE3)/pET22b-cbh2重组菌,在大肠杆菌中实现可溶性表达,粗酶液酶活力为0.71 IU/mL,低于绿色木霉[21]cbh2在酿酒酵母中表达,但具有发酵周期短的特点。利用三步法进行纯化,其优点在于纯化过程中梯度去除杂蛋白,获得纯度较高的CBHII酶蛋白,比活力为4.67 IU/mg,对微晶纤维素表现出较高的酶活。
目前,对纤维二糖水解酶的研究主要在里氏木霉、黑曲霉、哈茨木霉、微紫青霉等的研究,在匍枝根霉中分离获得外切纤维二糖水解酶基因的报道较少。在Neocallimastix patriciarum[18]中纤维二糖水解酶在E.coli BL21(DE3)中实现可溶性表达,且纯化后获得活力较高的蛋白。本研究获得的重组CBHII酶的最适反应pH和温度的研究结果与里氏木霉、草酸青霉分析表明,CBHII酶的最适反应pH与里氏木霉、草酸青霉相近,但最适反应温度较里氏木霉具有耐热性,CBHII酶活力与哈茨木霉相近,在E.coli BL21(DE3)进行表达CBHII,酶活力相对较低,原因可能是大肠杆菌缺乏协助蛋白折叠的系统[22],真菌蛋白在表达的过程中无法形成正确折叠的高级结构,蛋白以错误形成包涵体出现,导致表达的CBHII酶活力低。本研究采用降低温度来诱导表达,降低CBHII酶蛋白在大肠杆菌中的折叠速度,减少包涵体的形成,形成可溶性表达。构建的重组菌培养周期短,诱导剂使用浓度低,表达的CBHII蛋白在pH 4~7之间酶活力较稳定,但CBHII在E.coli BL21(DE3)中表达活力较低,我们将优化发酵条件和酶活测定方法来提高酶活,为制备以及在木质纤维素水解中的实际应用提供技术基础。
[1] Bhat M K.Cellulase and related enzymes in biotechnology[J].Biotechnology Advances,2000,18(5):355-383.
[2] Boisset C,Fraschini C,Schülein M,et al.Imaging the enzymatic digestion of bacterial cellulose ribbons reveals the endo character of the cellobiohydrolase Cel6A from Humicola insolens and its mode of synergy with cellobiohydrolase Cel7A[J].Applied and Environmental Microbiology,2000,66(4):1 444-1 452.
[3] Cheng C.Nucleotide sequence of the cellobiohydrolase gene from Trichoderma viride[J].Nucleic Acid Research,1990,18(18):55-59.
[4] WANG L S,ZHANG Y Z,GAO P J,et al.Changes in the structural properties and rate of hydrolysis of cotton fibers during extended enzymatichydrolysis[J].Biotechnology and Bioengineering,2006,93(3):443-456.
[5] Seiboth B,Hakola S,Mach R L,et al.Role of four major cellulases in triggering of cellulase gene expression by cellulose in Trichoderma reesei[J].Journal of Bacteriology,1997,179(17):5 318-5 320.
[6] WANG B B,XIA L M.High efficient expression of cellobiase gene from Aspergillus nigerin the cells of Trichoderma reesei[J].Bioresource Technology,2011,102(6):4 568-4 572.
[7] Takashima S,Ohno M,Hidaka M,et al.Correlation between cellulose binding and activity of cellulose-binding domain mutants of Humicola grisea cellobiohydrolase I[J].Federation of European Biochemical Societies,2007,581(30):5 891-5 896.
[8] Tavagnacco L,Mason P E,Schnupf U,et al.Sugar-binding sites on the surface of the carbohydrate-binding module of CBHI from Trichoderma reesei[J].Carbohydrate Research,2011,346(6):839-846.
[9] GAO P J,CHEN G J,WANG T H,et al.Non-hydrolytic disruption of crystalline structure of cellulose by cellulose binding domain and linker sequence of cellobiohydrolase I from Penicillium janthinellum[J].Acta Biochimica et Biophysica Sinaca,2001,33(1):13-18.
[10] 朱钰,陆合,胡晓莉.影响米根霉产γ-亚麻酸的几种因素[J].微生物学杂志,2007,27(4):6-10.
[11] 汤文晶,谢志皓,张庆庆,等.匍枝根霉液态发酵产木聚糖酶培养基优化研究[J].安徽工程大学学报,2014,29(1):1-5.
[12] TANG B,PAN H B,ZHANG Q Q,et al.Cloning and expression of cellulase gene EG1 from Rhizopus stolonifer var.reflexus TP-02 in Escherichia coli[J].Bioresource Technology,2009,100(23):6 129-6 132.
[13] 汤斌,张莹莹,杨亚平.匍枝根霉TP-02内切葡聚糖酶基因eg2的克隆表达及功能分析[J].食品与发酵工业,2013,39(7):13-17.
[14] 汤斌,许钟源,李松,等.匍枝根霉纤维素酶发酵条件优化及分批发酵动力学模型的构建[J].食品与发酵工业,2014,40(1):85-90.
[15] Battaglia E,Benoit I,Brink J,et al.Carbohydrate-active enzymes from the zygomycete fungus Rhizopus oryzae:a highly specialized approach to carbohydrate degradation depicted at genome level[J].BMC Genomics,2011,12(17):1-12.
[16] WU W,BU L T,Vuong T V,et al.Loop motions important to product expulsion in the Thermobifida fusca glycoside hydrolase family 6 eellobiohydrolase from structural and computational studies[J].The JournalL of Biological Chemistry,2013,288(46):33 107-33 117.
[17] WANG H C,CHEN Y C,HUANG C T,et al.Cloning and characterization of a thermostable and pH-stable cellobiohydrolase from Neocallimastix patriciarum J11[J].Protein Expression and Purification,2013,90(2):153-159.
[18] 陆合,朱钰,黄尤田.反向PCR克隆黑根霉R306Δ6-脂肪酸脱饱和酶基因[J].微生物学杂志,2008,28(1):24-27.
[19] 方浩,夏黎明.里氏木霉纤维二糖水解酶Ⅱ基因的高表达[J].高效化学工程学报,2014,28(4):784-790.
[20] CHEN L,Drake M R,Resch M G,et al.Specificity of O-glycosylation in enhancing the stability and cellulose binding affinity of Family 1 carbohydratebinding modules[J].Proceedings of the National Academy of Sciences of the U-nited States of America,2014,111(21):7 612-7 617.
[21] 刘泽寰,全艳彩,唐根云,等.绿色木霉CBHII基因的克隆及在酿酒酵母中的表达[J].华南理工大学学报,2009,37(6):91-95.
[22] 陈科,黄潇,路蕾,等.不同调控元件驱动下菊欧氏杆菌纤维素酶celY基因在大肠杆菌中表达的研究[J].中国生物工程杂志,2012,32(2):24-28.
