大孔树脂处理对鳕鱼蛋白酶解液中腥味物质的影响*
2015-12-25常钰菲侯虎李八方
常钰菲,侯虎,李八方
(中国海洋大学食品科学与工程学院,青岛 山东,266003)
鳕鱼,鳕属鱼类,是世界年捕捞量最大的深海鱼。鳕鱼中蛋白含量约16.5%,高于三文鱼、鲳鱼等鱼类,具有很高的营养价值[1]。研究表明,水产蛋白酶解产物中广泛存在着具有降血压[2]、抗氧化[3-4]等特殊生理功能的多肽,还可用于牛磺酸、壳聚糖[5]等的制备,来源于海洋生物的活性肽,在功能食品的开发中极具潜力。
但是,水产品普遍具有令人生厌的不良风味,尤以腥味为主;此外,在制备酶解液时,由于酶解过程较难控制,酶解产物通常具有苦腥味,严重制约水产蛋白酶解液在食品方面的应用[6]。因此,脱腥成为水产品加工及应用领域亟待解决的问题。
水产品脱腥方法主要分为物理脱腥、化学脱腥及生物脱腥三类,常见方法有活性炭吸附法、酸碱处理法及酵母发酵等[7]。活性炭吸附法在脱腥脱色方面有一定效果,但使蛋白质损失较大;酸碱处理法会引入一定的试剂残留;酵母等微生物发酵法,仅适于液态样品[8],且酵母粉的加入会引入异味。近年来,大孔树脂因具有吸附性和筛选性,能有效吸附各类有机物质,在不良风味脱除方面的应用逐渐兴起[9-11]。
本实验以大孔树脂吸附脱腥为研究对象,通过单因素实验,以大孔树脂型号为变量进行树脂初筛,选出对鳕鱼蛋白酶解产物脱腥的最佳树脂类型;以温度、树脂添加量及pH为变量进行单因素实验,在此基础上进行响应面优化,得出该型大孔树脂的最佳脱腥工艺,并通过验证实验及SPME-GC-MS分析确证该工艺可行、有效,为鳕鱼蛋白酶解液在腥味脱除、功能性食品开发等水产品加工应用领域提供实验依据及理论支持。
1 材料与方法
1.1 材料与试剂
新鲜鳕鱼购自青岛南山水产品市场。宰杀后的新鲜鳕鱼,去除鱼皮、内脏及鳃部,取背部鱼肉,制成肉糜,于-20℃冷冻保存。
枯草杆菌碱性蛋白酶(食品级),由南宁庞博试剂有限公司提供;牛血清蛋白标准品,由赛默飞科技有限公司提供;其他试剂均为国产分析纯。
001×7型大孔树脂,山东鲁抗立科药物化学有限公司;D151、D201、D311型大孔树脂,安徽三星树脂科技有限公司;DA201-C型大孔树脂,江苏苏青水处理工程集团有限公司;D4006、AB-8型大孔树脂,南开大学化工厂。
1.2 仪器与设备
AL204电子天平,梅特勒-托利多仪器有限公司;DS-1高速组织捣碎机,上海标本模型厂;PHS-3C雷磁pH计,上海仪电科学仪器股份有限公司;SHA-B恒温振荡器,国华电器有限公司;722s可见分光光度计,上海精密科学仪器有限公司;65 μm PDMS/DVB萃取纤维及HP-INNOWax(30 m×0.25 mm×0.25 μm)气相色谱柱,美国Supelco公司;GC-MS气相色谱-质谱联用仪,美国Agilent公司。
1.3 实验方法
1.3.1 鳕鱼蛋白酶解液的制备
将鳕鱼肉糜解冻,以20%为底物浓度加入至pH 10的缓冲液中,并加入0.15%枯草杆菌碱性蛋白酶,于55℃下搅拌酶解4 h,沸水浴中灭酶10 min,冷却,于5 000 r/min离心20 min,取上清液待用。
1.3.2 大孔树脂预处理[12]
将大孔树脂用蒸馏水洗至出水无味,无细碎树脂及杂质。以0.5 BV无水乙醇浸泡24 h,蒸馏水反复洗净至无气味。以2 BV 4%HCl浸泡4 h,排去酸液,蒸馏水洗至中性;以2 BV 4%NaOH浸泡4 h,排去碱液,蒸馏水洗至中性。湿基保存,使用时抽滤脱水。
1.3.3 大孔树脂静态吸附单因素实验
以经脱腥处理后的鳕鱼蛋白酶解液的腥味分值及多肽损失率为指标,分别考察树脂型号、温度、树脂添加量、pH对大孔树脂脱腥效果的影响。
1.3.4 中心组合(Box-Behnken)试验设计及响应面分析
应用Design-Expert 7.0软件,依据Box-Behnken设计原理,以酶解产物脱腥后的腥味分值和多肽损失率为响应值,选取脱腥温度(X1)、树脂添加量(X2)、pH(X3)3个自变量,分别在3个水平上进行响应面试验,建立自变量与响应值之间的回归关系,求得最优值并进行验证,从而对大孔树脂的脱腥工艺进行优化。共计17组试验,因素水平编码见表1。
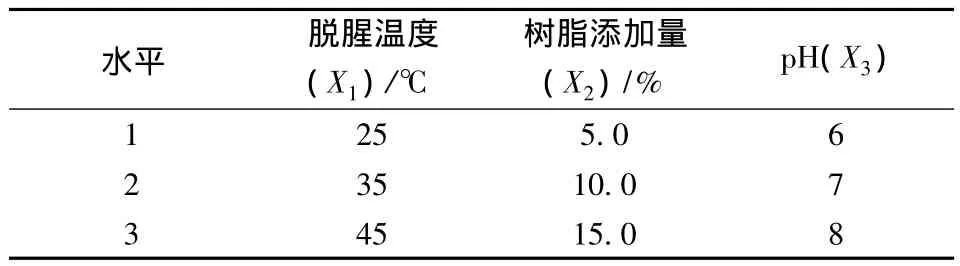
表1 响应曲面试验设计因素水平表Table 1 Factors and coded levels in response surface model
1.3.5 脱腥效果评价
以大孔树脂脱腥后的鳕鱼蛋白酶解液的腥味分值和多肽损失率为评价指标。
腥味分值由感官评定得来。感官评定小组由10名(5男5女)感官评定员组成,分别对大孔树脂处理后的样品进行感官评定。评定室温为25℃左右,评定过程中不得相互交流,样品的评定之间有一定的时间间隔。以酶解原液作为参照(分值为6),根据表2所列评分标准进行打分,取平均值表示该样品的腥味程度。

表2 感官评分标准表Table 2 Sensory evaluation standard
多肽含量的测定:参照水解液中多肽含量的测定方法[13],分别测定鳕鱼蛋白酶解原液和经AB-8大孔树脂处理后的鳕鱼蛋白酶解液中的多肽含量,多肽损失率计算:

式中,W0—鳕鱼蛋白酶解产物中多肽含量;W1—大孔树脂处理后的鳕鱼蛋白酶解产物中的多肽含量。
1.3.6 SPME-GC-MS分离鉴定
将鳕鱼蛋白酶解液及大孔树脂最佳工艺处理后的酶解液分别通过固相微萃取法(SPME)进行腥味物质萃取,并通过GC-MS进行分离及鉴定。
SPME:萃取纤维采用65 μm PDMS/DVB。
GC:色谱柱采用为 HP-INNOWax(30 m ×0.25 mm ×0.25 μm),进样口温度250℃;初始柱温40℃,保持3 min,以8℃ /min的速度升温至250℃,保持10 min;载气为氦气(He),流量为 0.8 mL/min。不分流进样。
MS:电子轰击(EI)离子源,离子源温度250℃,电子能量70 eV,检测器电压为350 V,质量扫描范围m/z 35~500。
通过计算各物质的Kovats指数,进一步为物质定性,并通过检索Flavor数据库(http://www.flavornet.org)、LRI& Odour数据库(www.odour.org.uk)及文献值[14]等,对物质进行风味描述。
2 结果与讨论
2.1 大孔树脂脱腥单因素实验
2.1.1 不同型号大孔树脂脱腥效果比较
以大孔树脂型号为变量进行单因素实验,脱腥效果如图1-a所示。由图可知,就腥味分值而言,大孔吸附树脂(DA201-C、D4006、AB-8)对腥味物质的吸附能力高于离子交换树脂(001×7、D151、D201、D311);就多肽吸附能力而言,阳离子交换树脂(001×7、D151)的吸附能力高于阴离子交换树脂(D201、D311),大孔吸附树脂中,DA201-C吸附较多的多肽,多肽损失率最高,而在D4006型和AB-8型2种吸附树脂作用下,多肽损失率较低。因此,从腥味分值和多肽损失率两个角度综合考虑,AB-8型大孔吸附树脂可吸附较多的腥味物质但又不至于损失大量多肽,脱腥效果较好。因此,本实验选取AB-8型大孔吸附树脂作为最佳树脂类型,用于后续的单因素实验及响应面试验。
2.1.2 温度对大孔树脂脱腥效果的影响
由图1-b可知,在15~55℃范围内,随着温度的升高,经AB-8型大孔树脂吸附处理后的酶解液的多肽损失率呈上升趋势,而腥味分值呈降低趋势,且两者的变化幅度均随温度升高而逐渐减弱。这表明,在一定范围内,升高温度,可促使AB-8型大孔树脂更多地吸附多肽,致使多肽损失率上升;相应地,升高温度也可促进AB-8型大孔树脂对不良风味物质的吸附,此外,温度的升高有利于腥味物质的挥发,2种作用可共同导致腥味分值的降低。从腥味分值和多肽损失率两个角度综合考虑,当温度介于25~45℃之间时,脱腥效果较好。因此,本实验选取25、35及45℃,作为后续响应面试验中温度的3个水平。
2.1.3 树脂添加量对大孔树脂脱腥效果的影响
由图1-c可知,在2.0%~20.0%范围内,当树脂添加量增加时,酶解液的多肽损失率呈上升趋势,腥味分值大幅下降,而当树脂添加量由10.0%增至20.0%时,腥味分值增幅很小,分值介于1.5~2.0之间,即表现为“腥味较弱”。这表明,在一定范围内,增加树脂量可加大AB-8型大孔树脂对鳕鱼蛋白酶解液中多肽的吸附,致使多肽损失率升高;相应地,树脂量的增加也可促进对腥味物质的吸附,但当树脂添加到一定量时,继续加大树脂量,对腥味物质的吸附因趋于饱和而无明显变化。从腥味分值和多肽损失率两个角度综合考虑,当树脂添加量介于5% ~15%之间时,脱腥效果较好。因此,本实验选取5%、10%及15%,作为后续响应面试验中树脂添加量的3个水平。
2.1.4 pH对大孔树脂脱腥效果的影响
由图1-d可知,当pH值由4升至9时,酶解液的多肽损失率均在15%上下浮动,无明显变化;而在pH值由4升至7时,腥味分值大幅降低,酶解液由“腥味偏重”变为“腥味较弱”或“略有腥味”,当pH值继续升高时,腥味分值略微上升。这表明,pH值的高低对多肽吸附率影响甚微;对腥味而言,中性环境更利于AB-8型大孔树脂对鳕鱼蛋白酶解液中腥味物质的吸附。从腥味分值和多肽损失率两个角度综合考虑,当pH值介于6~8之间时,脱腥效果较好。因此,本实验选取6、7、8作为后续响应面试验中pH的3个水平。
2.2 响应面法优化大孔树脂脱腥工艺
2.2.1 响应面试验结果分析
采用Design-Expert 7.0软件对响应面试验结果进行统计分析,并对各因素进行二项式拟合,并应用该软件绘制各指标与其他2个自变量的三维曲面图。响应面试验结果见表3,方差分析见表4。
根据实验结果,分别对腥味分值Y及多肽损失率W进行二次多项式拟合,得到回归模型如下:


表3 响应面试验结果Table 3 Experimental results of response surface model
由表4可以看出,本实验所选用的二次多项模型显著(P<0.05),失拟项不显著(P值分别为0.053 1、0.080 5,均大于0.05),这说明此回归模型理想,用方程Y和W拟合3个因素与腥味分值及多肽损失率之间的关系是可行的。对于腥味分值,其决定系数R2为0.973 5,校正决定系数Radj2为0.933 5,说明该模型能解释93.35%的响应值。对于多肽损失率,其决定系数R2为0.993 0,校正决定系数Radj2为0.984 0,说明该模型能解释98.40%响应值。

表4 腥味分值(Y)、多肽损失率(W)回归模型方差分析Table 4 ANOVA on regression model of fishy odor value and polypeptide loss ratio
方差分析结果表明,X1、X2、X3、X12、X22和X32对腥味分值Y影响显著,即温度、树脂添加量、pH三个因素均对腥味值有显著影响;X1、X2、X3、X12、X1X3对多肽损失率影响显著,即温度、树脂添加量、pH三个因素均对肽损失率有显著影响,交互项温度/pH对肽损失率也有显著影响。
2.2.2 各因素对响应值的影响
各因素对响应值的影响如图2(a~c)所示,在实验范围内,腥味分值随着温度、树脂添加量、pH的增加出现下降,但继续增大3者用量反而导致腥味分值的增加,这说明腥味分值Y具有低点。如图2(d~f)所示,在实验范围内,多肽损失率W随着温度、树脂添加量、pH的增加呈现先升高后降低的趋势,说明这3个因素均有最佳值。

图2 各因素交互效应三维曲面图Fig.2 3D surface images of interaction effects
2.2.3 大孔树脂静态吸附脱腥最优工艺验证
通过Design-Expert 7.0软件,按照优化目标,将腥味分值Y设置为最小“minimize”,将多肽损失率W设置为最小“minimize”,得到最优工艺为温度25℃、树脂添加量13.23%、pH 8.0,此工艺下腥味分值Y预测为1.9,多肽损失率W预测为17.62%。按照该最佳工艺条件重复试验3次,得到平均腥味分值Y为2.0,多肽损失率W为17.89%,实验结果与软件预测值接近,说明该工艺稳定、可靠。
2.3 SPME-GC-MS验证脱腥前后腥味物质的变化
对鳕鱼蛋白酶解产物及AB-8型大孔树脂在最佳工艺下脱腥后的酶解产物分别进行SPME-GC-MS分离鉴定,得到的挥发性风味物质总离子流色谱图如图3所示,所示挥发性风味物质鉴定结果见表5。

图3 脱腥前后总离子流色谱图对比Fig.3 Total ions chromatogram of hydrolysate before and after deodorization
由图3可知,在该GC-MS条件下得到的总离子流色谱图的分离度较好。由表5可知,经AB-8型大孔树脂最佳工艺处理后,鳕鱼蛋白酶解产物中的8种挥发性风味物质被脱除,且其他物质的丰度均有一定程度降低。被脱除的风味化合物中,1-戊烯-3-醇、己醛、2-己烯醛及异戊酸冰片酯等是水产品中常见的腥味来源[15]:1-戊烯-3-醇主要赋予鳕鱼蛋白酶解液以蘑菇、肉味和温和油脂风味,具有低阈值和高风味活性的特点,被证明对北极虾[16]等水产品的风味构成亦有较大贡献;己醛、己酸甲酯等,主要赋予鳕鱼蛋白酶解产物以青草味、清香味;异戊酸冰片酯(bornyl isovalerate)是鳕鱼蛋白酶解液土腥味的主要来源[17]。因此,SPMEGC-MS结果表明,经AB-8大孔树脂最佳工艺处理后的鳕鱼蛋白酶解产物,其腥味有所减弱,该方法可有效脱除鳕鱼蛋白酶解产物中的腥味物质。
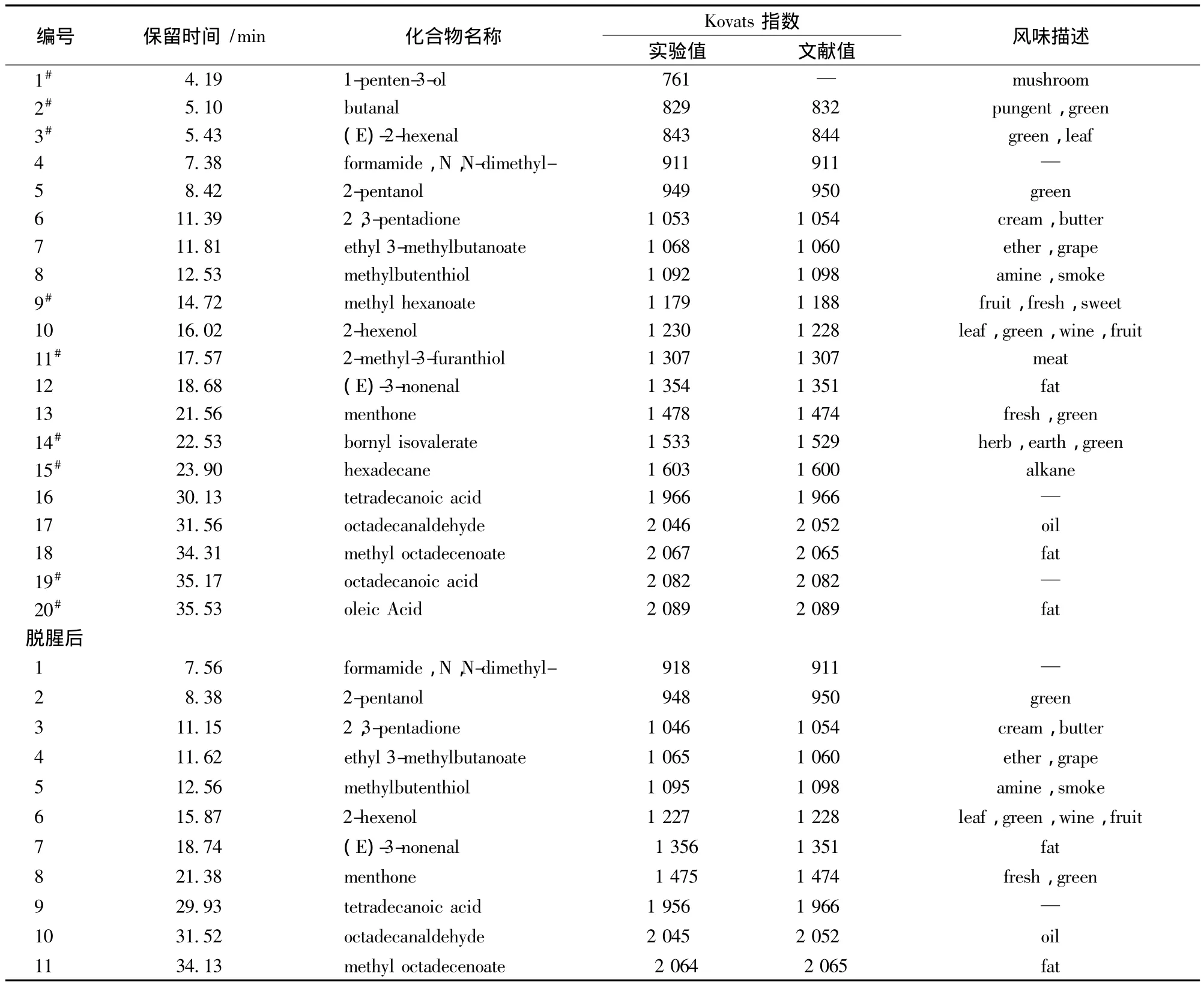
表5 GC-MS及Kovats指数鉴定结果Table 5 Identification results of GC-MS and Kovats indices
3 结论
(1)单因素实验结果表明,AB-8型大孔吸附树脂脱腥效果最佳;其他条件相同,当温度介于25~45℃时,当树脂添加量介于5% ~15%时,当pH在6~8范围内时,脱腥效果较好。
(2)AB-8型大孔树脂对鳕鱼蛋白酶解液的最佳脱腥工艺为:温度25℃、树脂添加量13.23%、pH 8.0。此工艺下脱腥得到的酶解液腥味分值为2.0,多肽损失率为17.89%,与软件预测值接近。
(3)验证实验及SPME-GC-MS分析表明,该脱腥工艺有效、可靠,可作为AB-8型大孔树脂对鳕鱼蛋白酶解液的最佳脱腥工艺。
[1] 中国科学院海洋研究所.中国经济动物志-海产鱼类[M].北京:科学出版社,1962.
[2] Bjorn T D,Svein K S,Rune L,et al.Utilization of fish in-dustry residuals:Screening the taurine concentration and angiotensin converting enzyme inhibition potential in cod and salmon[J].Journal of Food Composition and Analysis,2009,22(7):714-717.
[3] Je J Y,Park P J,Kim S K.Antioxidant activity of a peptide isolated from Alaska Pollack(Theragra chalcogramma)frame protein hydrolysate [J].Food Research International,2005,38(1):45-50.
[4] ZHUANGY L,SUN L P,ZHAOX,et al.Antioxidant and melanogenesis-inhibitory activities of collagen peptide from jellyfish(Rhopilema esculentum)[J].Journal of the Science of Food and Agriculture,2009,89(10):1 722-1 727.
[5] Gildberg A,Stenberg E.A new process for advanced utilization of shrimp waste[J].Process Biochemistry,2001,36(8-9):809-812.
[6] Yarnpakdee S,Benjakul S,Nalinanon S,et al.Lipid oxidationand fishy odour development in protein hydrolysate from Niletilapia(Oreochromis niloticus)muscle as affected by freshness and antioxidants[J].Food Chemistry,2012,132(4):1 781-1 788.
[7] 邓后勤,夏延斌,邓友光.鱼制品脱腥技术研究进展[J].食品与发酵工业,2006,32(5):109-112.
[8] 许秀娟,钟茂红,蒋仙玮.水产品除腥技术研究进展[J].中国食物与营养,2009(2):32-35.
[9] 张灿,徐岩,范文来.不同吸附剂对白酒异嗅物质去除的研究[J].食品工业科技,2012,33(12):60-65.
[10] 曾绍东,吴建中,欧仕益,等.阳离子交换树脂脱除罗非鱼酶解液腥味的研究[J].离子交换与吸附,2010,27(1):61-68.
[11] 米恒振.鳀鱼酶解液中不良风味的吸附与脱除[D].青岛:中国海洋大学,2010:48.
[12] 贾存琴,李阳春,屠鹏飞,等.D-101型大孔吸附树脂预处理方法的研究[J].中草药,2006,37(2):193-196.
[13] 鲁伟,任国谱,宋俊梅.蛋白水解液中多肽含量的测定方法[J].食品科学,2005,26(7):169-171.
[14] Kristel K,Erich L,Toomas P.Determining aroma-active compounds in Kama flour using SPME-GC/MS and GCOlfactometry[J].Flavour and Fragrance Journal,2011,26(2):122-128.
[15] 章超桦,平野敏行,铃木健,等.鲫的挥发性成分[J].水产学报,2000,24(4):354-358.
[16] 解万翠,杨锡洪,章超桦,等.顶空固相微萃取-气相色谱-质谱法测定北极虾虾头的挥发性成分[J].分析化学,2011,39(12):1 852-1 857.
[17] 杨玉平,熊光权,程薇,等.水产品异味物质形成机理、检测及去除技术研究进展[J].食品科学,2009,33(23):533-538.
