金针菇胞外多糖的化学结构及其抗氧化活性分析
2015-12-25沙日娜
沙日娜
(包头轻工职业技术学院,内蒙古包头,014035)
金针菇(Flammulina velutipes(Fr.)Singer),又名金钱菌,属真菌门(Eumycophyta),担子菌亚门(Basidiomycotina),层菌纲 (Hymenomycetes),伞菌目(Agaricales),口磨科(Tricholomataceae),小火焰菌属(Flammulina)或金钱菌属(Collybia)。金针菇口味鲜美,营养丰富,富含多种生物活性物质,如多糖、维生素、蛋白质、多元酚、朴菇素、膳食纤维等。近年来的研究表明,金针菇提取物具有免疫调节[1-2]、降胆固醇[3]、抑制肿瘤生长[4-6]等多种生理功能,但是其功效关系尚不清楚,其中金针菇多糖被认为是重要的功能因子之一。本研究对金针菇胞外多糖通过DEAE-52纤维素柱和G-100葡聚糖进行分离纯化,分别研究了FEPS-1和FEPS-2的分子量、单糖组成、键型和抗氧化活性。
1 材料与方法
1.1 材料、试剂与仪器
供试菌种:金针菇(Flammulina velutipes),内蒙古农科院保存。
深层液体种子培养基:马铃薯200 g,葡萄糖20 g,KH2PO41 g,MgSO4·7H2O 1 g,VB10.1 g,水 1 L,pH自然。
液体种子培养条件:25℃恒温摇床160 r/min振荡培养10 d。
深层液体发酵培养基:马铃薯200 g,葡萄糖20 g,KH2PO41 g,MgSO4·7H2O 1 g,VB10.1 g,蛋白胨3 g,酵母粉 3 g,水 1 L,pH 自然。
深层液体发酵培养条件:100 L气升式液体深层发酵罐中培养14 d,发酵温度25℃,连续通入无菌空气。
30%H2O2,天津市凯通化学试剂有限公司;体积分数为95%的乙醇,天津市百世化工有限公司;DPPH,Sigma公司;DEAE-52纤维素,Sigma公司;葡聚糖G-100,Sigma公司;苯酚天津市天大化学试剂厂;浓H2SO4,淄博化学试剂厂有限公司;浓HCl,淄博化学试剂厂有限公司;三氯乙酸,天津大茂化学试剂厂。
752-N紫外可见分光光度计,上海精宏实验设备有限公司;GC2010气相色谱仪,日本津岛公司;TDL-5-A型台式离心机,上海安亭科学仪器厂;Nicolet380傅立叶变换红外光谱仪,美国热电集团;Nicolet380傅立叶变换红外光谱仪,美国热电集团;DK-S24型恒温水浴锅,上海精宏实验设备有限公司;LXJ-68-02型离心机,北京医疗仪器修理厂;DZF-6021型真空干燥箱,上海精宏实验设备有限公司。
1.2 多糖的提取
首先对发酵液进行浓缩,浓缩温度为75℃,然后利用醇沉法提取金针菇胞外多糖。
1.3 成分含量测定
总糖含量采用苯酚-硫酸法[7]测定。
1.4 多糖的凝胶柱层析
首先采用DEAE-纤维素离子交换柱对多糖进行分离纯化,用浓度梯度为0.2,0.5,1.0 mol/L的NaCl溶液洗脱,洗脱速度控制在1 mL/min,每个洗脱梯度收集25管,每管收集2 mL,利用苯酚-硫酸法测定收集到的多糖溶液浓度,绘制洗脱曲线。然后葡聚糖G-100凝胶柱对多糖进行进一步分离纯化和纯度鉴定[8]。用0.1 mol/L NaCl溶液充分平衡层析柱后,用蒸馏水作为洗脱剂,洗脱速度控制在0.1 mL/min,每管收集2 mL,同样利用硫酸-苯酚法对收集到的多糖溶液浓度测定,绘制洗脱曲线。
1.5 多糖的分子质量测定
采用高效凝胶渗透色谱法(HPLC)对多糖的分子质量进行测定[9]。用高效液相色谱仪(1260,Agilent Technologies,USA),SHODEX SB-806HQ 色谱柱column(8.0 mm ×300 mm)及示差折光检测器测定。流动相为0.2 mol/L NaCl溶液,进样量为100 μL,流速为0.5 mL/min,柱温保持在5℃。标准品及样品质量浓度均为2 mg/mL。用葡聚糖系列样品作为标准品,以lgMw(分子质量对数)对ET(保留时间)绘制标准曲线,得线性回归方程:lgMw=1-0.342 9ET+11.975,R2=0.999 1。用 0.2 mol/L NaCl水溶液将样品配成质量浓度为2 mg/mL的溶液,上柱测定其保留时间,根据回归方程计算分子质量。
1.6 构成糖分析
糖样品经过酸加热完全水解(0.25 mol/L H2SO4,100 ℃,16 h),或者不经过水解处理,按照Blakeney[10]等制备成各单糖的全乙酰化糖醇衍生物,然后进行气相色谱(GC)分析(岛津 GC-14C,柱温210℃,N2流速30 mL/min),分离柱为岛津公司的毛细管柱DB-1(0.25 mm×30 m)。
1.7 多糖的红外光谱(IR)分析
多糖的 IR分析仪采用 Perkin Elmer公司的Spectrun GXFT-IR红外光谱分析系统。样品采用KBr压片法进行测定。
1.8 多糖的体外抗氧化分析
多糖对DPPH自由基的清除率测定反应体系如下:2 mL体积分数为95%的乙醇或DPPH(0.1 μmol/L),2 mL不同质量浓度的多糖溶液(100~1 000 mg/L)。反应混合物在25℃水浴15 min,在517 nm处测定吸光度[11]。清除羟基自由基的测定方法是采用Smironff(1989)的方法[12]。多糖还原力的测定方法根据 Oyaizu(1986)的方法[13]。
2 结果与分析
2.1 金针菇多糖的组分分离纯化
采用DEAE-纤维素柱对FEPS进行组分分离,分别利用蒸馏水和 0.2,0.3,0.5,1.0 mol/L 的 NaCl溶液作为流动相对FEPS洗脱,得到2个组分,如图1所示。FEPS分离得到FEPS-1和FEPS-2两个组分。对经过DEAE-纤维素分离得到的2个组分用葡聚糖G-100凝胶做进一步分离,如图2所示。FEPS-1和FEPS-2均分离得到一个单一的洗脱峰,表明FEPS-1和FEPS-2均为纯多糖。对FEPS-1和FEPS-2进行紫外光谱扫描(ultravialet spectrum,UV),试验结果显示FEPS-1和FEPS-2在280 nm处有特征吸收峰,表明两种组分可能是以糖蛋白的形式存在。
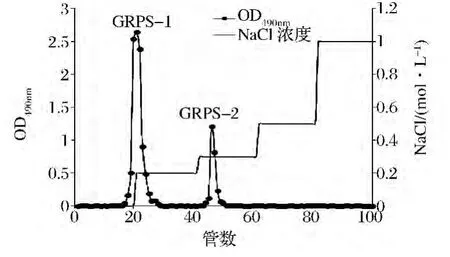
图1 FEPS的DEAE-纤维素离子交换柱层析洗脱曲线Fig.1 Elution curve of FEPS on DEAE-celluose collumn
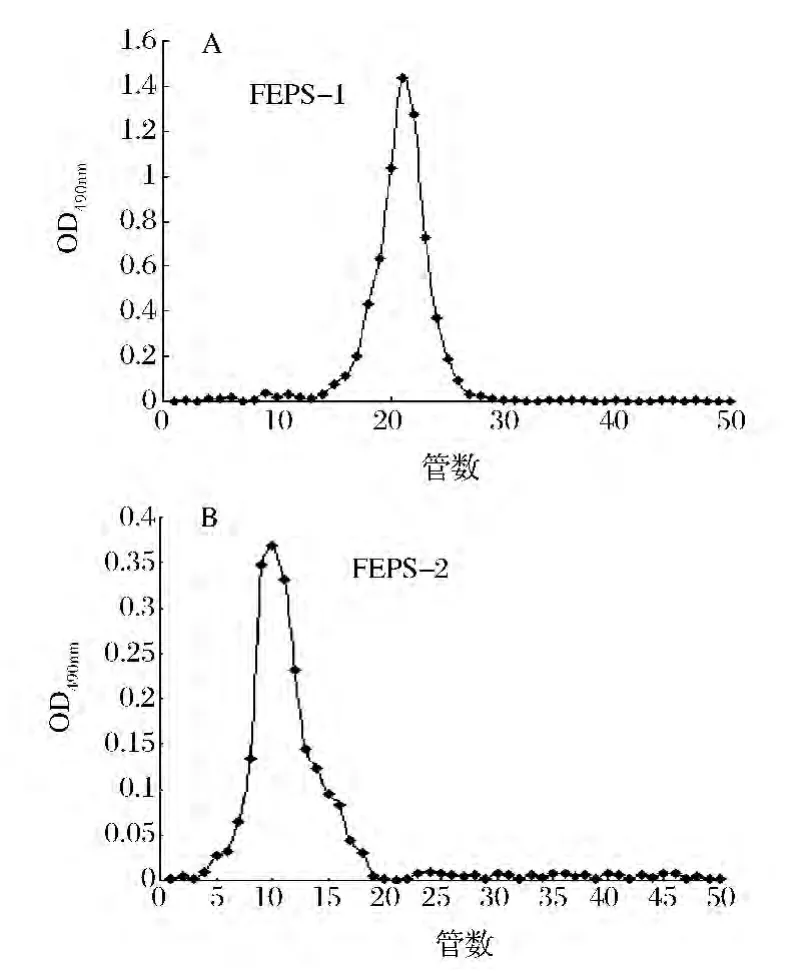
图2 两种多糖组分的葡聚糖G-100凝胶层析洗脱曲线(A)FEPS-1和(B)FEPS-2Fig.2 The profile of G-100 gel filtration chromatography by two polysaccharides(A)FEPS-1 and(B)FEPS-2
2.2 化学结构分析
由图3通过计算得知,FEPS的重均分子质量(Mw)为3.64×104Da,数均分子质量(Mn)为1.56×104Da,黏均分子质量(Mv)为3.28 ×104Da,Z 均分子质量(Mz)为7.14×104Da,峰位分子质量(Mp)为1.16×104Da。FEPS的Mw/Mn值为2.33。
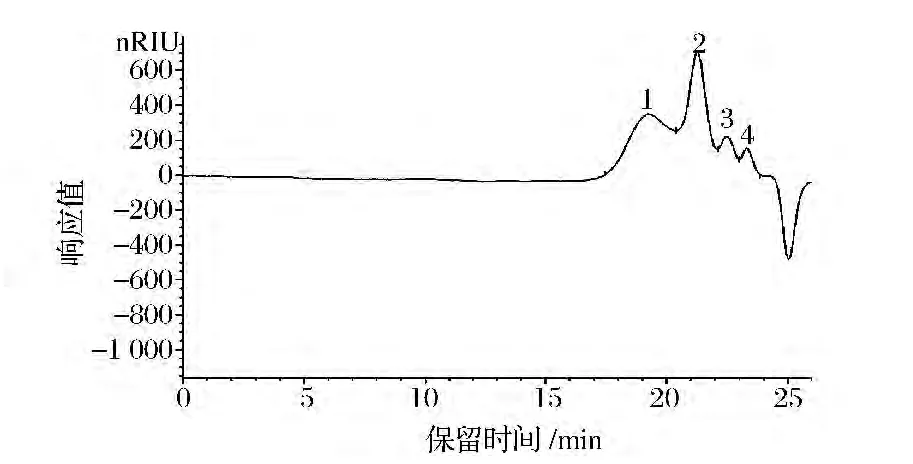
图3 FEPS高效液相色谱图分析Fig.3 HPLC spectra of FEPS
如图4所示FEPS-1的Mw为5.53×104Da,Mn为2.41×104Da,Mv为4.99×104Da,Mz为1.11×105Da,Mp为1.23×104Da。FEPS-1的Mw/Mn值为2.29。
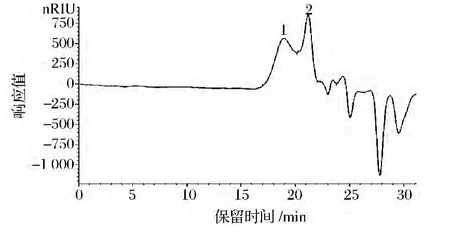
图4 FEPS-1高效液相色谱图分析Fig.4 HPLC spectra of FEPS-1
由图5可知,FEPS-2的Mw为1.36×104Da,Mn为1.05×104Da,Mv为3.55×104Da,Mz为1.20×105Da,Mp为1.14×104Da。FEPS-2的Mw/Mn值为1.29。
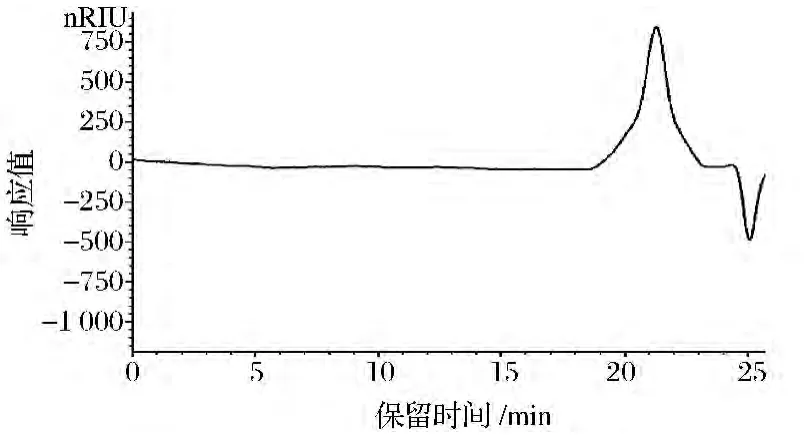
图5 FEPS-2高效液相色谱图分析Fig.5 HPLC spectra of FEPS-2
根据标样的保留时间来测定单糖的含量,由表1可知,FEPS-1主要由鼠李糖、葡萄糖、甘露糖和半乳糖,其含量分别为28.51%,62.94%,2.08%和6.47%,对应的摩尔比为 15.7∶31.3∶1.1∶3.3,由此可以看出,FEPS-1含量最多的单糖是葡萄糖和鼠李糖。FEPS-2主要由鼠李糖、葡萄糖和半乳糖组成,含量分别是68.23%,21.48%和10.29%,相应的摩尔比为37.5∶10.8∶5.2。可以看出 FEPS-2含量最多的单糖也是葡萄糖和鼠李糖。
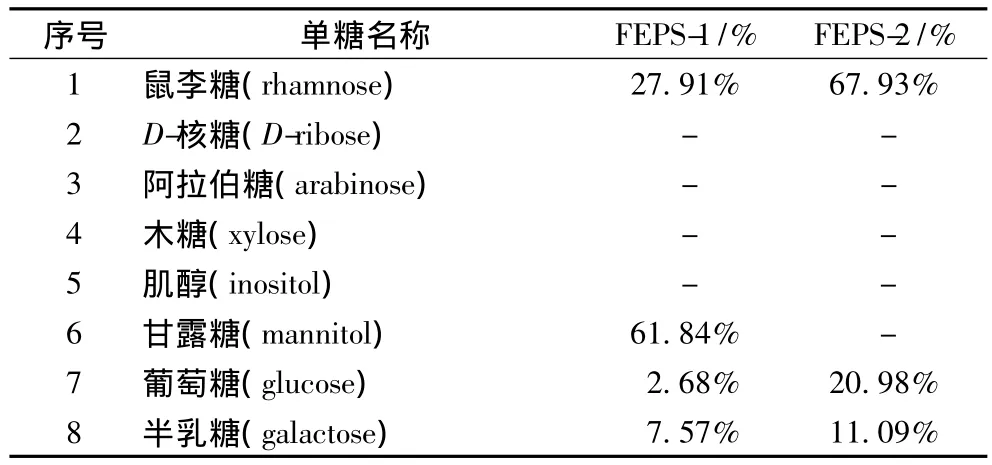
表1 气相色谱结果Table 1 Results of gas chromatograph
如图6所示,胞外多糖的两个组分(FEPS-1和FEPS-2)的红外光谱分析,两个组分在3 600~3 200 cm-1附近有较强的羟基(—OH)伸缩振动吸收峰[14]。FEPS-1在1 650.74 cm-1处的吸收峰说明有氮氢键(N—H)的存在[15]。FEPS-1 和 FEPS-2 分别在865.69 cm-1和880.72 cm-1处的吸收峰,表明它们的多糖结构中存在呋喃环[16]。
2.3 两种组分的体外抗氧化活性
2.3.1 FEPS-1和FEPS-2对DPPH的清除作用
图7表明,FEPS-1和FEPS-2清除DPPH的能力是随多糖浓度的升高而增大,在浓度为100 μg/mL时,FEPS-2对DPPH的清除率为(73.67±1.65)%。据报道,当质量浓度为100 μg/mL时,香菇多糖对DPPH的清除率为15%,灵芝多糖对DPPH的清除率为15%[17]。FEPS-2的EC50为(53±0.02)μg/mL远远高于香菇多糖(400 μg/mL)[18]和灵芝多糖(1 000 μg/mL)[17]。结果表明,FEPS-2对DPPH具有较高的清除率。
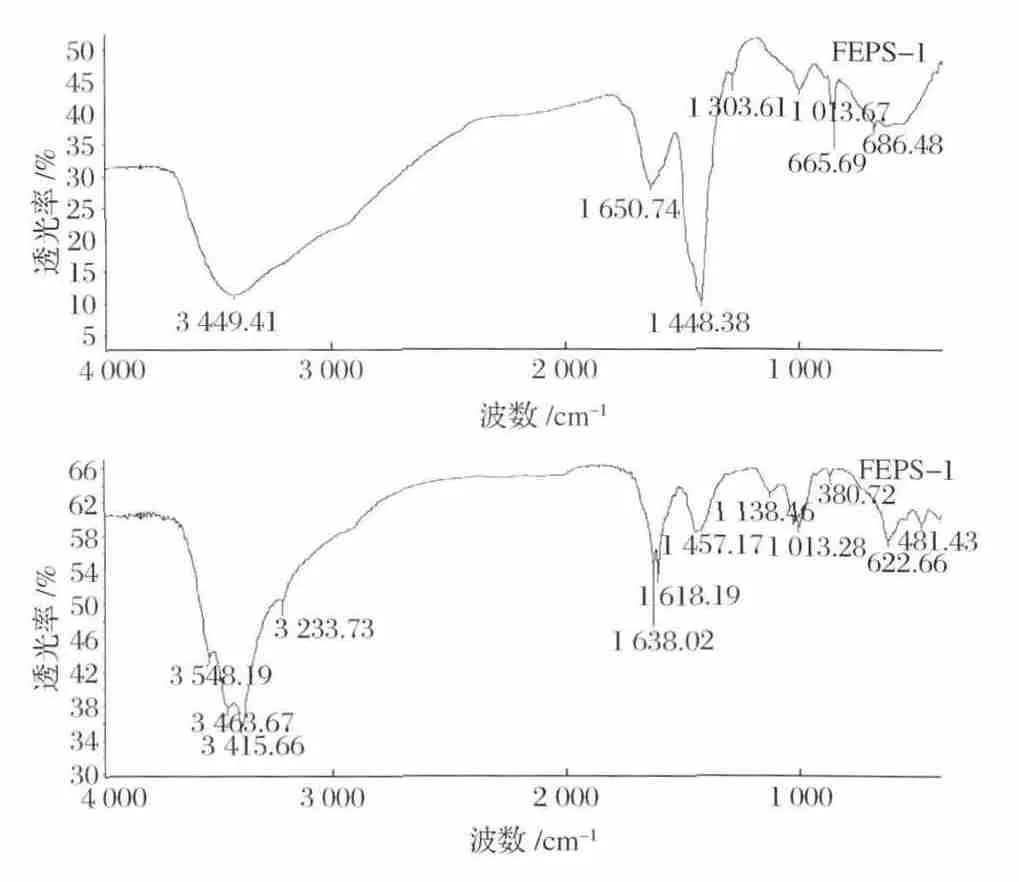
图6 FEPS-1和FEPS-2的红外光谱图Fig.6 FT-IR spectra of FEPS-1和FEPS-2
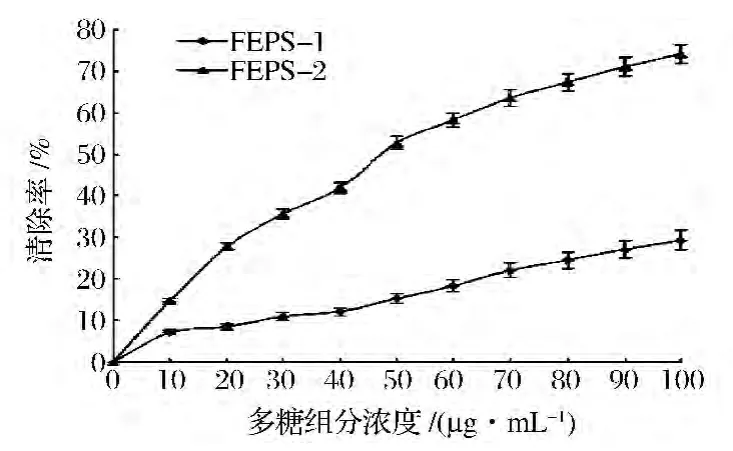
图7 FEPS-1和FEPS-2对DPPH的清除作用Fig.7 Scavenging effects of FEPs-1 and FEPs-2 on DPPH radicals
2.3.2 FEPS-1和FEPS-2对羟基自由基的清除作用
FEPS-1和FEPS-2对羟基自由基的清除作用见图8。在100 μg/mL时 FEPS-1和 FEPS-2对羟基自由基的清除率分别为(12.51±1.02)%和(69.94±4.81)%,FEPS-2对羟基自由基的清除作用是灵芝多糖[17]的2.41 倍,香菇多糖[18]的2.59 倍,白灵菇多糖[21]的 1.77 倍。
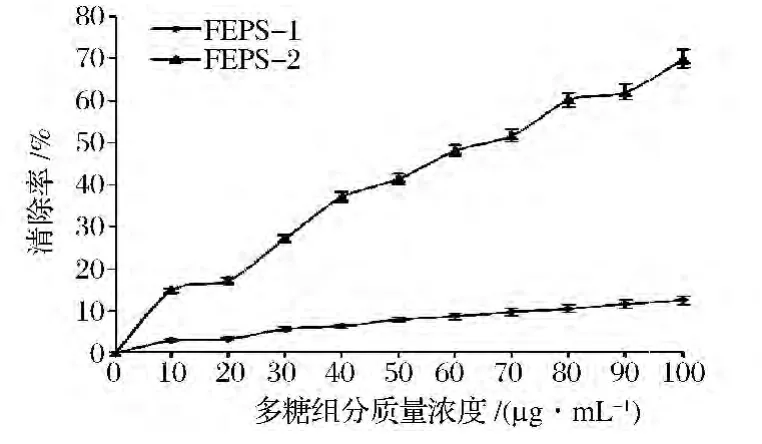
图8 FEPS-1和FEPS-2对羟基自由基的清除作用Fig.8 Scavenging effects of FEPs-1 and FEPs-2 on hydroxyl radicals
2.3.3 FEPS-1和FEPS-2的还原力测定
如图9所示,在100 μg/mL时,FEPS-1和FEPS-2在700 nm处测得的还原力分别为(0.23±0.04)和(0.41 ±0.02),FEPS-2的还原力比香菇高0.06,比白灵菇、金针菇、美味牛肝菌分别高 0.36,0.24,0.23[22]。说明2种组分都具有非常强的还原力,FEPS-2的还原力更为显著。

图9 FEPS-1和FEPS-2还原力测定Fig.9 Scavenging effects of FEPS-1 and FEPS-2 on DPPH radicals
3 结论
在本试验中,经过DEAE-纤维素离子交换柱和葡聚糖G-100凝胶柱的分离,FEPS分离得到多糖组分分别为FEPS-1和FEPS-2。利用气相色谱法测定了FEPS-1和FEPS-2单糖的组成。FEPS-1主要由鼠李糖、葡萄糖、甘露糖和半乳糖,FEPS-2主要由鼠李糖、葡萄糖和半乳糖组成。FEPS和FEPS-2中鼠李糖和葡萄糖含量都比较高。在结构分析中,通过红外光谱法对FEPS-1、GRPS-2在4 000~400 cm-1区段进行扫描,结果显示,两者均为含有呋喃环的多糖。
自由基是人体生命过程中生物化学反应产生的中间产物,体内自由基过多或清除缓慢均会引起分子、细胞甚至器官损伤,导致病变。结果表明,金针菇胞外多糖组分具有直接清除羟基自由基和DPPH的能力,且清除能力与多糖的浓度呈正相关,随多糖浓度的提高,FEPS-2清除率可达到70%以上。此外两者均有较强的还原力。
[1] Hsu H C,Hsu C I,Lin R H,et al.Fip-vvo,a new fungal immunomodulatoryprotein isolated fromVolvariellavolvacea[J].Biochem,1997,323(2):557-565.
[2] Hsieh K Y,Hsu C L,Lin J Y,et al.Oral administration of an ediblemushroom-derived protein inhibits the development of food-allergic reactions in mice[J].Clinic Experimental Allergy,2003,33(11):595-565.
[3] 魏华,谢俊杰,吴凌伟,等。金针菇营养保健作用[J]。天然产物研究与开发,1997,9(2):93-96.
[4] 孔祥辉,孙宇峰,任永春,等.金针菇免疫调节蛋白的研发与应用[J]。生物技术,2006,16(4):85-88.
[5] Leung M Y,Fung K P,Choy Y M.The isolation and characterization of animmunomodulatory and anti-tumor polysaccharide preparation from Flammulina velutipes[J].Immunopharmacology,1997,35(3):255-263.
[6] WANG H X,Ng T B.Flammulin:a novel ribosome-activating protein from fruiting bodies of the winter mushroom Flammulina velutipes[J].Biochem Cell Bio,2000,78(16):699-702.
[7] Gilles D M,Hamilton K A,Rebers J K,et al.Colorimetric method for determination of sugars and related substances[J].Anal Chem,1956,28(3):350-356.
[8] 王博,徐莎,黄琳娟,等。白芨多糖BSPI-A的分离纯化及结构研究[J]。食品科学,2010,31(7):120-123.
[9] LIN H J,QIN X M,Aizawa I,et al.Chemical properties of water-soluble pectins in hot-and cold-break tomato pastes[J].Food Chemistry,2005,93(3):409-415.
[10] Blakeney A B,Harris P T,Henry R J,et al.A simple and rapid preparation of alditol acetates for monosaccharide analysis[J].Carbohydrate Res,1983,113(83):219-299.
[11] LIU X H,FENG P Y,SHI Y L.Study of isolation and purification of polysaccharides from fresh mycelia of Agaricus blazei Mussill and its anti-fatigue effect[J].Journal of Southwest Agricultural University,2006,28(2):190-194.
[12] Smirnoff N,Cumbes Q J.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1 057-1 060.
[13] Oyaizu M.Antioxidative activity of browning products of glucosamine fractionated by organic solvent and thin layer chromatography[J].J Jpn Soc Food Sci,1986,35:771-775.
[14] CAI Wei-rong,XIE Liang-liang,CHEN Yong,et al.Purification,characterization and anticoagulant activity of the polysaccharides from green tea[J].Carbohydrate Polymers,2013,92(2):1 086-1 090.
[15] GAN D,MA L,JIANG C,et al.Production,preliminary characterization and antitumor activity in vitro of polysaccharides from the mycelium of Pholiota dinghuensis Bi[J].Carbohydrate Polymers,2011,84(3):997-1003.
[16] CHEN Y,MAO W J,Wang B F,et al.Preparation and characterization of an extracellular polysaccharide produced by the deep-sea fungus Penicillium griseofulvum[J].Bioresource Technology,2013,132(3):178-181.
[17] LI Z P,WU P,WU S Q.Study on antioxidant activity of Ganoderma applanatum intracellular polysaccharides[J].Sci Technol Food Ind,2010,31(6):108-110.
[18] Turlo J,Gutkowska B,Herold F.Effect of selenium enrichment on antioxidant activities and chemical composition of Lentinula edodes(Berk.)Pegl.mycelial extracts[J].Food Chem,Toxicol,2010,48(4):1 085-1 091.
[19] ZHANG J,ZHANG Z C,WANG Y H.Studies on water soluble polysaccharides from the mycelia of Ganoderma lucidum by alkaline extraction[J].J Food Sci Biotechnol,2005,3(24):98-100.
[20] 尹艳丽,王金荣,胡元森,等。香菇·灵芝菌丝体多糖的提取及复合抗氧化活性研究[J]。安徽农业科学,2010,38(18):9 521-9 522,9 530.
[21] 马淑凤,陈丽梅,徐化能,等.白灵菇胞外多糖的分离纯化及其抗氧化活性的研究[J]。江苏农业科学,2010,26:157-162。.
[22] 陈欣,龚兰,刘冠卉。食用真菌多糖提取条件的优化及其还原力的比较[J]。食品科学,2010,31(14):140-144。
