嗜热栖热菌海藻糖合酶的分子改造及其应用*
2015-12-25宿玲恰张悦吴敬
宿玲恰,张悦,吴敬
1(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
2(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡,214122)
海藻糖是由两个吡喃葡萄糖通过半缩醛羟基缩合,以α-1,1-糖苷键连接而成的非还原性二糖,广泛存在于微生物、植物和昆虫中[1-3]。海藻糖具有稳定的化学性质,能够有效保护生物膜和生物大分子,从而维持生命体的生命过程和生物特征。2000年7月,Nature中有关海藻糖评价专文提出:“海藻糖的存在与否关系着很多生命的生存或者死亡”。海藻糖还能够作为生物和医学领域中生物活性物质的优良保护剂和稳定剂。因此,海藻糖以其独特的理化性质和功能在食品加工业、医药业、农业、生化制品业和化妆品业等多个领域中具有广泛的应用前景[1,4-5]。
在海藻糖的制备方面,人们投入了大量精力对其制备工艺进行研究,并寻求简单有效的生产方式。目前,海藻糖的制备方法主要包括天然生物提取法、化学合成法、微生物发酵法和酶转化法。酶转化法又分为海藻糖合酶法、磷酸化酶法以及麦芽寡聚糖基海藻糖合成酶和麦芽寡聚糖基海藻糖水解酶双酶法[6-8]。其中,海藻糖合酶(Trehalose synthase,简称 TreS,EC 5.4.99.16)是一类分子内转糖苷酶,能够催化麦芽糖一步转化为海藻糖,具有成本低廉、转化工艺简单和产物易于分离提取等优势,为目前海藻糖制备方法的研究方向[9-10]。
海藻糖合酶来源于多种微生物,包括常温菌和嗜热菌。通常情况下,常温菌来源的酶的最适反应温度为25~35℃,最适pH 6.5~8.0。当采用该类酶制备海藻糖时,由于酶的作用环境适合于多种微生物生长,常常易受到杂菌污染,消耗反应底物和产物,造成原料浪费,同时使得反应体系pH难以控制,影响酶催化活性和稳定性。而嗜热菌来源的酶的最适温度一般高于60℃,并且在60~80℃、pH 5.5~9.5条件下仍然保持较好的稳定性,因此有利于通过提高酶反应温度减少微生物污染,避免损失[10-13]。
本研究团队前期研究中克隆表达了来源于嗜热栖热菌的海藻糖合酶,并优化了该酶催化麦芽糖制备海藻糖的酶转化工艺,但转化率仅有49.0%(数据将在《基因组学与应用生物学》杂志2015年第34卷发表)。本文通过定点突变,获得了催化性能提升的海藻糖合酶突变体,为其进一步工业化规模制备和应用奠定了基础。
1 材料和方法
1.1 菌种与质粒
E.coli JM109、E.coli BL21(DE3)、质粒 pET24a(+)-TreS为本实验室保藏。
1.2 主要试剂
琼脂糖、Prime STAR® HS DNA聚合酶和DpnI,TaKaRa(大连)公司;质粒提取试剂盒,天根(北京)生化科技有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)、卡那霉素(Kan),生工生物工程(上海)股份有限公司;蛋白质凝胶电泳试剂盒和蛋白分子量标准品,碧云天生物技术(上海)有限公司;高效液相色谱柱Syncronis Amino Column(4.6 mm ×250 mm),Thermo Scientific公司(美国);蛋白胨和酵母粉,Oxoid公司(英国);麦芽糖、海藻糖和葡萄糖等分析纯试剂,国药集团(北京)。
1.3 工程菌的构建
以质粒 pET-24a(+)-TreS为模板,通过一步PCR获得突变体 P251L。正向引物(P251L-F):5'-ATGTGGCCGGAGGAGACCCTGCCCTACTTCGGGGAC-3',反 向 引 物 (P251L-R):5'-GTCCCCGAAGTAGGGCAGGGTCTCCTCCGGCCACAT-3'。通过核酸电泳验证PCR扩增产物,利用Dpn I降解模板后,转化E.coli JM109,在LB琼脂固体培养基上培养8~10 h,挑取单克隆于LB液体培养,抽提质粒进行序列测定。将含突变正确的基因的质粒转化至E.coliBL21(DE3)中,从而获得重组表达海藻糖合酶突变体的基因工程菌。
1.4 培养基和培养条件
1.4.1 培养基
LB培养基(g/L):NaCl 10,蛋白胨10,酵母粉5,卡那霉素0.03,pH 7.0。
TB 培养基(g/L):蛋白胨12,KH2PO416.4,酵母粉24,K2HPO42.3,甘油5,卡那霉素0.03,pH 7.0。
1.4.2 培养条件
种子培养:将保藏于-80℃的甘油管中吸取20 μL菌液接种至含30 μg/mLKan的LB培养基中,于200 r/min、37℃恒温摇床中培养8~10 h。
摇瓶发酵:将种子液以5%接种量接至含30 μg/mL Kan的 TB培养基中,于37℃、200 r/min培养至OD600值达到 1.5,加入终浓度为 0.05 mmol/L的IPTG进行重组蛋白的诱导表达。
1.5 海藻糖的制备
1.5.1 海藻糖合酶转化条件的研究
用Na2HPO4-NaH2PO4缓冲液配制一定浓度的麦芽糖底物溶液,取10 mL装于50 mL具塞三角瓶中,然后加入一定量的酶液,置于水浴摇床中以150 r/min进行酶反应,定时取样,沸水浴10 min,并以12 000 r/min离心10 min后,将上清液用0.22 μm滤膜过滤,稀释,利用HPLC检测(见1.6.4)反应产物中海藻糖的生成量。
1.5.2 海藻糖转化率计算(公式1)

1.6 分析方法
1.6.1 大肠杆菌细胞光密度(OD600值)的测定
用去离子水作为空白对照,利用蛋白核酸定量仪测定经过适当稀释的菌液在波长600 nm下的吸光度值,OD600=读数×稀释倍数。
1.6.2 细胞破碎
收集重组菌发酵液,于12 000 r/min离心10 min后,弃去上清液,然后加入等体积磷酸缓冲液(20 mmol/L,pH 7.0)将菌体彻底悬浮。利用超声波细胞粉碎机破碎细胞 (工作条件:φ 6工作探头,时间15 min,工作3 s间歇2 s,功率25%),进而于12 000 r/min离心15 min,收集上清液即为海藻糖合酶酶液。
1.6.3 海藻糖合酶酶活力测定
将稀释一定倍数的酶液与用磷酸缓冲液(20 mmol/L,pH 7.0)配制的0.1 g/mL麦芽糖溶液均匀混合,置于60℃反应30 min后,沸水浴15 min将酶灭活以终止反应,然后通过HPLC检测(见1.6.4)反应液中海藻糖的生成量。
酶活单位定义:在上述反应条件下,每分钟生成1 μmol海藻糖所需的酶量定义为1个酶活力单位(U)。
1.6.4 海藻糖含量的HPLC分析
采用日立L-2000高效液相色谱仪检测海藻糖含量。HPLC检测条件为:NH2柱(APS-2 HYPERSIL,Thermo Scientific),柱温40℃,流动相为80%乙腈水溶液,流速0.8 mL/min,示差折光检测器。
2)季节温差产生的温度作用比较大,但是在工程实际中由于基础的变形会释放到一部分作用,在计算中应考虑,否则会大幅度提高用钢量。
1.6.5 SDS-PAGE蛋白电泳分析
使用购自碧云天生物技术有限公司的试剂盒进行SDS-PAGE蛋白电泳胶的制备,浓缩胶和分离胶的浓度分别为5%和12%,采用Tris-HCl,pH 8.3缓冲体系,电泳胶采用考马斯亮蓝G250(0.1%)染色。
2 结果分析
2.1 海藻糖合酶突变位点的选择
本研究从NCBI中搜索嗜热菌来源的、并且与本团队前期从嗜热栖热菌基因组获得的海藻糖合酶氨基酸同源性为98%~99%的海藻糖合酶氨基酸序列,经过多重序列比对,发现第251位点处氨基酸较为特殊。一方面,该位点非常保守,除了本团队获得的海藻糖合酶在该位点处为Pro,其他海藻糖合酶均为Leu(图1)。另一方面,以Mycobacterium smegmatis海藻糖合酶(PDB编号3zo9)为模板,利用SWISS-MODEL在线软件对本团队获得的海藻糖合酶空间结构进行模拟,发现该位点位于α-螺旋末端,由于Pro在二级结构中具有终止螺旋的作用,并且该螺旋一端的loop结构与活性中心相连(图2),可能对其催化功能产生不利影响。因此,本研究尝试将该251位点的Pro突变为Leu,从而提高该位点附近结构稳定性,阻挡底物流失,提高转化率。

图1 不同嗜热菌来源的海藻糖合酶多重序列比对Fig.1 Partial sequence alignments of trehalose synthase from different Thermus

图2 嗜热栖热菌海藻糖合酶空间结构模拟图Fig.2 Structure simulation of the T.thermophilus trehalose synthase
2.2 海藻糖合酶的定点突变和诱导表达
通过一步PCR法进行定点突变获得了突变体P251L,经DNA测序验证突变成功,进一步以E.coli BL21(DE3)为宿主菌进行突变体的表达,在37℃培养温度下经摇瓶发酵28 h时OD600值为6.9,海藻糖合酶酶活达到最高值为6.9 U/mL(图3)。经SDSPAGE分析,在理论值大小106 kDa附近出现明显目的条带(图4)。

图3 摇瓶发酵重组菌生长情况及产酶情况Fig.3 The cell growth of recombinant E.coli and production of trehalose synthase
2.3 海藻糖合酶突变体制备海藻糖的工艺优化
2.3.1 初始pH对海藻糖制备的影响

图4 重组大肠杆菌发酵制备海藻糖合成酶的SDS-PAGE的分析Fig.4 SDS-PAGE analysis of recombinant trehalose synthase
为了探究初始pH对海藻糖合酶突变体制备海藻糖的影响,利用不同pH(6.0~8.0)的20 mmol/L磷酸缓冲液配置0.3 g/mL的麦芽糖底物溶液,然后加入一定量的海藻糖合酶突变体在40℃下进行酶反应。从图5a可知,当初始pH在6.0~7.5范围内,转化率随pH的升高从40.2%逐渐提高至59.4%。当初始pH为7.5和8时,海藻糖合酶的转化率均为59.4%。本研究选择初始pH7.5继续开展其他条件对制备海藻糖影响的研究。
2.3.2 温度对海藻糖制备的影响
温度是影响海藻糖制备的一个重要因素,将反应体系初始pH设置为7.5,其他反应条件不变,考察不同反应温度(30~60℃)对海藻糖的制备影响。如图5b所示,当反应温度为50℃时,转化率最高,达到62.0%。此外,还考察了在50℃其他pH条件下的转化率情况,发现转化率均低于62.0%。前期研究发现天然海藻糖合酶的最适反应温度为40℃,但该温度较适合多种微生物生长,易造成微生物污染,导致麦芽糖和海藻糖的消耗,以及微生物生长代谢引起的pH下降等问题,使得酶失活进而转化率降低。突变体的最适反应温度为50℃,降低了微生物生长代谢带来的弊端,在海藻糖制备的实际应用中具有较大优势。
2.3.3 加酶量对海藻糖制备的影响
加酶量直接影响到生产成本,当酶促反应体系初始pH为7.5,反应温度为50℃,保证其他的反应条件不变,加酶量为5~30 U/g麦芽糖时,如图5c可知,当加酶量为5~20 U/g时,麦芽糖酶转化率随加酶量的增加而逐渐提高,当加酶量达到20 U/g麦芽糖时,转化率达到62.0%,继续增大加酶量,转化率不再继续上升,因此选择加酶量20 U/g麦芽糖,有利于降低工业成本,同时保证较高的转化率。
2.3.4 底物浓度对海藻糖制备的影响
将酶促反应体系初始反应pH设置为7.5,反应温度设置为50℃,加酶量为20 U/g麦芽糖,在底物质量浓度分别为0.1~0.6 g/mL下进行酶反应实验。结果如图5d所示,当底物质量浓度在0.1~0.5 g/mL范围内,转化率非常接近,分别为61.5%,62.0%,62.0%,61.9%和61.3%。然而,底物质量浓度高于0.6 g/mL时,转化率稍有下降,为54.4%。因此,总体而言,底物质量浓度对海藻糖制备的影响不大,在实际应用中,在较高底物质量浓度下进行酶反应,有利于提高生产强度,减少生产成本。

2.4 采用工业级麦芽糖制备海藻糖的研究
在上述研究获得了海藻糖制备最优条件的基础上,本文进一步探究了利用工业级麦芽糖制备海藻糖的情况。麦芽糖通常从淀粉水解获得,此过程会产生一定的葡萄糖,从生产成本角度考虑,在海藻糖的工业化生产中,所使用的麦芽糖均含有一定量的葡萄糖。有报道显示,以含有葡萄糖的底物进行酶促反应可能会因葡萄糖的抑制作用导致转化率下降[12-13]。因此,本研究考察了分别以含有0~0.07 g/mL葡萄糖的0.3 g/mL麦芽糖为底物的酶反应情况。如图6所示,当葡萄糖含量为0~0.05 g/mL时,转化率均保持在61.5% ~62.0%;葡萄糖含量为0.06 g/mL和0.07 g/mL时,转化率分别为61.0%和60.2%。因此,当底物中含有0.01 g/mL~0.07 g/mL葡萄糖时,转化率相差不大。
进一步分别用国药、罗盖特(中国)精细化工有限公司以及江苏省奥谷生物科技有限公司生产的麦芽糖(葡萄糖含量分别为0,0.01,0.03 g/mL)为底物,制备海藻糖,转化率分别为61.8%,61.8%和61.4%。由此可知,以工业级麦芽糖为底物制备海藻糖,对突变体的酶转化率影响很小,具备工业化具备海藻糖的潜力。
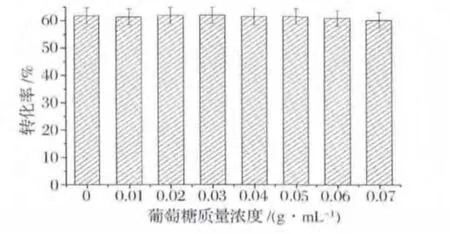
图6 葡萄糖含量对海藻糖生产的影响Fig.6 Effect of lactose concentration on trehalose production
3 结论
本团队前期工作中获得了一种嗜热栖热菌来源的海藻糖合酶,但其催化制备海藻糖的转化率较低。在本研究中,通过定点突变技术将其进行了分子改造,获得了突变体P251L,并在E.coli中进行了重组表达。进一步优化了该突变体制备海藻糖的转化条件,获得了最优反应条件为:初始pH为7.5,温度为50℃,加酶量为20 U/g麦芽糖,转化率达到最高值为62.0%,比天然酶提升了13.0%。此外,研究还发现,不同底物质量浓度(0.1~0.5 g/mL)和少量的葡萄糖(0~0.07 g/mL)对酶反应无明显影响。该研究对于完善海藻糖合酶的催化性能和功能优化提供了一定的借鉴意义,今后可继续对海藻糖合酶进行分子改造,进一步提升其催化转化制备海藻糖的应用性能,从而为海藻糖的工业化制备奠定基础。
[1] Elbein A D,Pan Y T,Pastuszak I,et al.New insights on trehalose:a multifunctional molecule[J].Glycobiology,2003,13(4):17-27.
[2] 靳文斌,李克文,胥九兵,等.海藻糖的特性、功能及应用[J].精细与专用化学品,2015(1):30-33.
[3] Lunn J E,Delorge I,Figueroa C M,et al.Trehalose metabolism in plants[J].Plant J,2014,79(4):544-567.
[4] YANG C R,YU R K.Intracerebral transplantation of neural stem cells combined with trehalose ingestion alleviates pathology in a mouse model of huntington 's disease[J].J Neurosci Res,2009,87(1):26-33.
[5] 陈海健.海藻糖的提取方法和性质研究[J].广东化工,2013,11(40):121-122.
[6] Zdzieblo A,Synowiecki J.Production of trehalose by intramolecular transglucosylation of maltose catalysed by a new enzyme from Thermus thermophilus HB-8[J].Food Chem,2006,96(1):8-13.
[7] WANG L,HUANG R,GU G B,et al.Optimization of trehalose production by a novel strain Brevibacterium sp.SY361[J].J Basic Microb,2008,48(5):410-415.
[8] 李镭,丁宏标,余晓斌,等.海藻糖酶法合成途径及其酶基因的重组表达研究[J].生物技术通报,2007(3):25-29.
[9] Koh S,Kim J,Shin H J,et al.Mechanistic study of the intramolecular conversion of maltose to trehalose by Thermus caldophilus GK24 trehalose synthase[J].Carbohyd Res,2003,338(12):1 339-1 343.
[10] Lee J H,Lee K H,Kim C G,et al.Cloning and expression of a trehalose synthase from Pseudomonas stutzeri CJ38 in Escherichia coli for the production of trehalose[J].Appl Microbiol Biot,2005,68(2):213-219.
[11] Nishimoto T,Nakada T,Chaen H,et al.Purification and characterization of a thermostable trehalose synthase from Thermus aquaticus[J].Biosci Biotech Bioch,1996,60(5):835-839.
[12] Chen Y S,Lee G C,Shaw J F.Gene cloning,expression,and biochemical characterization of a recombinant trehalose synthase from Picrophilus torridus in Escherichia coli[J].J Agr Food Chem,2006,54(19):7 098-7 104.
[13] WEI Y T,ZHU Q X,LUO Z F,et al.Cloning,expression and identification of a new trehalose synthase gene from Thermobifida fusca genome[J].Acta Bioch Bioph Sin,2004,36(7):477-484.
