牛血清白蛋白对牛胰脂肪酶交联酶聚体制备及催化性能的影响*
2015-12-25崔建东刘容麟
崔建东,刘容麟
(河北科技大学,生物科学与工程学院,河北省发酵工程技术研究中心,河北石家庄,050018)
脂肪酶(EC3.1.1.3,Lipase)是一种重要的生物催化剂,是一类特殊的酯链水解酶。该酶能催化多种反应,如酯化、水解和聚合反应等,在食品工业中可用于油脂加工、乳品中乳脂的降解以及作为酯溶性抗氧化剂及营养强化剂等[1-2]。但游离的脂肪酶在应用过程中,表现出不稳定、易失活的问题,限制了该酶的应用。大量研究表明,酶固定化技术能改善酶的稳定性和催化性能[3-5]。
交联酶聚体技术(CLEAs)是近年来国内外固定化酶研究的热点,该技术具有制备条件温和、操作简单、酶固定化效率和酶活保留率高等优点。目前已经被成功应用在苯丙氨酸解氨酶[6]、漆酶[7]、氨基酰化酶[8]等多种酶的固定化。但该方法也存在一些缺点,如形成的固定化酶颗粒小、机械强度低等。特别是,如果被固定化的酶表面所含有的氨基(—NH2)较少,则难以用交联剂(戊二醛)交联,导致交联固定化效率下降[9]。为了克服这个问题,有学者利用富含氨基的高分子多聚物和酶共沉淀交联,以提高CLEAs的交联效率[10-11]。但这些高分子聚合物含有大量的电荷,这些电荷会影响酶活性中心的微环境,导致酶的活性构象改变[12]。牛血清白蛋白(BSA)是一种富含氨基的惰性蛋白,由于BSA自身是一种蛋白质,对所要交联固定的酶没有负作用,因此是替代高分子聚合物提高CLEAs交联效率的理想辅助交联剂。因此,本研究以牛血清白蛋白作为一种辅助交联剂,研究了BSA对牛胰脂肪酶CLEAs制备及其催化性能的影响,以期能显著提高CLEAs固定化效率及催化效率。
1 材料与方法
1.1 材料与仪器
牛胰脂肪酶(lipase,15 mU/mg),阿拉丁试剂(上海)有限公司;牛血清白蛋白,Sigma公司;50%戊二醛,阿拉丁试剂(上海)有限公司;其他试剂均为市售分析纯。
S-4800-Ⅰ型场发射扫描电子显微镜,日本HITACHI;IX51倒置荧光显微镜,美国OLYMPUS;752型紫外分光光度计,上海光谱仪器有限公司;TGL-16C型离心机,上海安亭科学仪器厂;HC-3018型高速离心机,安徽中科中佳科学仪器有限公司;85-1B磁力搅拌器,巩义市予华仪器有限责任公司;FD-27真空冷冻干燥机,北京德天佑科技发展有限公司。
1.2 实验方法
1.2.1 牛血清白蛋白辅助交联制备脂肪酶交联酶聚体
取1.0 mL质量浓度为100 mg/mL游离脂肪酶与50 mg/mL的牛血清白蛋白混合(pH 7.5,50以mmol/L磷酸缓冲液配制)置于7 mL离心管中,并加入硫酸铵使体系中硫酸铵浓度为80%使蛋白析出。之后加入体积分数为50%的戊二醛,使其终浓度为1%,在25℃下搅拌交联1 h。离心分离后的沉淀用磷酸缓冲液(pH7.5,50 mmol/L)洗涤,获得交联脂肪酶聚集体(BSA-Lipase-CLEAs)。对于Lipase-CLEAs,除了在制备过程中不添加 BSA,其他制备条件与BSA-Lipase-CLEAs一致。
1.2.2 固定化脂肪酶的形态观察
固定化脂肪酶样品经真空冷冻干燥后,在真空条件下喷铂金,利用电子扫描显微镜(电子发射电压60~100 kV)检测。利用50 mg异硫氰酸荧光素(FITC)溶于8 mL二甲基亚砜(DMSO),加入100 mL溶有1 g脂肪酶的磷酸钠缓冲液(0.2 mol/L,pH 7.5),室温下避光搅拌溶解2 h。加入无水乙醇(与溶液的量大约等量即可)沉淀标记好的蛋白,离心除去多余的FITC。沉淀需要清洗3次。标记好FITC的脂肪酶用于固定化,用荧光倒置显微镜观察固定化酶。
1.2.3 酶活测定方法
用对硝基苯酚法测定脂肪酶酶活[13]。酶促反应液包括一定量的酶样品(溶于50 mmol/L的磷酸缓冲液,pH 7.5),5 mL 0.009 g/mL的对硝基乙酸酯,反应在37℃振荡保温5 min。10 000×g离心5 min,取上清液在410 nm下测吸光值。固定化酶的酶活测定与游离酶相似,根据对硝基苯酚标准曲线计算酶活。酶活力单位定义为:每分钟催化对硝基乙酸酯生成1 μmol对硝基苯酚所需的酶量为1个酶活力单位。
1.2.4 酶活回收率(公式(1))

1.2.5 统计分析
所有实验重复进行3次,利用SAS软件(v8.0)进行统计分析。
1.2.6 实验设计
1.2.6.1 固定化酶制备条件优化
利用单因素实验考察了BSA添加质量浓度(0,0.005,0.01,0.02,0.05 g/L)、戊二醛体积分数(0.5%,1.0%,1.5%,2.0%,2.5%)以及交联时间(0.5,1,1.5,2,2.5 h)对固定化酶的影响(考察某一因素时,其他制备条件不变,制备条件见1.2.1部分)。
1.2.6.2 固定化酶的动力学参数及最适催化条件考察
考察固定化酶的最适催化温度,将一定量酶样品分别在30、40、50、60和70℃条件下测定酶活,酶活的测定参照1.2.3部分。对于动力学参数的测定,取一定量的酶样品测定不同底物浓度(120,110,100,90和80 μmol/L对硝基乙酸酯)下的酶促反应速率,利用双倒数法得到Km和Vmax。
1.2.6.3 固定化酶的催化稳定性考察
对于温度稳定性,将游离酶和固定化酶分别置于60℃下处理1、2和3 h后,分别检测酶活。对于pH稳定性,将游离酶和固定化酶分别置于pH为4、6、8、10和12的磷酸缓冲液中处理12 h后,检测酶活。对于储存稳定性,将游离酶和固定化酶分别保存在50 mmol/L 磷酸盐(pH 7.5)中,于25 ℃放置1、3、6、9 和12 d,并在相对应的储存时间检测酶活。重复使用稳定性实验:将一定量的固定化酶在37℃条件下催化底物对硝基乙酸酯生成对硝基苯酚,反应5 min后,离心分离出固定化酶,用50 mmol/L磷酸盐缓冲液(pH 7.5)洗涤后,在固定化酶中加入新的底物进行第2轮反应,依此分批催化,每次催化反应后分别检测固定化酶剩余的酶活。直到检测不到酶活为止。
2 结果与讨论
2.1 固定化脂肪酶制备条件优化
2.1.1 对硝基苯酚标准曲线制备
标准曲线方程:Y=5.907 9X+0.028 1,R2=0.999 9,以此计算酶活。
2.1.2 BSA浓度对固定化酶的影响
从图1可以得出,BSA的添加对脂肪酶交联酶聚体的酶活回收率有较大的影响,随着BSA质量浓度的增加,CLEAs的酶活回收率也在增加,当BSA质量浓度为0.05 g/L时,最大酶活回收率达到70%(比不添加BSA制备的CLEAs酶活回收率提高了15%)。但当BSA浓度过大时,CLEAs的酶活回收率却又有所下降。这表明富含氨基的BSA提高了脂肪酶的交联效率,适当BSA的添加使大多数原本难以被戊二醛交联的脂肪酶分子被充分的交联,减少了脂肪酶分子的泄露,导致酶活回收率提高。但过量的BSA会与脂肪酶共同竞争戊二醛分子,使得戊二醛主要被用于交联BSA,而脂肪酶分子难以充分被交联,从而使脂肪酶的交联效率下降[14]。
2.1.3 戊二醛浓度对固定化酶的影响
由图2可以看出,随着戊二醛体积分数的增加,固定化酶的酶活回收率也在增加,当戊二醛体积分数达到1%时,酶活回收率达到最高,而随着戊二醛体积分数的继续增加,酶活回收率却开始下降。有研究表明,戊二醛不仅是酶蛋白的交联剂,同时也会破坏酶蛋白的结构,过量的戊二醛能进入酶的活性中心,破坏酶活性结构,导致酶变性失活[15]。从而使酶活回收率下降。
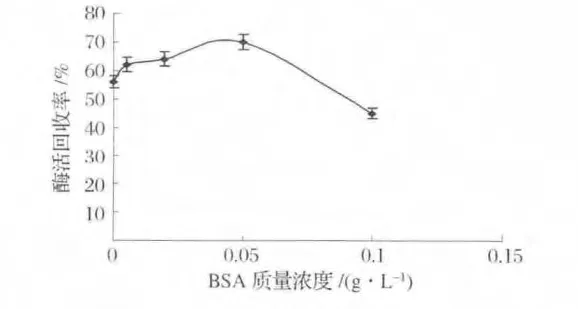
图1 BSA质量浓度对酶活回收率的影响Fig.1 Effects of BSA concentration on activity recovery
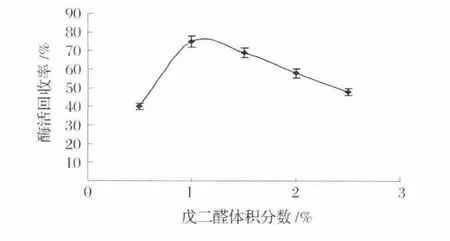
图2 戊二醛体积分数对酶活回收率的影响Fig.2 Effects of glutaraldehyde concentration on activity recovery
2.1.4 交联时间对固定化酶的影响
从图3可知,固定化酶的酶活回收率随着交联时间的增加而增加,交联2 h,酶活回收率达到最大。但随着交联时间的继续增加,酶活回收率下降。这可能是由于戊二醛既能作为酶蛋白的交联剂,同时有是酶蛋白的失活剂,酶蛋白与戊二醛长时间的接触会导致戊二醛直接作用酶分子的活性中性,改变酶的活性结构,反而使酶失活。导致固定化酶酶活回收率有所下降。

图3 交联时间对固定化酶酶活的影响Fig.3 Effects of cross-linking time on activity
2.2 固定化酶的形态观察
图4是扫描电镜和荧光倒置显微镜观察的固定化酶的图片。从图4可以看出,在10 μm标尺下,没有添加BSA制备的CLEAs的颗粒非常小,形态不规则,分布不均匀 (图4a),而添加BSA制备的CLEAs颗粒较大,且呈现出圆球状的颗粒,分布较为均匀(图4b)。这种均匀的球型结构更有利于酶促反应过程中固定化酶均匀地分散在反应液中,减少空间位阻现象的发生。荧光倒置显微镜表明,标记有FITC的酶蛋白在蛋白聚体中发出绿光(图4c,4d),表明酶蛋白已经被交联固定化。但添加BSA的脂肪酶CLEAs发出更多、更强的荧光(图4d),表明BSA的添加能提高脂肪酶的交联效率。

图4 固定化酶的形态Fig.4 Morphology of immobilized lipase
2.3 固定化酶最适催化温度和动力学参数
2.3.1 最适催化温度
图5是游离脂肪酶、未添加BSA制备的CLEAs和添加BSA制备的CLEAs的最适反应温度。由图5可以看出,经过交联固定化后,脂肪酶的最适反应温度由50℃迁移到了60℃,最适温度增加了10℃,当温度从60℃升高到70℃时,固定化脂肪酶比游离酶表现出更高的催化活性。表明CLEAs比游离酶有更好的温度适用性。
2.3.2 动力学参数
由表1可以看出,所有固定化的脂肪酶的Km均大于游离的脂肪酶,说明固定化导致底物与酶分子之间产生了底物扩散效应,从而使底物与酶活性中心的亲和力降低,最大反应速率有所降低。但相比而言,添加 BSA制备的 CLEAs比未添加 BSA制备的CLEAs表现出相对高的底物亲和力,催化效率(νmax/Km)也略高于未添加BSA制备的CLEAs。
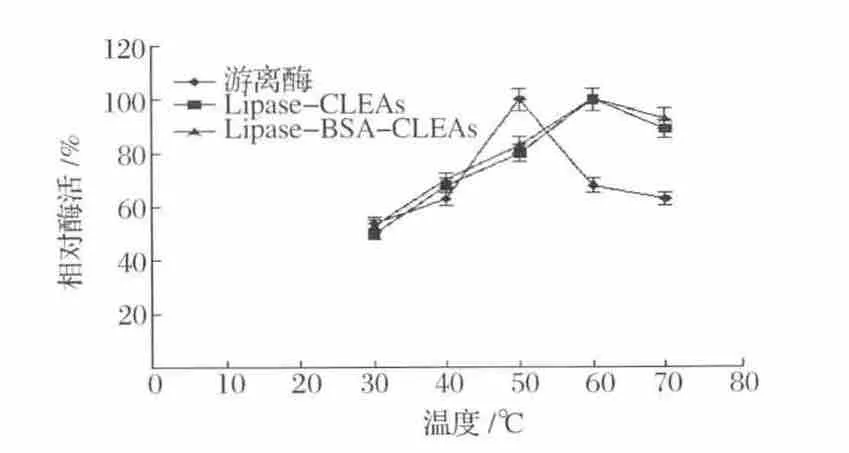
图5 固定化酶的最适催化温度Fig.5 Effects of temperature on the activity of immobilized lipase
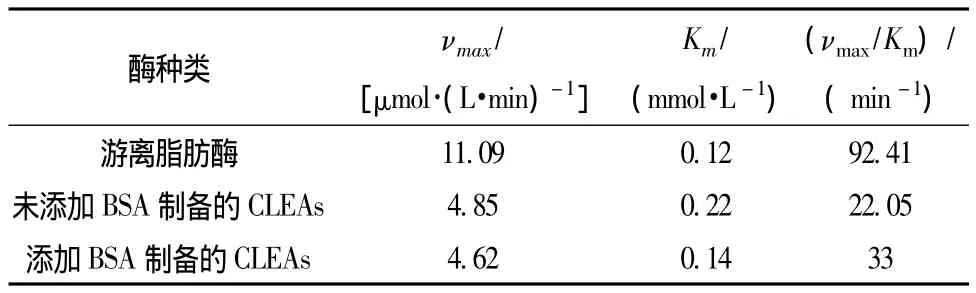
表1 固定化酶动力学参数Table1 Kinetic parameters of free lipase,lipase-CLEAs,and lipase-BSA-CLEAs
2.4 固定化酶催化稳定性
2.4.1 固定化酶温度稳定性
图6是固定化脂肪酶的温度稳定性曲线,结果表明,与游离酶相比,固定化酶具有更高的耐受高温的能力,在60℃下处理3 h时,游离酶基本损失了50%的初始酶活,而CLEAs始终能保持70%以上的酶活,相对于CLEAs,BSA的添加能提高CLEAs耐受高温的能力,处理 3 h后,添加 BSA的 CLEAs(Lipase-BSACLEAs)残留的酶活要高于不添加BSA的CLEAs。说明BSA的添加不但增强了脂肪酶的交联效率,而且大分子的BSA还能起到减缓高温传递速度,保护脂肪酶使其不失活,从而降低了脂肪酶的失活速率。
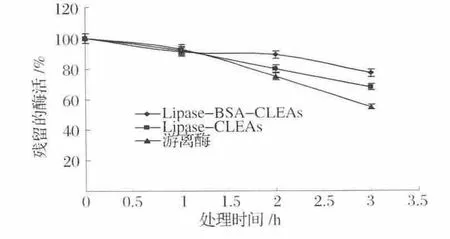
图6 固定化酶的温度稳定性Fig.6 Thermostability of immobilized lipase
2.4.2 固定化酶pH稳定性
图7是固定化酶pH的稳定性结果,与游离酶相比,所有的CLEAs在pH4~12时表现出较高的耐受性,而且,添加BSA制备的CLEAs比不添加BSA制备的CLEAs表现出更高的pH耐受性。例如,当在pH4的缓冲液中处理12 h时,Lipase-BSA-CLEAs酶活残留率始终能保持在近80%,但Lipsae-CLEAs只有45%的酶活保留率,而游离酶在此条件下只有20%左右的酶活保留率,这些结果表明,通过将脂肪酶固定化成CLEAs,能显著提高脂肪酶耐受酸碱的能力,而BSA的加入更有利于提高脂肪酶的交联效率,降低了酶分子从酶聚体中的泄漏,从而提高了脂肪酶的稳定性。
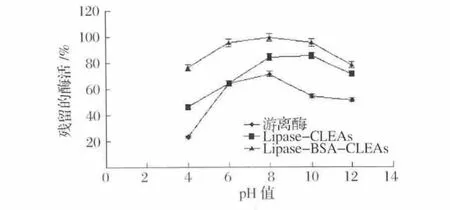
图7 固定化酶的pH值稳定性Fig.7 pH-stability of immobilized lipase
2.4.3 固定化酶储存稳定性
固定化酶的储存稳定性是评价固定化酶应用价值的重要指标[16]。图8是固定化酶储存25℃下的稳定性结果,在储存过程中,游离酶的酶活迅速下降,在储存第6天时酶活只有初始酶活的50%。但所有固定化的CLEAs酶活都表现出明显的增加,在储存第6天时Lipase-CLEAs和Lipase-BSA-CLEAs的酶活分别达到最大,分别是初始酶活的229%和158%。这种现象也被Ferreira等[17]人发现。他们认为,这种明显的提高可能是由于残留在酶聚体内部的戊二醛将没有被完全交联脂肪酶继续交联固定,同时,残留的戊二醛也会诱导脂肪酶活性中心的变化,导致酶活增加。
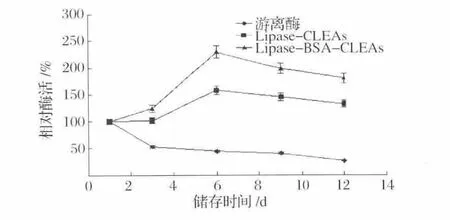
图8 固定化酶的储存稳定性Fig.8 Storage stability of immobilized lipase
2.4.4 固定化酶重复使用性
图9是固定化酶的重复使用稳定性结果。添加BSA制备的CLEAs的重复使用稳定性要优于不添加BSA制备的CLEAs,经过连续的7次重复使用后,Lipase-BSA-CLEAs还能保留初始酶活的80%左右,但Lipase-CLEAs只有初始酶活的30%,这个结果说明,BSA的添加增强了脂肪酶的交联效率,脂肪酶的泄漏减少,从而使固定化酶的重复使用性更好。
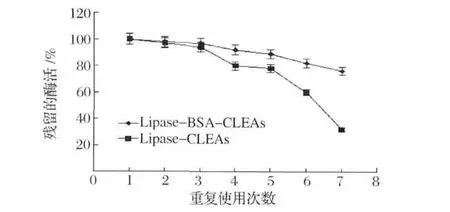
图9 固定化酶重复使用稳定性Fig.9 Recycling stability of immobilized lipase
3 结论
通过研究BSA的添加对脂肪酶交联酶聚体制备及稳定性的影响,获得最适的固定化酶制备条件是:BSA的最适添加质量浓度是0.05 g/L,戊二醛的体积分数为1%,交联时间是2 h。所得固定化酶的最大酶活回收率是70%。与不添加BSA所制备的CLEAs相比,酶活回收率增加了15%。同时,添加BSA所制备的CLEAs表现出较好的温度适用性、pH和储存稳定性,而且还具有优秀的重复使用稳定性,在连续重复使用7批次后,添加BSA所制备的CLEAs还能保持初始酶活的近80%。上述结果表明,这种通过添加BSA制备交联酶聚体是提高交联酶聚体催化效率的有效方法。
[1] 邬显章,邬敏辰.脂肪酶分子生物学的研究进展[J].食品与生物技术,2002,21(1):94-98.
[2] 王海燕,李富伟,高秀华.脂肪酶的研究进展及其在饲料中的应用[J].饲料工业,2007,28(6):14-17.
[3] López-Serrano P,Cao L,van Rantwijk F,et al.Cross-linked enzyme aggregates with enhanced activity:application to lipases[J].Biotechnology Letter,2002,24(16):1 379-1 383.
[4] 王静云,马翠丽,包永明.脂肪酶仿生固定化及性质[J].分子催化,2011,25(4):341-347.
[5] Kartal F,Kilinc A.Crosslinked aggregates of Rhizopus oryzae Lipase as industrial biocatalysts:preparation,optimization,characterization,and application for enantioselective resolution reactions[J].Biotechnology Progress,2012,28(4):937-945.
[6] 李连连,崔建东.以大孔硅胶为载体的苯丙氨酸解氨酶交联酶聚体的制备及性质研究[J].食品工业科技,2014(11):160-165.
[7] Matijosyte I,Arends I,Vries S D,et al.Preparation and use of cross-linked enzyme aggregates(CLEAs)of laccases[J].Journal of Molecular Catalysis B:Enzymatic,2010,62(2):142-148.
[8] Vaidya B K,Kuwar S S,Golegaonkar S B.Preparation of cross-linked enzyme aggregates of L-aminoacylase via coaggregation with polyethyleneimine[J].Journal of Molecular Catalysis B:Enzymatic,2012,74:184-191.
[9] Fernando L G,Lorena B,Aurelio H,et al.Co-aggregation of enzymes and polyethyleneimine:a simple method to prepare stable and immobilized derivatives of glutaryl acylase[J].Biomacromolecules,2005,6(4):1 839-1 842.
[10] CUI Dong-jian,JIA Shi-ru.Optimization protocols and improved strategies of cross-linked enzyme aggregates technology:current development and future challenges[J].Critical Reviews in Biotechnology,2013,35(1):15-28.
[11] Wilson L,Illanés A,Soler L,HenrÍquez M J.Effect of the degree of cross-linking on the properties of different CLEAs of penicillin acylase[J].Process Biochemistry,2009,44(3):322-326.
[12] Joo P H,Uhm K N,Kim H K.Biotransformation of amides to acids using a co-cross-linked enzyme aggregate of Rhodococcus erythropolis amidase[J].Journal of Microbiology and Biotechnology,2010,20(2):325-231.
[13] Bustos-Jaimes I,Garcia-Torres Y,Santillan-Uribe H,et al.Immobilization and enantioselectivity of Bacillus pumilus lipase in ionic liquids[J].Journal of Molecular Catalysis B:Enzymatic,2013,89(3):137-141.
[14] Wilson L,Illanés A,Soler L,et al.Effect of the degree of cross-linking on the properties of different CLEAs of penicillin acylase[J].Process Biochemistry,2009,44(3):322-326.
[15] CUI J D,ZHANG S,SUN L M.Cross-linked enzyme aggregates of phenylalanine ammonia lyase:novel biocatalysts for synthesis of L-phenylalanine[J].Applied Biochemistry and Biotechnology,2012,167(4):835-844.
[16] 张羽飞.仿生固定化酶制备及其催化特性研究[D].天津:天津大学,2008.
[17] Guauque Torres M P,Foresti M L,Ferreira M L.CLEAs of Candida antarctica lipase B(CALB)with a bovine serum albumin(BSA)cofeeder core:Study of their catalytic activity[J].Biochemical Engineering Journal,2014,90:36-43.
