全细胞催化合成L-苯基乳酸重组大肠杆菌的构建*
2015-12-25王颖范铭薛素妹钱凯齐斌朱益波
王颖,范铭,薛素妹,钱凯,齐斌,朱益波
1(吉林农业大学食品科学与工程学院,吉林长春,130118)
2(常熟理工学院生物与食品学院,苏州市食品生物技术重点实验室发酵工程技术研究中心,江苏常熟,215500)
苯基乳酸(phenyllactic acid,PLA),即2-羟基-3-苯基丙酸,是一种应用广泛的手性化合物[1-3]。近年来,研究发现PLA对大多数食源性致病细菌和真菌具有广谱而高效的抗菌活性[4-7],引起食品行业普遍关注。PLA作为乳酸菌苯丙氨酸的代谢产物,对人体和动物细胞均无毒性[8-10],是一种天然生物防腐剂。此外,它还具有溶解性好和热稳定性高、有效pH范围宽、使用方便等优点,有利于其未来在食品工业的普遍应用[11-14]。
L-苯基乳酸(L-phenyllactic acid,L-PLA)作为PLA两种手性对映异构体[15]中的一种,具有特殊的生物活性,可以作为手性中间体广泛应用于化工、医药、农药和生物合成等领域[16]。采用聚苯基乳酸替代矿物类工程塑料有助于减少矿物能源消耗和温室气体排放[17]。目前微生物转化合成D-PLA和L/DPLA消旋体[18-20]的研究较多,携带 Lactobacillus plantarum subsp.plantarum基因D-ldhY52V突变体的重组大肠杆菌E.coli BL21(DE3)/pET-28a-ldhD由于关键位点基因突变导致重组菌转化能力明显提高至77%摩尔转化率[21]。ZHENG[22]报道用凝结芽孢杆菌(Bacillus coagulans SDM)全细胞生产苯基乳酸产量高达37.3 g/L,转化率为70%。Leuconostoc mesenteroides ATCC 8293[23]生长细胞转化合成D-PLA最大值35 mmol/L,转化率高达75.2% ~83.3%。但目前报道D-PLA合成的文献较多,关于L-PLA合成的报道较少,且产量和光学纯度仍不理想。采用高效便捷的方法合成高光学纯度是L-PLA大量投入应用的前提。而生物催化因其高效和高度的立体选择性,成为手性合成最重要的方法之一。
乳酸脱氢酶是微生物合成PLA的一种关键酶,但由于微生物细胞内乳酸脱氢酶的表达受到严格调控,限制苯基乳酸合成[24]。因此,利用基因工程手段获得高效过表达乳酸脱氢酶的重组菌是提高苯基乳酸产量的有效途径。本研究构建了1株能够高效表达L-乳酸脱氢酶的基因工程菌E.coli BL21(DE3)/pET-28a-ldhL,此重组菌具有较高的还原苯丙酮酸(phenylpyruvic acid,PPA)生产L-PLA能力,可为进一步提高微生物合成PLA的产率、光学纯度和底物转化率提供借鉴。
1 材料与方法
1.1 材料与试剂
1.1.1 主要试剂
L-苯基乳酸、D-苯基乳酸和苯丙酮酸钠,国药集团;酵母提取物和胰蛋白胨,英国Oxoid公司;IPTG、DNA 聚合酶、DNA Marker、NADH(BBI)、X-Gal、硫酸卡那霉素、相关分子试剂盒、引物合成和DNA测序,上海生物工程公司;T4DNA连接酶、限制性内切酶,大连宝生物公司(TaKaRa);B-PER细菌总蛋白提取试剂,德国Thermo公司;所有实验试剂如果无特殊说明均为分析纯。
1.1.2 菌株、质粒和培养基
pMD19-T Simple Vector大连宝生物公司(TaKa-Ra);E.coli JM109,E.coli BL21(DE3),pET-28a(+)均为实验室保藏。
Luria-Bertani(LB)培养基:酵母粉5 g/L,蛋白胨10 g/L,NaCl 10 g/L。根据需要,在培养基中添加50 μg/mL的硫酸卡那霉素。
1.2 仪器与设备
PCR扩增仪、水平电泳系统、垂直电泳系统、凝胶成像系统、微孔板分光光度计,美国 Bio-RAD公司;高速台式离心机,德国Thermo公司;恒温金属浴,德国 Eppendorf公司;高效液相色谱仪,日本岛津公司;恒温振荡培养箱,太仓市华美生化仪器厂。
1.3 实验方法
1.3.1 分子克隆
基因组DNA的提取纯化、质粒DNA的提取纯化、DNA酶切、连接和转化、感受态细胞制备均参照文献[25]。根据美国国家生物技术中心(National Center ofBiotechndogy Information,NCBI)中 已 知 的B.megaterium WSH-002 L-乳酸脱氢酶基因(1dhL)序列设计特异性引物。上游引物:5’-GCGCCCATATGATGAAAACACAATTTAC-3’;下游引物:5’-CCGGGATCCTTACACAAAAGCTCTG-3’。为了便于克隆与连接,上游引物5’设计了Nde I酶切位点,下游引物5’设计了BamH I酶切位点。
以巨大芽孢杆菌 B.megaterium Z2013513(CCTCC:M2013244)基因组为模板,对ldhL基因进行PCR扩增。PCR反应体系(50 μL):10×PCR Buffer 5 μL,上下游引物(10 pmol)各2 μL,Mg2+(25 mmol/L)3 μL,dNTP 1 μL,Taq DNA 聚合酶(5 U/μL)1 μL,基因组模板 2 μL,灭菌超纯水 36 μL。PCR 扩增条件为:94℃预变性5 min,94℃变性1 min,55℃退火1 min,72℃延伸90 s,进行25个循环,最后72℃终延伸10 min。
PCR产物经1%琼脂糖凝胶电泳检测。将胶回收的目的基因片段亚克隆到pMD19-T简易载体,用T4DNA连接酶16℃连接过夜,转化至感受态细胞E.coli JM109中,根据蓝白斑筛选阳性克隆。通过双酶切鉴定后,获得阳性克隆子E.coli JM109/pMD19-T-ldhL,送往上海生工进行DNA测序。
1.3.2 重组表达质粒pET-28a-ldhL的构建
将克隆载体pMD19-T-ldhL经Nde I和BamH I双酶切产物进行核酸电泳胶回收,获得目的基因ldhL,连接至经Nde I和BamH I双酶切的表达质粒pET-28a(+),转化到E.coli BL21(DE3)感受态细胞中,经质粒酶切和菌落PCR验证,获得重组大肠杆菌BL21(DE3)/pET-28a-ldhL。
1.3.3 目的基因的诱导表达
挑取 E.coli BL21(DE3)/pET-28a-ldhL、E.coli BL21(DE3)/pET-28a(+)和 E.coli BL21(DE3)单菌落分别接种于10 mL LB液体培养基(含卡那霉素50 μg/mL),37 ℃,200 r/min培养过夜。按1%的接种量(体积分数)转接入100 mL LB培养基(含50 μg/mL卡那霉素)中,37℃,200 r/min培养至OD600值为0.4~1.0,添加IPTG至终浓度为1 mmol/L,于25℃,200 r/min诱导表达6 h。取诱导后菌液,8 000 r/min、4℃离心5 min,菌泥经超纯水洗涤2遍后稀释至OD600值为1,取1 mL稀释液离心收集菌体,加入100 μL超纯水和30 μL 5×上样缓冲液,充分混匀后沸水浴加热5 min,12 000 r/min、4 ℃ 离心 5 min,取10 μL上清进行SDS-PAGE分析。以12%的凝胶作分离胶,电泳结束后用考马斯亮蓝R250染色。经脱色液脱色后凝胶成像分析重组蛋白表达情况。
1.3.4 乳酸脱氢酶酶活力测定
诱导活化后的菌株E.coli BL21(DE3)、E.coli BL21(DE3)/pET-28a和E.coli BL21(DE3)/pET-28a-ldhL经离心洗涤后稀释至OD600值为1,取1 mL稀释液离心收集菌体,加入500 μL B-PER试剂,充分混匀后30℃涡旋裂解10 min,12 000 r/min、4℃离心5 min,取适量上清液进行乳酸脱氢酶酶活测定。
乳酸脱氢酶活性测定参照文献[26]并做适当修改,基本原理是鉴于NADH在340 nm处有最大吸收峰,通过光吸收峰值的改变定量测定酶的含量。酶活测定温度 30℃,3 mL的反应体系:pH 7.0,100 mmol/L磷酸钠缓冲液,含10 mmol/L苯丙酮酸钠,0.4 mmol/L NADH和适量粗酶液。在30℃、pH 7.0条件下,每分钟消耗1 μmol/L NADH所需的酶量为1个酶活单位(U/mL)。比酶活定义为:1 mg酶蛋白所含的酶活单位(U/mg)。蛋白质浓度测定方法:Bradford法[27],以不同浓度的牛血清蛋白做标准曲线。
1.3.5 重组大肠杆菌全细胞转化PPA合成L-PLA
菌体活化:从固体培养基上挑取E.coli BL21(DE3)/pET-28a-ldhL单菌落接种至装有10 mL新鲜LB培养基(含50 μg/mL卡那霉素)的100 mL三角瓶中培养,37℃、200 r/min过夜培养。
重组菌诱导及L-PLA合成:将活化好的重组菌E.coli BL21(DE3)/pET-28a-ldhL按1%(体积比)的接种量接种至装有100 mL新鲜LB培养基(含50 μg/mL卡那霉素)的500 mL三角瓶中,200 r/min、37℃培养至 OD600值为 1.2,加入诱导剂 IPTG至 0.2 mmol/L,25℃诱导6 h后,4℃、6 000 r/min离心5 min收集菌体。菌体用pH为7.0的磷酸钠缓冲液洗涤2次,重悬于10 mL磷酸钠缓冲液中,反应60 min后取500 μL转化液经10 000 r/min,4℃离心5 min,上清进行HPLC检测产物L-PLA和底物PPA物质的量浓度,菌泥进行OD600值检测。
1.3.6 高效液相色谱分析方法
将转化液离心,取上清液与流动相混合均匀,经0.22 μm滤膜过滤后采用HPLC检测L-PLA物质的量和光学纯度。PPA和L-PLA定量检测条件:色谱柱为Bio-Rad Aminex HPX-87H;流动相为5 mmol/L稀硫酸;流速0.6 mL/min;柱温30℃;进样体积5 μL,检测波长210 nm。L-PLA光学纯度检测条件为:手性柱OJ-RH,流动相:V(乙腈)∶V(甲醇)∶V(三氟乙酸)∶V(去离子水)=50∶50∶1.5∶900,流速 0.3 mL/min,柱温30℃,检测波长210 nm,进样量5 μL。
1.3.7 PPA摩尔转化率计算[公式(1)]
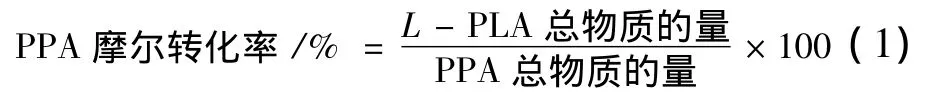
2 结果与分析
2.1 ldhL基因克隆及重组质粒的构建
以B.megaterium Z2013513基因组为模板进行PCR扩增,产物经琼脂糖凝胶电泳检测扩增片段大小约1.0 kb,(如图1A),片段大小与预期相符。将PCR产物连接至克隆质粒pMD19-T简易载体,经测序分析,ldhL基因长度为957 bp,表明已扩增到ldhL基因。重组表达质粒pET-28a-ldh L图谱如图2所示。重组克隆质粒pMD19-T-ldh L和重组表达质粒pET-28a-ldh L经Nde I和BamH I双酶切后进行琼脂糖凝胶电泳分析结果分别如图1B和图3A,表明克隆质粒和表达质粒均构建成功。E.coli BL21(DE3)/pET-28a-ldh L菌落PCR电泳图如3B,表明重组大肠杆菌能成功克隆并转录ldh L基因。

图1 PCR扩增产物电泳图(A);重组克隆质粒pMD19-T-ldhL(B)的酶切鉴定Fig.1 Electrophoresis of PCR amplification(A);Restrication analysis of recombinant cloning plasmid pMD19-T-ldhL(B)

图2 pET-28a-ldhL质粒图谱Fig.2 Map of recombinant plasmid pET-28a-ldhL
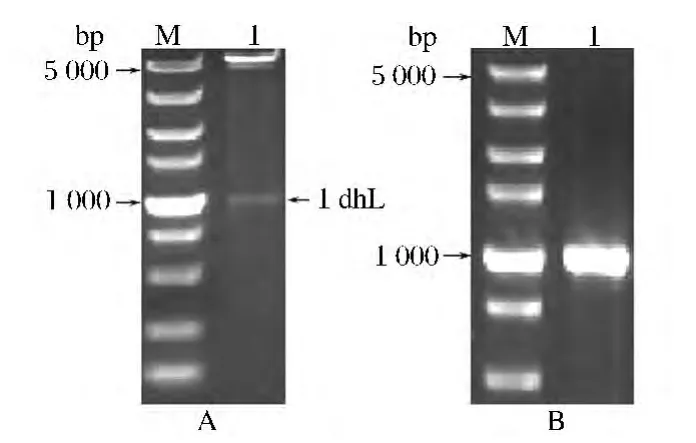
图3 重组表达质粒pET-28a-ldhL的酶切鉴定(A);菌落PCR鉴定(B)电泳图Fig.3 Restrication analysis of recombinant cloning plasmid pET-28a-ldhL(A);Electrophoresis of clone PCR verification(B)
2.2 ldhL基因的诱导表达及酶活测定
对经IPTG诱导后重组大肠杆菌E.coli BL21(DE3)/pET-28a-ldhL、E.coli BL21(DE3)/pET-28a 和原始菌株E.coli BL21(DE3)进行SDS-PAGE电泳分析,结果如图4所示。与对照菌株相比,E.coli BL21(DE3)/pET-28a-ldhL在约40 ku处有明显条带,除去质粒上融合表达的融合标签,与预测目标蛋白大小一致,表明巨大芽孢杆菌ldhL在大肠杆菌中成功表达。

图4 SDS-PAGE分析重组大肠杆菌L-乳酸脱氢酶蛋白表达Fig.4 SDS-PAGE analysis of recombinant L-lactate dehydrogenase expression in E.coli
对E.coli BL21(DE3)/pET-28a-ldhL粗酶液酶活和蛋白表达量进行测定,未检测出对照菌株E.coli BL21(DE3)/pET-28a和 E.coli BL21(DE3)对 PPA的酶活,重组菌株E.coli BL21(DE3)/pET-28a-ldhL对PPA的比酶活为3.4 U/mg,说明重组ldhL在大肠杆菌中成功表达且对PPA显示出催化活力。
2.3 重组菌全细胞转化PPA合成L-PLA
全细胞转化试验表明E.coli BL21(DE3)/pET-28aldhL对PPA具有较强的转化能力。在37℃、200 r/min条件下转化60 min,70.32 mmol/L PPA经25 g/L(干重)重组大肠杆菌将全细胞转化还原为50.59 mmol/L LPLA,底物摩尔转化率为71.94%。HPLC检测结果见图5:此转化体系不对称还原PPA合成的L-PLA具有较高的光学纯度(96.98%e.e.),以上结果表明此一步生物转化体系能高效地不对称合成L-PLA。
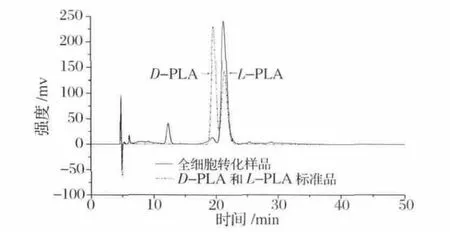
图5 HPLC分析重组菌全细胞转化合成L-PLAFig.5 HPLC analysis of L-PLA production by whole cells of recombinant E.coli
3 结论
Rubrivivax benzoatilyticus JA2[28]可将 1 mmol/L L-苯丙氨酸转化为 0.92 mmol/L L-PLA。1996年,Hashimoto[29]等从土壤中筛选1株假单胞菌(Pseudomonas sp.),能将2-羟基3-苯基丙腈(3-phenyllactonitrile)转化为e.e.值为75%的L-PLA。本研究通过构建过表达L-乳酸脱氢酶的重组大肠杆菌E.coli BL21(DE3)/pET-28a-ldhL,采用全细胞一步生物转化法,将PPA高效不对称还原成高光学纯度L-PLA,为进一步提高微生物合成L-PLA的产率、光学纯度和底物转化率提供依据。
[1] Dieuleveux V,Vanderpyl D,Chataud J,et al.Purification and characterization of anti-Listeria compounds produced by Geotrichum candidum[J].Applied and Environmental Microbiology,1998,64(2):800-803.
[2] Tuberoso C I G,Bifulco E,Caboni P,et al.Lumichrome and phenyllactic acid as chemical markers of thistle(Galactites tomentosa moench)honey[J].Journal of Agricultural and Food Chemistry,2010,59(1):364-369.
[3] LI X,JIANG B,PAN B.Biotransformation of phenylpyruvic acid to phenyllactic acid by growing and resting cells of a Lactobacillus sp.[J].Biotechnology Letters,2007,29(4):593-597.
[4] WANG J,YOO J,LEE J,et al.Effects of phenyllactic acid on production performance,egg quality parameters,and blood characteristics in laying hens[J].The Journal of Applied Poultry Research,2009,18(2):203-209.
[5] 贾江花.乳酸脱氢酶的克隆表达及酶学性质的研究[D].无锡:江南大学,2009.
[6] WANG J,LEE J,YOO J,et al.Effects of phenyllactic acid on growth performance,intestinal microbiota,relative organ weight,blood characteristics,and meat quality of broiler chicks[J].Poultry Science,2010,89(7):1 549-1 555.
[7] Dieuleveux V,Gueguen M.Antimicrobial effects of D-3-phenyllactic acid on Listeria monocytogenes in TSB-YE medium,milk,and cheese[J].Journal of Food Protection,1998,61(10):1 281-1 285.
[8] Valerio F,Lavermicocca P,Pascale M,et al.Production of phenyllactic acid by lactic acid bacteria:an approach to the selection of strains contributing to food quality and preservation[J].FEMS Microbiology Letters,2004,233(2):289-295.
[9] Lavermicocca P,Valerio F,Visconti A.Antifungal activity of phenyllactic acid against molds isolated from bakery products[J].Applied and Environmental Microbiology,2003,69(1):634-640.
[10] Allen K L,Molan P C,Reid G M.A survey of the antibacterial activity of some New Zealand honeys[J].Journal of Pharmacy and Pharmacology,1991,43(12):817-822.
[11] Wilkins A L,Lu Y,Molan P C.Extractable organic substances from New Zealand unifloral manuka(Leptospermum scoparium)honeys[J].Journal of Apicultural Research,1993,32(1):3-9.
[12] 李兴峰,江波,潘蓓蕾.新型生物防腐剂——苯乳酸在食品中的研究与应用[J].食品与发酵工业,2007,33(5):87-91.
[13] 李远颂.生物合成R-3-苯基乳酸的研究[D].儋州:华南热带农业大学,2006.
[14] Naz S,Gueguen-Minerbe M,Cretenet M,et al.Aromatic amino acids as precursors of antimicrobial metabolites in Geotrichum candidum[J].FEMS Microbiology Letters,2013,344(1):39-47.
[15] Ström K,Sjögren J,Broberg A,et al.Lactobacillus plantarum MiLAB 393 produces the antifungal cyclic dipeptides cyclo(L-Phe-L-Pro)and cyclo(L-Phe-trans-4-OH-L-Pro)and 3-phenyllactic acid[J].Applied and Environmental Microbiology,2002,68(9):4 322-4 327.
[16] WANG H K,YAN Y H,WANG J M,et al.Production and characterization of antifungal compounds produced by Lactobacillus plantarum IMAU10014[J].PloS One,2012,7(1):e29452.
[17] Sun X Z,Minowa T,Yamaguchi K,et al.Evaluation of energy consumption and greenhouse gas emissions from poly(phenyllactic acid)production using sweet sorghum[J].Journal of Cleaner Production,2014,http://dx.doi.org/10.1016/j.jclepro.2014.09.041.
[18] Rodriguez N,Salgado J M,Cortes S,et al.Antimicrobial activity of D-3-phenyllactic acid produced by fedbatch process against Salmonella enterica[J].Food Control,2012,25(1):274-284.
[19] Dallagnol A,Catalán C,Mercado M,et al.Effect of biosynthetic intermediates and citrate on the phenyllactic and hydroxyphenyllactic acids production by Lactobacillus plantarum CRL778[J].Journal of Applied Microbiology,2011,111(6):1 447-1 455.
[20] MU W,YU S,ZHU L,et al.Production of 3-phenyllactic acid and 4-hydroxyphenyllactic acid by Pediococcus acidilactici DSM 20284 fermentation[J].European Food Research and Technology,2012,235(3):581-585
[21] ZHU Y,HU F,ZHU Y,et al.Enhancement of phenyllactic acid biosynthesis by recognition site replacement of D-lactate dehydrogenase from Lactobacillus pentosus[J].Biotechnology Letters,2015,37(6):1 233-1 241.
[22] ZHENG Z,MA C,GAO C,et al.Efficient conversion of phenylpyruvic acid to phenyllactic acid by using whole cells of Bacillus coagulans SDM[J].PloS One,2011,6(4):e19030.
[23] Li L,Shin S Y,Lee K W,et al.Production of natural antimicrobial compound D-phenyllactic acid using Leuconostoc mesenteroides ATCC 8293 whole cells involving highly active d ‐ lactate dehydrogenase[J].Letters in Applied Microbiology,2014,59(4):404-411.
[24] 胡发根,沈丽,季华兰,等.重组大肠杆菌全细胞合成苯基乳酸的研究[J].食品工业科技,2015,36(9):149-151.
[25] Sambrook J,Ruseel D W.Molecular Cloning[M].3rd ed.New York:Cold Spring Harbor Laboratory Press,2001.
[26] 李建武,萧能,余瑞元,等.生物化学实验原理和方法[M].北京:北京大学出版社,1997:351-353.
[27] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1):248-254.
[28] Prasuna M L,Mujahid M,Sasikala C,et al.L-Phenylalanine catabolism and L-phenyllactic acid production by a phototrophic bacterium,Rubrivivax benzoatilyticus JA2[J].Microbiological Research,2012,167(9):526-531.
[29] Hashimoto Y,Kobayashi E,Endo T,et al.Conversion of a cyanhydrin compound into S-(-)-3-phenyllactic acid by enantioselective hydrolytic activity of Pseudomonas sp.BC-18[J].Bioscience,Biotechnology,and Biochemistry,1996,60(8):1 279-1 283.
