鸡软骨中硫酸软骨素的分离纯化*
2015-12-25王鑫徐丽萍宋志鹏
王鑫,徐丽萍,宋志鹏
(哈尔滨商业大学食品工程学院,省高校食品科学与工程重点实验室,黑龙江哈尔滨,150076)
鸡软骨中的硫酸软骨素(简称CS)作为结缔组织天然存在的重要成分,发挥着许多生理功能。比如CS可以和胶原蛋白结合成高分子材料而起到使各器官特定结构固定的作用[1]。虽然CS的主链结构并不复杂,但就硫酸基、硫酸化程度和2种差异向异构糖醛酸链内的分布呈现了高度的不均一性。CS的精细结构决定着其与多种蛋白质分子的相互作用以及功能的特异性[2]。因此,作为动物软骨中特有的糖胺聚糖,CS还具有调节关节机能、防治动脉硬化、抗凝血、清除自由基、增强免疫、抗病毒、调节动物体内水分和抗肿瘤等多种生理功能[3]。从鸡软骨中提取的CS中,除含有酸性黏多糖外,还含有很多水溶性物质,而这些物质的存在则会降低提取物中CS的含量,降低CS的生理活性,因此实验过程中必须将这些杂质除去,以提高CS的纯度[4]。
离子交换树脂是一种具有网状结构且含有离子活性基团而且能与溶液中的其他物质进行交换或吸附的聚合物,利用它与流动相中的离子可以进行可逆的交换这一性质来对离子型化合物进行纯化。由于化合物所带电荷性质和数量的不同,进而与树脂的交换或吸附能力也不同,利用该性质可对鸡软骨中的CS进行分离纯化[5-6]。凝胶层析法又称排阻层析、分子筛过滤等。它的优点是层析所用的凝胶是1种具有三维空间的多孔网状结构,且呈珠状颗粒的惰性载体,每个颗粒的细微结构及筛孔的直径均匀一致,像筛子一样,直径大于孔径的分子将无法进入凝胶内部,便直接沿凝胶颗粒的间隙流出,不带电荷,吸附力弱,操作条件比较温和,可在相当广泛的温度范围下进行,无需有机溶剂,设备简单,操作方便,并且保持所分离成分的生物学活性,对于高分子物质有很好的纯化效果[7]。采用离子交换树脂法对CS粗提物进行纯化工艺的研究,为获得纯度较高的CS,将进一步采用凝胶层析对其进行纯化,以期得到更好的应用。
1 材料与方法
1.1 材料与仪器
硫酸软骨素粗提物,实验室自制;硫酸软骨素标准品,美国Sigma公司;732阳离子交换树脂,杭州争光化工厂;D218阴离子交换树脂,西安蓝晓科技新材料有限公司;201*7型树脂,沈阳市新西试剂厂;葡聚糖凝胶G-75,上海君威生物科技有限公司。
1.2 实验方法
1.2.1 超声波辅助碱-双酶法提取鸡软骨中硫酸软骨素
称取5份3 g原料,分别置于烧杯中,按料液比1∶6(g:mL)加入质量分数为4%的NaOH溶液,将烧杯置于超声波仪器中,在100 W的功率下超声处理100 min,调节pH值为6.8。按13∶10 000(g:mL)的酶质量和溶液体积比加入木瓜蛋白酶(酶活力80万U/g),在45℃恒温水浴中加热1h,然后将烧杯迅速放入90℃水浴箱中并保温20 min进行灭酶,用HCl调节pH值至5.9。按13∶10 000(g:mL)的酶质量和溶液体积比加入胃蛋白酶(酶活力3 000 U/g),分别在48℃恒温水浴加热103 min。迅速升温到90℃保温20 min灭酶。调节pH值至6.8~7.2内,按溶液总体积的3%加入NaCl,搅拌均匀后加入无水乙醇,使乙醇浓度达到70%,静置12h,吸出上清液后收集沉淀进行离心,在用乙醇对沉淀进行1~2次的洗涤,置于55~60℃干燥箱中干燥、粉碎后即得成品,称量,计算 CS 的得率[8]。
1.2.2 离子交换树脂纯化硫酸软骨素
1.2.2.1 D218离子交换树脂的预处理
用去离子水浸泡离子交换树脂数小时后进行过滤,然后用体积分数85%乙醇浸泡3h后用去离子水洗净。采用2倍树脂体积、浓度为70mg/mL的HCl溶液浸泡3h,再用去离子水洗至中性,然后滤干。再采用2倍树脂体积、浓度为80mg/mL的NaOH溶液浸泡3h,用大量去离子水洗至中性,最后用去离子水浸泡备用。
1.2.2.2 D218离子交换树脂纯化硫酸软骨素工艺条件的选择
将D218阴离子交换树脂采用湿法装柱后,分别用 1∶1、1∶2、1∶3、1∶4、1∶5的树脂与 CS 粗提物水溶液体积比进行动态吸附实验,分别吸附30、40、50、60、70 min 后,将 CS 粗提物水溶液以 0.5、1.0、1.5、2.0、2.5mL/min的流速分别经过玻璃树脂柱,采用树脂与NaCl溶液体积比为1∶1、1∶2、1∶3、1∶4、1∶5、1∶6的比例,分别用浓度为 1.5、2.0、2.5、3.0、3.5mol/L 的NaCl溶液对已经饱和的树脂进行洗脱,每隔15 min收集一次洗脱液,共收集8次,分别测定每一次的CS含量,确定最佳解吸时间。测定流出液中CS的含量,并计算其吸附率,选出树脂纯化最佳条件[9]。
1.2.3 凝胶层析法纯化硫酸软骨素
1.2.3.1 葡聚糖凝胶G-75的预处理
取18g葡聚糖凝胶G-75粉末,浸泡于300 mL蒸馏水中使其充分溶胀(室温,24 h),然后经过反复倾斜除去表面的悬浮颗粒,将葡聚糖凝胶G-75浸泡过夜备用。
1.2.3.2 凝葡聚糖凝胶G-75纯化硫酸软骨素步骤
将凝胶装柱、上样和平衡后,采用pH值为4.8的乙酸-乙酸钠溶液进行洗脱,将CS粗纯物水溶液以0.7 mL/min的流速经过凝胶,采用自动部分收集器对流出液进行收集,共接50支管,每管接约2.5 mL。
1.2.3.3 硫酸软骨素纯化物制备
通过离子交换树脂和凝胶层析法最佳工艺条件纯化CS,经干燥浓缩后即得CS纯化物,并计算CS的纯度:
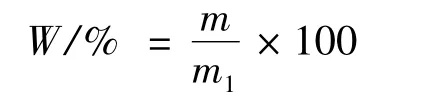
式中:W,CS纯度,%;m,纯化物中CS的质量,g;m1,纯化物的质量,g。
1.2.4 硫酸软骨素HPLC分析
色谱柱:Ultimate XB-NH2柱(25 mm×4.6 mm,5 μm);柱温:30℃;检测波长:232 nm;流动相:醋酸钠缓冲溶液(pH 5.6)-乙腈(体积比95∶5);进样量10 μL;流速:1.0 mL/min。比较CS标准品与样品图谱出峰位置和保留时间。
2 结果与讨论
2.1 超声波辅助碱-双酶法提取鸡软骨中CS
以CS得率为指标,采用超声波辅助碱-双酶法提取鸡软骨中CS,结果见表1。

表1 超声波辅助碱-双酶法提取CSTable 1 Ultrasonic-assisted extraction CS with alkali-double enzymatic
由表1可知,采用超声波辅助碱-双酶法提取CS得率最高,为26.85%。采用双酶法进行2次酶解可以充分水解CS中的蛋白质,而且水解过程中既不会使CS发生水解也不会产生水解黏多糖的酶。同时,还可从提取CS的废液中回收蛋白,既解决了环境污染问题,还可以确保回收的蛋白质的品质和风味。
2.2 离子交换树脂法纯化硫酸软骨素实验结果分析
2.2.1 硫酸软骨素纯化最佳上样量的确定
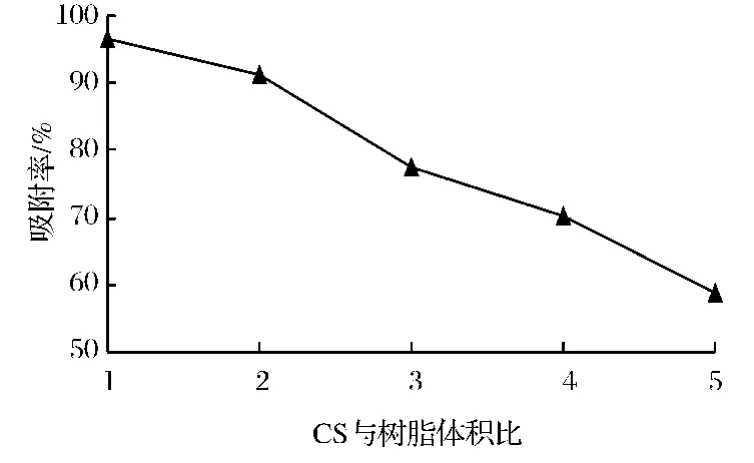
图1 上样量的选择Fig.1 The optimum choice of the sample volume
由图1所示,随着CS粗提液用量和树脂体积比的不断加大,CS的吸附率呈整体下降趋势。在二者体积比为1∶1时,吸附率为最大值,此时树脂可能已经处于饱和状态,如果继续增大上样量,就会造成部分CS成分的损失。而如果上样量过少,就会使纯化时间变长,因此针对吸附效果以及经济因素方面的考虑,确定CS粗提液用量与树脂体积比为1∶1为最佳上样量。
2.2.2 硫酸软骨素纯化最佳吸附时间的确定
如图2所示,吸附时间在30~70 min时曲线呈上升趋势,吸附率在60 min吸附时间处取得最大值,当吸附时间超过60 min后吸附率反开始下降。这可能是由于吸附是以物理过程为主伴随这化学吸附,如果时间过长,就会破坏树脂达到的平衡,故确定60 min为最佳吸附时间。
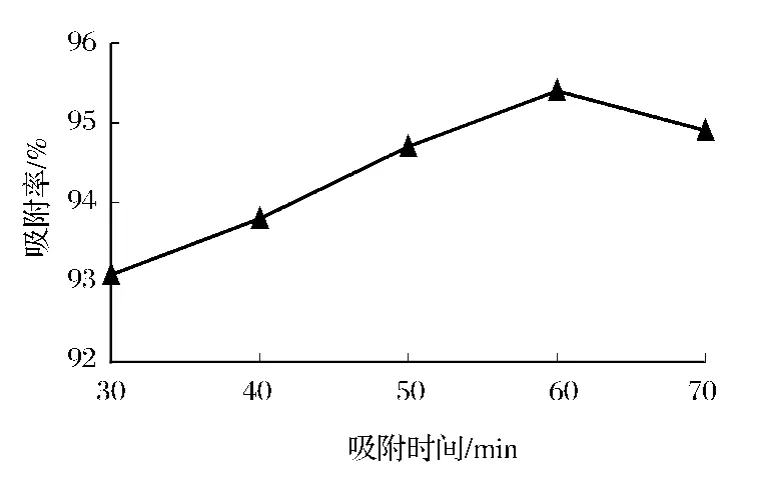
图2 最佳吸附时间的选择Fig.2 The optimum choice of the adsorption time
2.2.3 硫酸软骨素纯化流速的确定
如图3所示,CS吸附率取得最大值是在吸附流速为0.5 mL/min时,而当吸附流速超过1.0 mL/min时,吸附率呈逐渐下降的趋势。其原因是较快的流速不利于吸附的进行,但流速过慢又会使纯化时间延长,增加生产成本。而CS的吸附率在0.5和1.0 mL/min的流速中差异不大,所以从经济成本的角度考虑吸附流速应以1.0mL/min为宜。
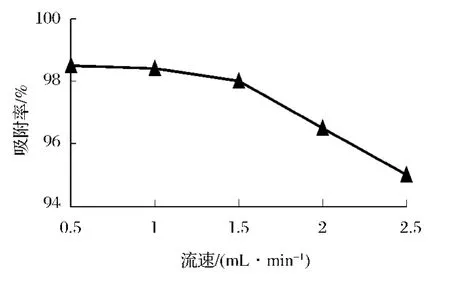
图3 流速的选择Fig.3 The optimum choice of the flow rate
2.2.4 硫酸软骨素纯化洗脱剂NaCl浓度的确定
如图4所示,当NaCl溶液浓度为1.5~3.5 mol/L时,洗脱液中CS含量呈上升趋势,当NaCl溶液浓度3.0 mol/L时CS的解吸率最大,当NaCl溶液浓度继续增大时呈下降趋势,这是由于随着NaCI浓度的不断增大,其它某些杂质也会随CS一起沉淀出来,从而使CS的纯度降低。因此确定CS纯化最佳洗脱浓度为3.0 mol/L。
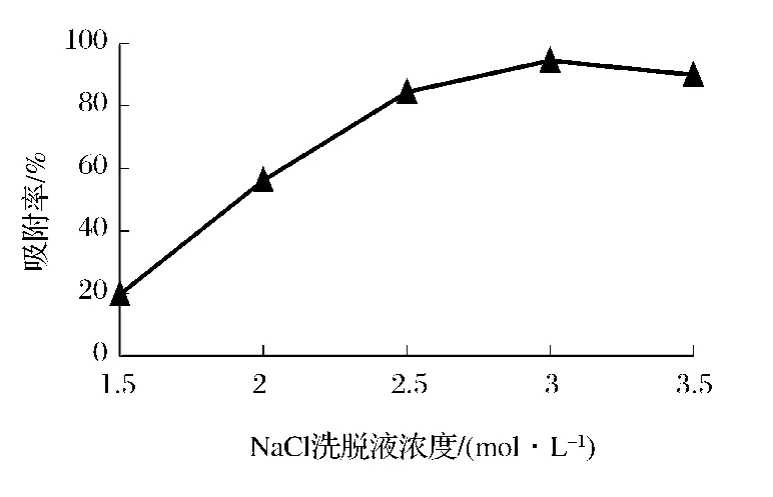
图4 洗脱液浓度的选择Fig.4 The optimum choice of the concentration of the eluant
2.2.5 硫酸软骨素纯化洗脱剂NaCl用量的确定
如图5所示,当洗脱剂NaCl溶液用量与树脂体积比在1∶1~5∶1时,解吸率呈逐渐上升的趋势。当洗脱剂NaCl溶液的用量与树脂体积比为5∶1时,CS的解析率达到最大值;但是继续加大洗脱液用量时解吸率反而降低,可能是因为随洗脱液体积增大溶液中的CS的质量浓度减小,从而影响了CS溶液的洗脱效果,因此应确定5∶1为CS纯化洗脱剂NaCl溶液用量与树脂用量的最佳体积比。
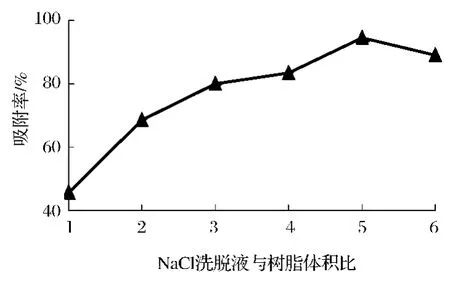
图5 NaCl用量的选择Fig.5 The optimum choice of the NaCl amount
2.2.6 硫酸软骨素纯化解吸时间的确定
如图6所示,CS的解吸率随解吸时间的延长而增大。在解析时间为75 min时,CS的解吸达到最大值,继续增加解吸时间,曲线则呈下降趋势且趋于稳定,这说明时树脂中的CS在解吸75 min时已基本解吸完全,故确定75 min为最佳解吸时间。
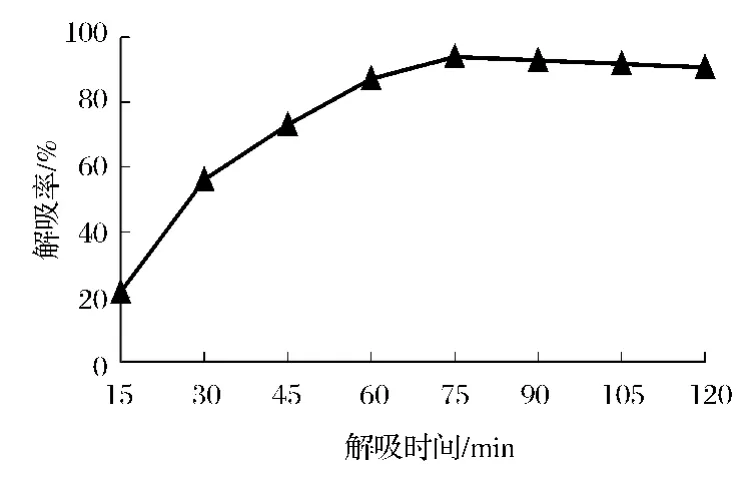
图6 最佳解吸时间的选择Fig.6 The optimum choice of the desorption time
2.3 葡聚糖凝胶G-75洗脱硫酸软骨素结果与分析
从图7中可以看出,采用流速为0.7 mL/min的的乙酸-乙酸钠溶液(pH=4.8)洗脱时,随着管数的推进,吸光值逐渐增加,在第30管出现最大吸光值为0.785,之后随着管数的推进,吸光值逐渐减小,在第42管出现零值,之后全部为零趋于稳定。由此可见,第30管CS含量最高,第42管之后几乎不含有CS。
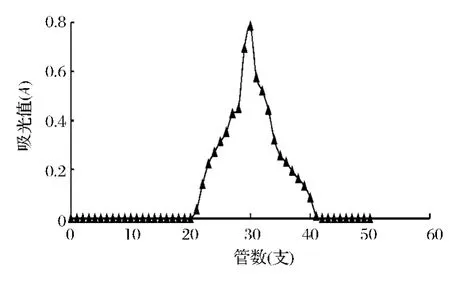
图7 CS洗脱结果Fig.7 The elution result of CS
2.4 离子交换树脂法制备硫酸软骨素纯化物
采用离子交换树脂D218纯化CS的最佳工艺条件为:CS粗提物溶液体积与树脂体积比为1∶1,吸附流速为1.0 mL/min,吸附时间为60 min,洗脱剂为3.0 mol/L的NaCl溶液,最佳解析时间为75 min,洗脱剂用量与树脂体积比为5∶1,再采用葡聚糖凝胶G75纯化CS,纯化后CS纯化物的纯度见表2。
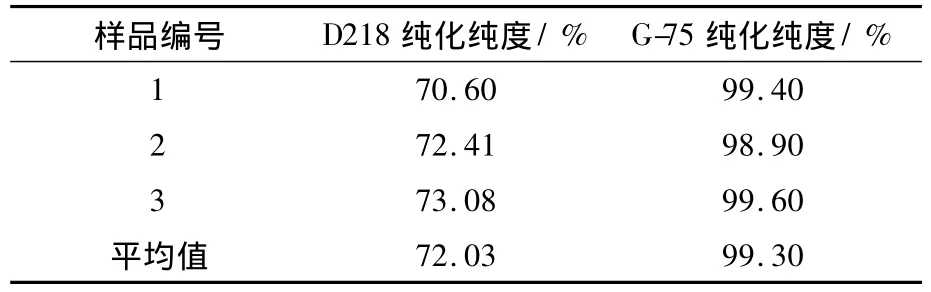
表2 CS纯化物的纯度表Table 2 The purity result of purified product of CS
如表2所示,离子交换树脂法纯化后的CS纯度为72.03%,葡聚糖凝胶G-75纯化后CS纯化物的纯度提高至99.30%。
2.5 HPLC检测结果与分析
由图8、图9可以看出,CS标准品和纯化后的CS样品有相同的出峰位置,峰形较好,保留时间比较短,且均在17.5~18.5 min内,进一步证明了提取于鸡软骨中并经过纯化后得到的物质为CS。
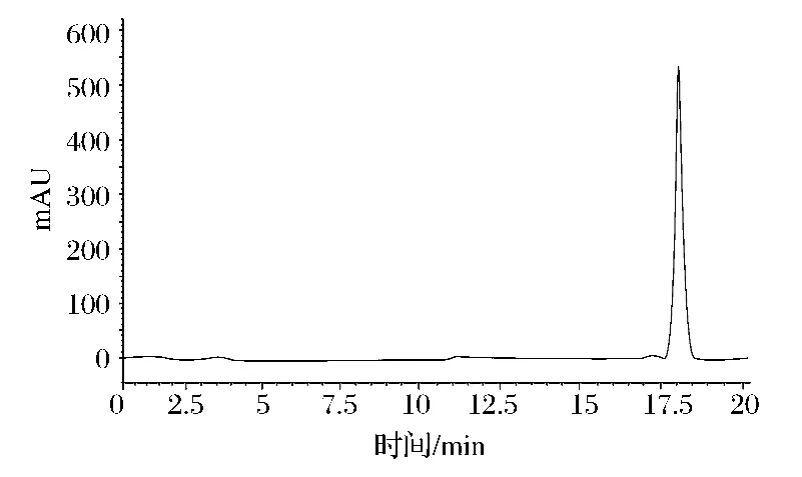
图8 CS标准品HPLC检测图谱Fig.8 HPLC chromatograms of CS standard
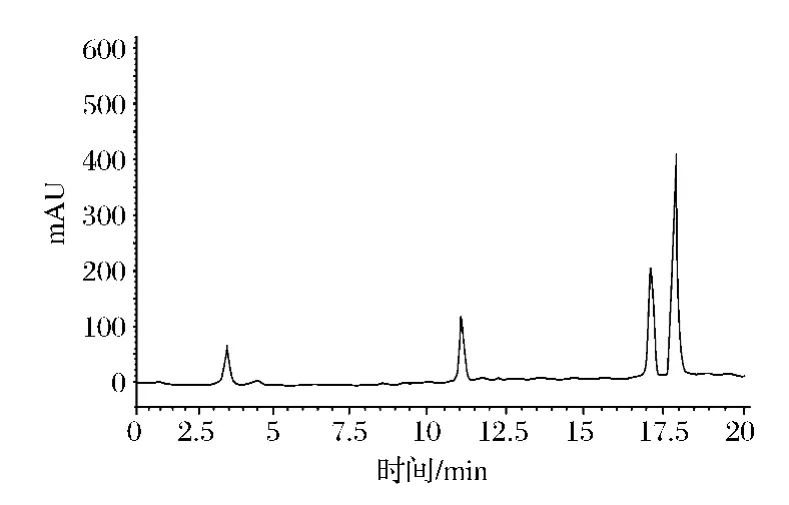
图9 CS纯品HPLC检测图谱Fig.9 HPLC chromatograms of CS sample
3 结论
采用离子交换树脂法及凝胶层析法对超声波辅助碱-双酶法提取的CS进行纯化并对纯化工艺进行了优化,并对纯化后得到的物质进行了定性定量分析。通过静态吸附及解吸实验的筛选,确定CS的最佳纯化树脂为D218型阴离子交换树脂。离子交换树脂法纯化CS的最佳工艺条件为:吸附液用量与树脂体积比为1∶1吸附流速为1.0 mL/min;吸附时间为60 min;洗脱剂NaCl溶液的浓度为3.0 mol/L;洗脱剂NaCl溶液用量与树脂体积比为5∶1;最佳解析时间为75 min。纯化后CS纯度为72.03%。采用凝胶层析法纯化CS,纯化后CS纯度为99.30%。通过高效液相色谱法对纯化后的物质进行检测,结果表明纯化后得到的物质与CS标准品出峰位置以及结构都一致,进一步证明从鸡软骨中提取的物质为CS。
[1] 陈亚.硫酸软骨素生产工艺的优化研究[D].上海:华东理工大学,2010:1-65.
[2] Volpi N.Quality of different chondroitin sulfate preparations in relation to their therapeutic activity [J].J Pharm Pharmacol,2009,61:1 271-1 280.
[3] Takanishi G C,Borst C A.Glucosamine and chondroitin in the treatment of osteoarthritis[J].Women's Health Primary Care,2001,4(1):61.
[4] 吕惠中.硫酸软骨素的分离纯化及其抗凝血作用的研究[D].山东:青岛大学,2003,1-57.
[5] 谢果凰.鲨鱼硫酸软骨素的分离提纯及其抗氧化功能的研究[D].江苏:宁波大学,2010:1-54.
[6] 苏现波,刘安军.羊软骨粘多糖的提取与分离[J].食品工业科技,2004,25(3):98-100.
[7] 罗秉俊,张苏云.凝胶层析分离提纯芦荟多糖的方法[J].芦荟产业,2011,(2):78.
[8] 陈红丽,杨永锋,于建军.胃蛋白酶提取硫酸软骨素的研究[J].应用化工,2009,38(12):1 766-1 768.
[9] 李鑫,姚开,贾冬英,等.硫酸软骨素的提取和纯化分离技术[J].天然产物研究与开发,2004,16(6):597-60.
