薄膜包装对鲜切芹菜抗氧化活性的影响*
2015-12-25郭峰胡花丽吴朝霞李鹏霞
郭峰,胡花丽,吴朝霞,李鹏霞
1(江苏省农业科学院农产品加工所,江苏南京,210014)2(沈阳农业大学食品学院,辽宁沈阳,110866)
芹菜(Apium graveolens),属伞形科植物,是1种耐寒性柱状叶类蔬菜,清香鲜嫩、风味独特,具有降压降脂等功效[1-2]。但采后芹菜的呼吸作用和生理代谢旺盛,极易失水、黄化,致使芹菜衰老加速,货架期缩短,因此采后芹菜的贮藏保鲜技术是生产实践中备受关注的问题[3]。
果蔬的成熟衰老与活性氧代谢及膜脂过氧化作用密切相关。果蔬中活性氧物质主要包括H2O2、·OH和 O-2·等。刚采收果蔬体内的 SOD、POD、CAT等内源抗氧化酶活性较高,能及时清除组织代谢产生的过量活性氧,维持活性氧的稳态,使其不会对果蔬造成伤害[4];然而,随着贮藏时间的延长,果蔬体内的抗氧化能力减弱,导致组织内活性氧的积累,当活性氧的积累超过一定的阀值,即对细胞膜系统造成伤害,从而加速果蔬的衰老[5]。
薄膜包装可通过薄膜的渗透作用与果蔬的呼吸作用在包装袋内形成高浓度CO2和低浓度O2气体微环境,进而影响果蔬的新陈代谢,达到延长果蔬贮藏寿命的目的[6-8]。此外,薄膜包装具有方便、无公害等特点,已在多种果蔬保鲜中被广泛应用[9-12]。不同种类的果蔬对薄膜包装的贮藏适应性差异较大,需针对产品找出相适应的薄膜种类[13]。
本试验以鲜切芹菜为材料,研究了鲜切芹菜在薄膜包装贮藏过程中抗氧化能力及其相关酶活性的变化,旨在探讨不同薄膜包装对芹菜衰老的影响。
1 试验材料与方法
1.1 试验材料与预处理
本试验芹菜材料为清晨采收的南京地产香芹,采收后1 h内运回实验室。切去茎基部和叶柄,保留茎长度20~25 cm,挑选长度一致、成熟度相近、色泽鲜艳、无机械伤、无病害的鲜切芹菜作为试验材料。采用P1-12.75 μm 聚乙烯袋[渗透系数:CO2,553 525.26 mL/(m2·d);O2,440 129.22 mL/(m2·d)]、P2,32.70 μm聚乙烯袋[渗透系数:CO2,31 616.57 mL/(m2·d);O2,4 329.00 mL/(m2·d)]对芹菜进行包装处理,以12.75 μm聚乙烯袋打孔(上下各开一直径2 cm圆孔)包装作对照处理(CK)。每袋装芹菜(800±50)g,置于(7±1)°C进行自发气调贮藏,相对湿度为80%~90%。贮藏期间每5 d取样1次,每处理取样(500±20)g,用于各项指标的测定。
1.2 实验方法
1.2.1 袋内CO2和O2比例的测定
用CYES-Ⅱ氧CO2气体测定仪测定薄膜包装袋内O2和CO2含量。
1.2.2 叶绿素含量测定
切除芹菜根部和顶部6~7 cm,保留的中间部分作为指标测定用样品。参考李合生[14]的方法,采用乙醇浸提法测定叶绿素含量。称取样品5 g,体积分数95%乙醇匀浆定容15 mL,避光浸提,于649、665 nm波长处测定吸光值,计算叶绿素含量。
1.2.3 丙二醛(MDA)含量测定[14]
样品选取方法同1.2.2。取5 g样品,加入质量分数5%三氯乙酸15 mL,研磨匀浆,3 000 r/min下离心10 min,取上清液2 mL,加入2 mL 0.67%硫代巴比妥酸,混合后沸水浴30 min,冷却后离心,取上清液测定在450、532、600 nm波长处的吸光值,计算MDA含量。
1.2.4 抗氧化能力的测定[15-16]
样品选取方法同1.2.2。提取液的制备:称取5 g样品,加入10 mL 95%乙醇匀浆,浸提5 h,10 000 r/min离心20 min,上清液即为提取液。
1.2.4.1 DPPH清除能力的测定
反应液为2.5 mL 1.0×10-4mol/L DPPH溶液,1 mL样品提取液,于波长517 nm处测定吸光值,计算清除能力。
1.2.4.2 羟基自由基(·OH)清除能力测定
在试管中分别加入2 mL磷酸缓冲液(pH 7.4),0.3 mL 5 mmol/L的邻二氮菲溶液,0.2 mL 7.5 mmol/L FeSO4溶液,每加一管后立即混匀。加入0.5 mL提取液,混匀后加入1 mL 0.02%的H2O2最后补充体积至6 mL。于37°C水浴1 h,于510 nm处测定吸光值,计算清除能力。
1.2.4.3 超氧阴离子自由基(O2-·)清除能力测定
取2.5 mL 0.05 mol/L Tris-HCl缓冲溶液(pH 8.2),置于25°C水浴20 min,分别加入0.5 mL提取液和0.5 mL 25 mmol/L的邻苯三酚溶液,混匀后于25°C水浴5 min,8 mol/L HCl溶液0.5 mL用于终止反应,于425 nm处测定吸光值,计算清除能力。
1.2.5 酶活性的测定[17]
1.2.5.1 过氧化物酶(POD)活性的测定
采用愈创木酚法,样品选取方法同1.2.2。取5 g样品,加入10 mL 50 mmol/L磷酸缓冲液(pH 7.0,内含1%PVP),冰浴下研磨,4°C下10 000 r/min下离心20 min,上清液即为POD粗提液。取1 mL粗酶提取液,加入2 mL 0.05 mol/L愈创木酚(用0.2 mol/L pH 6.4的磷酸缓冲液配成)中,在30°C水浴中平衡5 min,然后加入1 mL 0.2%H2O2(用0.2 mol/L pH 6.4的磷酸缓冲液配成)混匀,以每分钟OD470变化0.01为表示1个过氧化物酶活性单位计算POD活性。
1.2.5.2 过氧化氢酶(CAT)活性的测定
样品选取方法同1.2.2。取5 g样品,加入10 mL 50 mmol/L磷酸缓冲液(pH 7.0,内含1%PVP),冰浴下研磨,4°C下10 000 r/min下离心20 min,上清液即为CAT粗提液。取1 mL粗酶液,加入2 mL 0.05 mol/L磷酸缓冲液(pH 7.8),在25°C水浴下预热5 min,加入1 mL 0.2%H2O2,以每分钟 OD240减少0.1个单位为一个酶活性单位计算CAT活性。
1.2.5.3 超氧化物歧化酶(SOD)活性的测定
采用氮蓝四唑(NBT)法,样品选取方法同1.2.2。取5 g样品,加入15 mL 50 mmol/L磷酸缓冲液(pH 7.8,内含1%PVP)冰浴下研磨,于4°C下10 000 r/min离心20 min,上清液即为SOD粗提液。取1 mL上清液,加入1.5 mL 50 mmol/L磷酸缓冲液、0.3 mL 130 mmol/L Met溶液、0.3 mL 750 μmol/L NBT 溶液、0.3 mL 100 μmol/L EDTA-Na2液、0.3 mL 20 μmol/L核黄素,置于4 000 lux日光灯下反应20 min,于560 nm波长下测定吸光度,计算SOD活性。
1.3 数据处理
数据采用Origin 8.5进行作图,显著性采用SPSS 20.0软件ANOVA进行邓肯式多重差异分析(P<0.05)。
2 结果与分析
2.1 薄膜包装袋内CO2和O2的比例
由表1可知,P2包装袋内CO2浓度高于P1,O2浓度低于P1,分别维持在1.10% ~1.97%和12.53%~17.63%之间,这与P2薄膜包装更低的气体渗透性[CO2渗透系数:31 616.57 mL/(m2·d);O2渗透系数:4 329 mL/(m2·d)]有直接联系。可见,P2薄膜包装极大地限制了包装袋内气体与空气间的渗透。
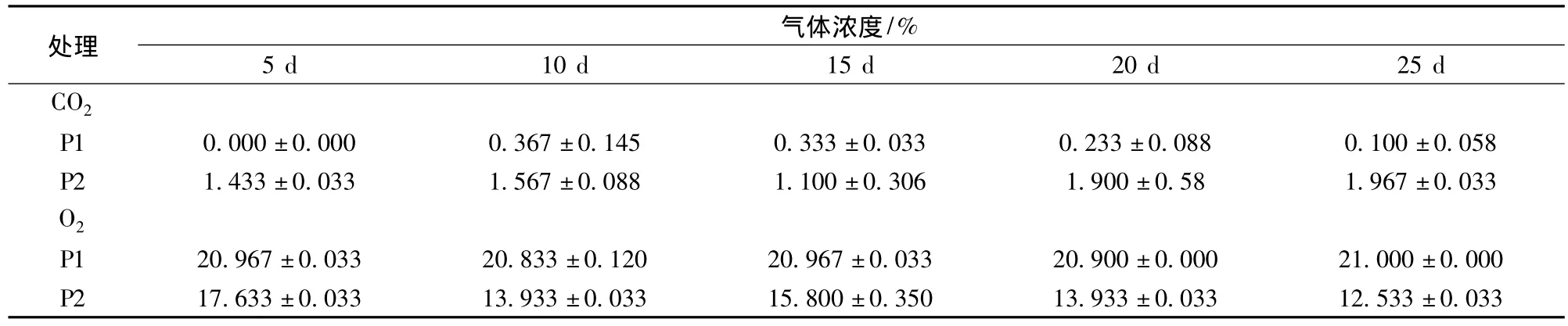
表1 薄膜包装袋内CO2和O2的比例Table 1 CO2and O2content in bags during film packaging storage
2.2 不同薄膜包装对鲜切芹菜叶绿素含量的影响
芹菜采后呼吸旺盛,极易黄化[1],由此影响保鲜和销售。表2表明,在贮藏过程中,芹菜叶绿素含量整体呈下降趋势。在贮藏第5、10、25天时,P2处理的芹菜叶绿素a、b和总叶绿素含量均显著高于P1和CK(P<0.05),总叶绿素含量分别为 CK的1.19、1.26、2.34倍,表明P2薄膜包装可有效延缓芹菜叶绿素分解,显著提高芹菜贮藏品质及寿命。
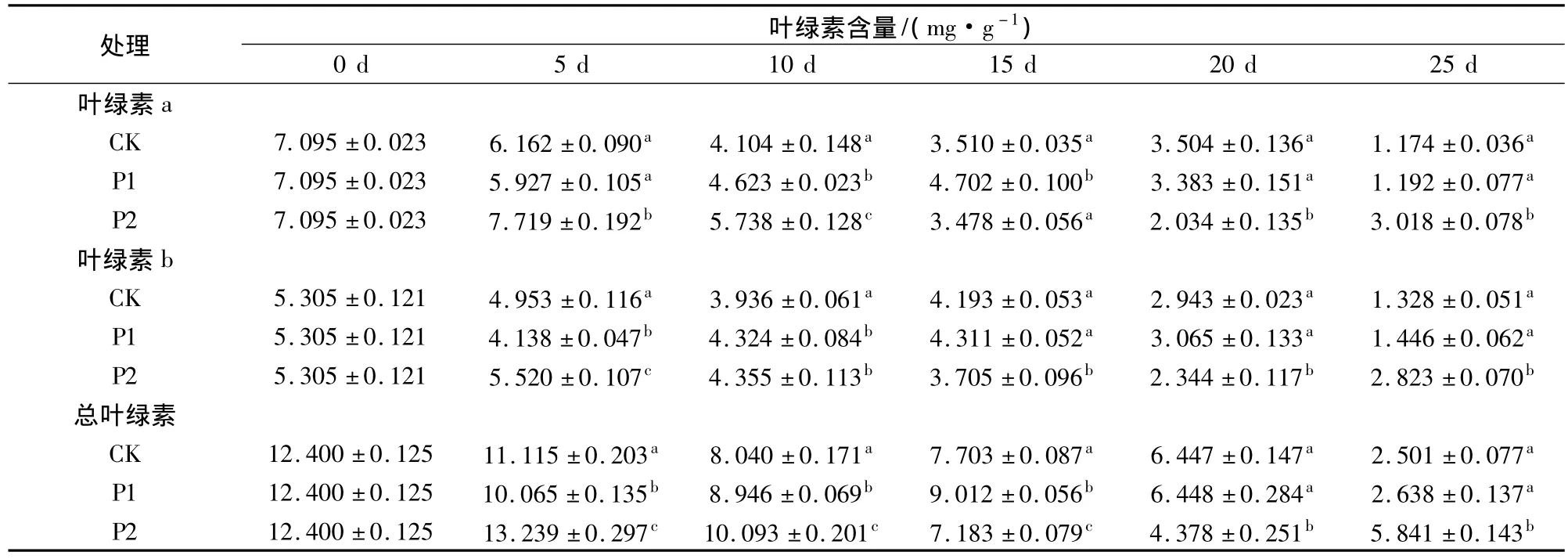
表2 鲜切芹菜在薄膜包装贮藏过程中叶绿素含量的变化Table 2 chlorophyll content of fresh-cut celery during film packaging storage
2.3 不同薄膜包装对鲜切芹菜丙二醛(MDA)含量的影响
MDA含量是反映膜脂过氧化程度的一个重要指标。由图1可看出,在鲜切芹菜贮藏过程中,MDA含量整体呈上升趋势,其中P1和P2处理芹菜的MDA含量均低于CK。在整个贮藏过程中,P2处理芹菜的MDA含量显著低于P1和CK(P<0.05),且在第10天达到最小值,为0.34 μmol/g。可见,在鲜切芹菜贮藏过程中,薄膜包装可有效抑制丙二醛含量的增加,其中P2薄膜包装处理的效果更好。
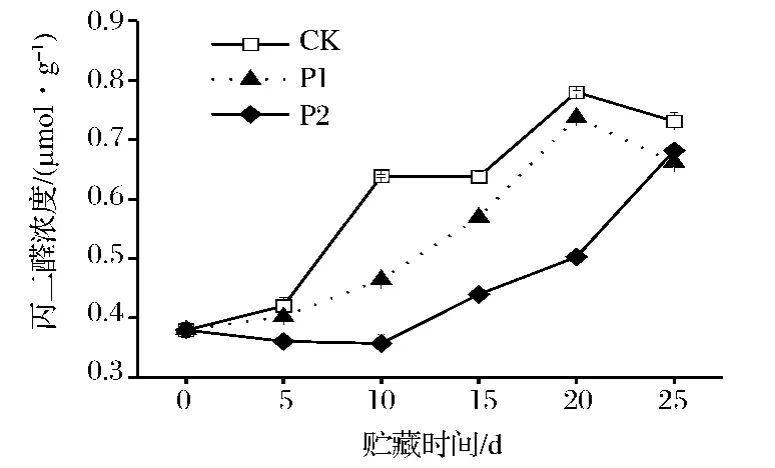
图1 鲜切芹菜在薄膜包装贮藏过程中丙二醛(MDA)含量的变化Fig.1 MDA content of fresh-cut celery during film packaging storage
2.4 不同薄膜包装对鲜切芹菜自由基清除能力的影响
图2-A表明,在鲜切芹菜在贮藏过程中,DPPH清除能力先上升后下降。CK、P1、P2处理芹菜的DPPH清除能力均在贮藏第20天时达到峰值。在贮藏第5、10、15、20、25 天时,P2 处理芹菜的 DPPH 清除能力分别是 CK 的 1.19、1.27、1.21、1.20、1.46 倍,且该处理芹菜对DPPH清除能力显著高于CK(P<0.05)。然而,整个贮藏过程中,P1处理与CK相比无显著性差异。
由图2-B可知,整个贮藏过程中,P1、P2处理芹菜的羟基自由基清除能力均高于CK;在贮藏第5、10、15、25天时,P1处理芹菜的·OH清除能力与P2无显著性差异,而在第20天时,P2处理芹菜的·OH清除能力比P1处理高9.51%。可见,P2薄膜包装处理芹菜可维持较高的·OH清除能力。
由图2-C可知,贮藏期间,鲜切芹菜超氧阴离子自由基清除能力上升后迅速下降。CK芹菜中O2-·清除率峰值出现在第10天,为11.57%;P1、P2处理O2-·清除率的峰值则均出现在第15天,分别为15.62%、18.65%。总体来看,贮藏10 d后,P1、P2处理芹菜中的O2-·清除能力显著高于CK(P<0.05)。
2.5 不同薄膜包装对鲜切芹菜内源抗氧化酶活性的影响
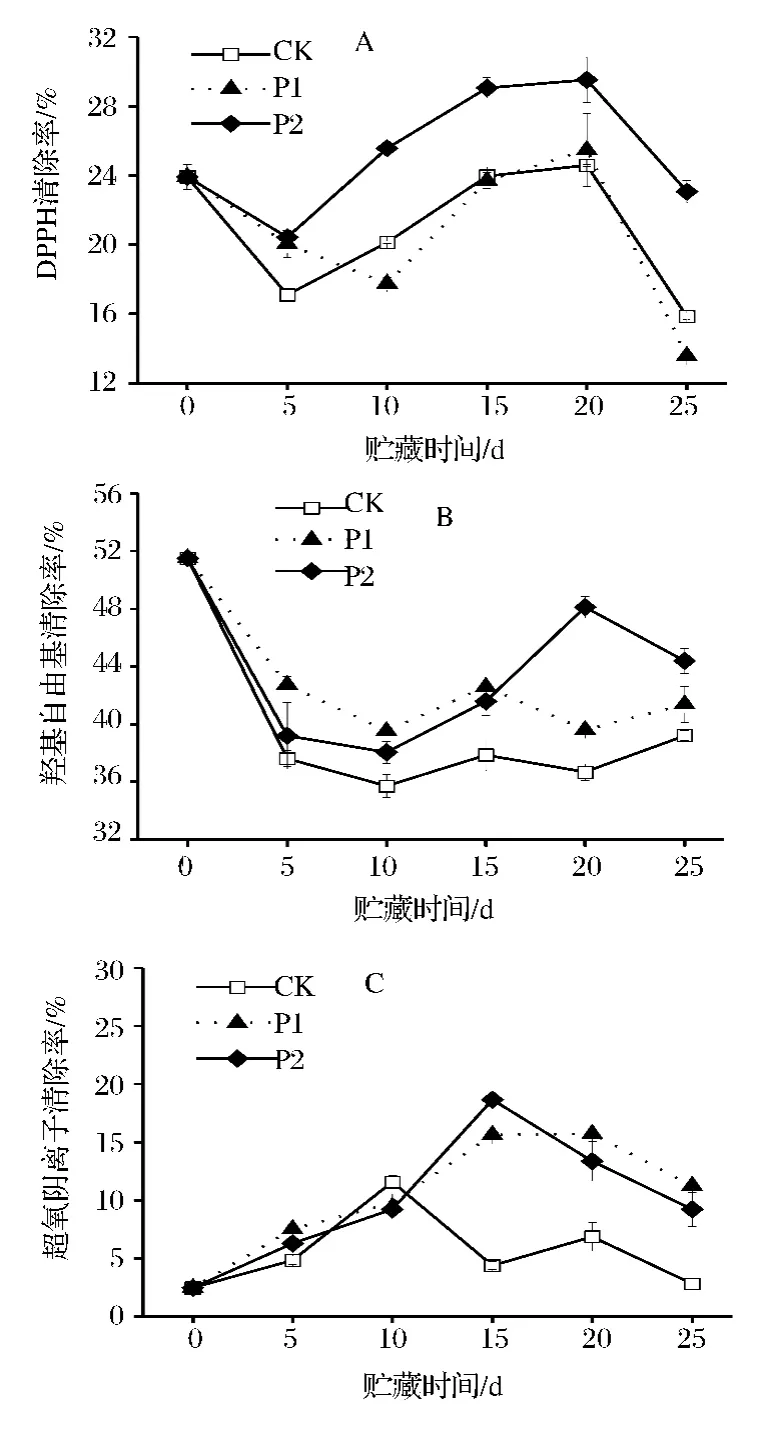
图2 鲜切芹菜在薄膜包装贮藏过程中自由基清除能力的变化Fig.2 Radical scavenging activity of fresh-cut celery during film packaging storage
2.5.1 不同薄膜包装对鲜切芹菜超氧化物歧化酶(SOD)活性的影响
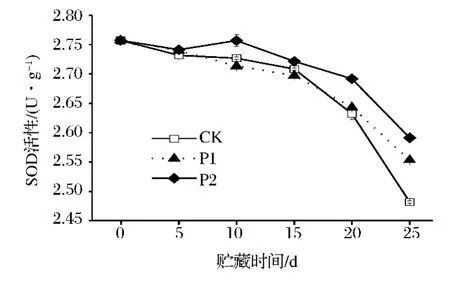
图3 鲜切芹菜在薄膜包装贮藏过程中SOD活性的变化Fig.3 SOD activity of fresh-cut celery during film packaging storage
由图3可看出,鲜切芹菜在贮藏期间,其SOD活性整体呈现下降趋势,且在贮藏15 d后SOD活性下降速率明显加快。除第5天外的整个贮藏过程中,P2处理芹菜的SOD活性显著高于CK(P<0.05)。整个贮藏过程P1处理芹菜的SOD活性与CK无显著性差异。可知,P2薄膜包装可有效延缓鲜切芹菜SOD活性的降低。
2.5.2 不同薄膜包装对鲜切芹菜过氧化物酶(POD)活性的影响
图4表明,鲜切芹菜在贮藏期间,POD活性在前期缓慢上升,之后呈波动上升的趋势。在贮藏0~10 d时,P1、P2处理芹菜的POD活性均高于CK;贮藏10 d之后,CK、P1处理芹菜的POD活性开始波动上升,且CK高于P1(P<0.05)。P2处理芹菜的POD活性在贮藏15 d后出现波动。可知,P2处理薄膜包装可有效延缓鲜切芹菜过氧化物酶(POD)活性峰值的出现。
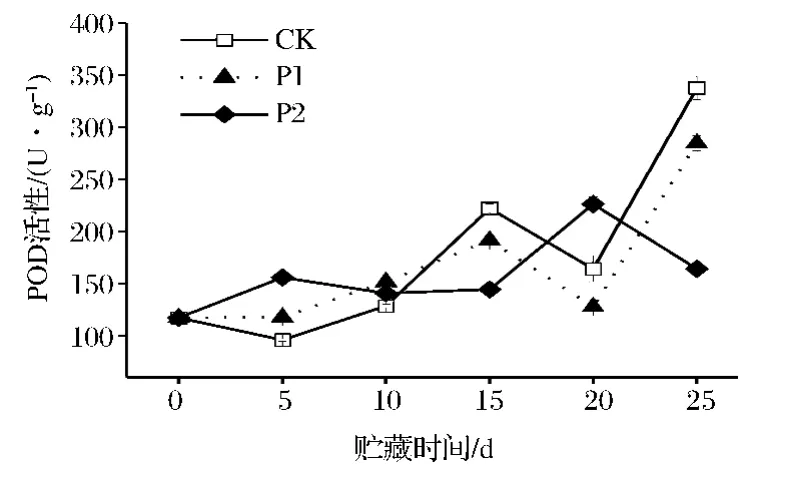
图4 鲜切芹菜在薄膜包装贮藏过程中POD的变化Fig.4 POD activity of fresh-cut celery during film packaging storage
2.5.3 不同薄膜包装对鲜切芹菜过氧化氢酶(CAT)活性的影响
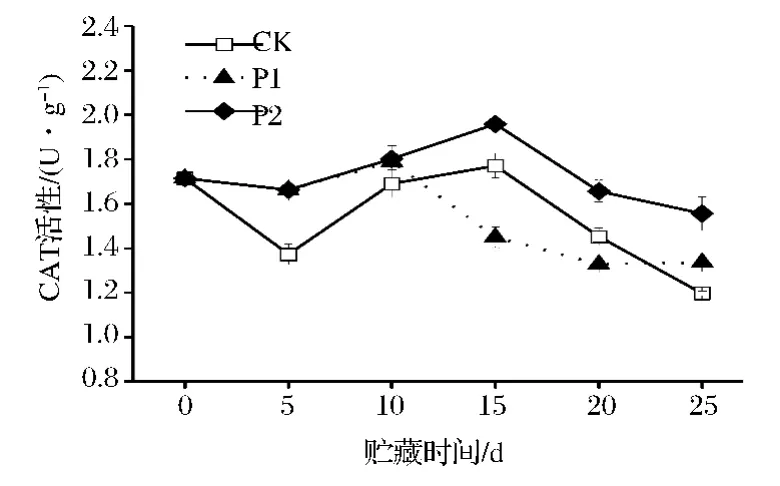
图5 鲜切芹菜在薄膜包装贮藏过程中CAT的变化Fig.5 CAT activity of fresh-cut celery during film packaging storage
由图5可看出,鲜切芹菜在整个贮藏过程中,其CAT活性先上升后下降。CK、P2处理的CAT活性均在第15天出现极大值,分别为1.771 U/g和1.959 U/g;在第15、20天时,P1处理的CAT活性低于CK处理。整个贮藏过程中,P2处理的CAT活性显著高于CK(P<0.05)。可知,P2处理可有效维持鲜切芹菜较高的CAT活性。
3 讨论与结论
生物细胞膜脂过氧化的一个主要机制是活性氧自由基诱发膜脂不饱和脂肪酸发生连锁的过氧化反应,使脂肪酸发生降解,产生脂质过氧化物[18]。SOD能催化O2-·的歧化反应[19],保护膜结构,延缓组织衰老。SOD活性下降与MDA含量增加,意味着组织清除活性氧能力的下降和膜脂过氧化作用的加强。本研究表明,CK处理鲜切芹菜贮藏10 d后SOD活性下降速率加快,O2-·清除率下降,MDA含量迅速升高;SOD活性与MDA含量显著呈负相关(r=-0.793),这与阮亚楠[20]的研究结果一致。与对照相比,薄膜包装显著降低了鲜切芹菜MDA的积累,延缓了SOD活性和O2-·清除能力的下降,说明薄膜包装对抑制膜脂过氧化损伤具有一定的作用,这可能与其维持包装袋微环境中的低浓度O2(12.53%~17.63%)和高浓度CO2(1.10%~1.97%)有关,这一结果同样被胡花丽在草莓[21]中证实。
CAT催化分解组织中高浓度的 H2O2,从而使H2O2控制在较低水平。POD催化组织中低浓度的H2O2发生氧化,用以清除过氧化物和H2O2。POD伴随果蔬的成熟衰老而不断发生变化,其所表现的保护作用或伤害效应因植物种类和品种不同而异[22]。有学者认为可能植物体中存在2种POD作用机制,一种机制是它在遇逆境或衰老初期即表达,表现为保护效应,能增加果实的耐藏性;另一种则是在逆境后期或衰老后期被启动,表现为伤害效应,因此降低果实的耐藏性[23]。本研究结果表明,芹菜CAT活性先上升后下降,这与 Bartoli[24]和闫瑞香[25]等的研究结果一致。POD活性在贮藏前期缓慢上升,此时POD表现为保护效应,随后出现的峰值标志衰老加速的开始[26-27],POD 活性出现波动和上升,这与聂华堂[28]等的研究结果一致。与对照相比,P2薄膜包装显著提高了CAT活性,延缓POD活性峰值的出现并在贮藏后期抑制POD活性波动上升,表明P2薄膜包装可有效保持鲜切芹菜活性氧自由基代谢的平衡,延缓其衰老进程。
自由基清除能力是判定果蔬抗氧化活性的重要指标,抗氧化物质(酚类、黄酮类、Vc)和抗氧化酶(SOD、CAT、POD)系统共同维持植物体内的自由基平衡。研究结果表明,与对照相比,P2薄膜包装维持鲜切芹菜较高的DPPH、·O2-、·OH的清除能力,说明P2薄膜包装可有效保持鲜切芹菜较高的抗氧化活性,减少自由基对组织的损伤,这也与MDA含量变化的结果一致。
综上所述,鲜切芹菜在贮藏过程中,SOD活性下降,CAT活性先上升后下降,POD活性在贮藏前期缓慢上升,后期出现峰值和波动,表明芹菜衰老加速。结果表明,与对照相比,薄膜包装可提高鲜切芹菜DPPH、O2-·、·OH的清除能力及 CAT、POD的活性。此外,P2薄膜包装更有效延缓了MDA的积累和SOD活性下降,并延迟了POD活性峰值的出现;另外,P2薄膜包装还有效减缓了组织中叶绿素的降解,这与其低渗透性所形成的高比例CO2和低比例O2密切相关。因此,薄膜包装可有效延缓鲜切芹菜的衰老进程,其中P2薄膜包装效果更佳。
[1] 朱军伟,谢晶,章佳君,等.薄膜包装芹菜品质分析及货架寿命研究[J].食品科学,2013,34(4):272-276.
[2] 张立奎,陆兆新,郁志芳.臭氧水处理鲜切生菜贮藏期间的品质变化[J].食品与发酵工业,2004,30(3):128-131.
[3] 侯建设,李中华,江杰,等.芹菜的薄膜包装冷藏研究[J].食品科学,2002,23(6):143-145.
[4] 班兆军,冯建华,徐新明,等.果蔬衰老机理研究简述[J].中国果菜,2011(1):55-56.
[5] 王丽娇,牟其云,李文香,等.微真空条件对西兰花叶绿素降解与内源抗氧化性的影响[J].食品科学,2013,34(20):312-317.
[6] Özogul F,Polat A,Özogul Y.The effects of modified atmosphere packaging and vacuum packaging on chemical,sensory and microbiological changes of sardines[J].Food Chemistry,2004,85(1):49-57.
[7] Guynot M E,Marín S,Sanchis V,et al.An attempt to minimize potassium sorbate concentration in sponge cakes by modified atmosphere packaging combination to prevent fungal spoilage[J].Food Microbiology,2004,21(4):449-457.
[8] 王宝刚,侯玉茹,李文生,等.自动自发气调箱贮藏对甜樱桃品质及抗氧化酶的影响[J].农业机械学报,2013,44(1):137-141.
[9] Jafri M,Jha A,Bunkar D S,et al.Quality retention of oyster mushrooms by a combination of chemical treatments and modified atmosphere packaging[J].Postharvest Biology and Technology,2013,76:112-118.
[10] Sothornvit R,Kiatchanapaibul P.Quality and shelf-life of washed fresh-cut asparagus in modified atmosphere packaging[J].LWT-Food Science and Technology,2009,42(9):1484-1490.
[11] 古荣鑫,胡花丽,曹宏,等.不同薄膜包装对冷藏空心菜采后品质的影响[J].食品与发酵工业,2014,40(3):237-243.
[12] 王亚楠,胡花丽,古荣鑫,等.不同薄膜包装对桑葚采后品质的影响[J].食品科学,2014,0-0.
[13] 李宁,阎瑞香,王步江.不同包装方式对白灵菇低温保鲜效果的影响[J].农业工程学报,2011,27(7):377-382.
[14] 李合生.植物生理生化实验原理和技术[M].高等教育出版社,2000.
[15] DU G,LI M,MA F,et al.Antioxidant capacity and the relationship with polyphenol and Vitamin C in fruits[J].Food Chemistry,2009,113(2):557-562.
[16] Alothman M,Bhat R,Karim A.Antioxidant capacity and phenolic content of selected tropical fruits from Malaysia,extracted with different solvents[J].Food Chemistry,2009,115(3):785-788.
[17] 孙群,胡景江.植物生理学研究技术[M].杨凌:西北农林科技大学出版社,2006.
[18] Bowler C,Montagu M V,INZE D.Superoxide dismutase and stress tolerance[J].Annual review of plant biology,1992,43(1):83-116.
[19] 曹慧,王孝威.水分胁迫下新红星苹果超氧化自由基累积和膜脂过氧化作用[J].果树学报,2001,18(4):196-199.
[20] 阮亚男,何兴元,陈玮,等.CO2浓度倍增对城市银杏叶片膜脂过氧化与抗氧化酶活性的影响[J].生态学报,2007,27(3):1 106-1 121.
[21] 胡花丽,李鹏霞,王毓宁,等.不同气体成分处理对丰香草莓采后品质,SOD及 CAT活性的影响[J].江西农业学报,2010,22(12):26-29.
[22] 魏云潇,叶兴乾.果蔬采后成熟衰老酶与保护酶类系统的研究进展[J].食品工业科技,2009(12):427-431.
[23] 寇晓虹,王文生,吴彩娥.果实成熟衰老与保护酶系统的关系[J].中国果菜,2002(6):24-25.
[24] Bartoli C G,Simontacchi M,Guiamet J J,et al.Antioxidant enzymes and lipid peroxidation during aging of RAM petals[J].Plant Science,1995,104(2):161-168.
[25] 闫瑞香,王仁才,关文强.亚精胺对猕猴桃采后抗氧化酶活性的影响[J].园艺学报,2002,29(2):173-175.
[26] 颉敏华,张继澍,颉建明.苦瓜采后某些生理生化变化与其衰败的关系[J].西北植物学报,2004,24(4):716-719.
[27] Gorin N.Differences inl-malate determined enzymatically ortitrimetrically in golden delicious apples[J].Zeitschrift für Lebensmittel-Untersuchung und Forschung,1976,162(3):259-261.
[28] 聂华堂,钟广炎,陈竹生,等.锦橙,凤梨甜橙贮藏期间果皮过氧化物酶活性的变化[J].中国南方果树,1990,19(3):24-25.
