艾纳香叶中花椒油素的制备*
2015-12-25王远辉宋燕燕
王远辉,宋燕燕
(河南工业大学粮油食品学院,河南郑州,450001)
艾纳香(Blumea balsamifera(L.)DC.)属菊科植物,主要分布于东亚和东南亚地区,是我西南地区传统草药,多用于苗药和瑶药,我国贵州罗甸为其道地产地[1]。《中国药典》记载艾纳香叶与小枝是提取左旋龙脑的天然植物原料[2],但未发现用其制备花椒油素的记载。目前,仅有一项专利记载利用酸碱溶液和溶剂萃取艾粉(艾纳香粗提物)中花椒油素[3]。花椒油素(xanthoxylin),2-羟基-4,6-二甲氧基苯乙酮,分子式C10H12O4,多见于花椒果皮和某些中草药(如乌桕根皮)中[4~5]。现代医学研究证实花椒油素可抑制药物引起的肌肉收缩和血小板凝聚,可引起小鼠心肌的自发搏动,其衍生物具有多种活性(驱虫、杀菌、防霉)[6~9]。花椒油素是间苯三酚衍生物,已有资料显示多种间苯三酚衍生物具有生理活性,备受研究人员关注[10]。
花椒油素主要有2个来源,一个是以间苯三酚为原料,经过酰化成酯反应和甲基化反应制备[11];另一个是从天然植物中提取,常通过溶剂提取和色谱分离收集,多应用于分析,极少用于高纯产品制备,测定时常用反相液相色谱法[12~13]。目前,花椒油素多存在于花椒的油树脂和精油中[4],但蒸馏法尚未被用于制备高纯花椒油素。艾纳香叶因其左旋龙脑含量高受到关注,而提取左旋龙脑后的原料叶常被作为废渣处理,其含有花椒油素的事实常被忽略,近些年才被注意。黄永林等团队从艾纳香中分离出花椒油素,并测定不同部位的含量[12,14]。谭道鹏等将艾纳香粗提物艾粉溶于碱液,过滤后调酸性再萃取,最后重结晶获得高纯花椒油素[3]。在前期研究中设计冷凝回流式蒸馏法提取艾纳香叶中左旋龙脑,粗提物中左旋龙脑含量超过80%,花椒油素含量极少,基本都保留于艾纳香残叶中[15],为使艾纳香叶中花椒油素得到充分利用,需设计新的工艺方案制取高纯花椒油素。本实验同时蒸馏萃取法、色谱柱层析、重结晶纯化组成整体工艺制备花椒油素,并通过气相色谱(GC)进行定量测定,通过核磁共振(NMR)进行定性验证。
1 材料与方法
1.1 材料与仪器
艾纳香叶于2012年12月采样于贵州罗甸,由贵州农科院何元农研究员鉴定为菊科植物艾纳香Blumea balsamifera(L.)CD.的叶。经提取左旋龙脑后剩余的艾纳香残叶,水分含量为79.5%。
AR224CN电子天平,奥豪斯(上海)仪器有限公司;GC-2010气相色谱仪(配备氢火焰离子化检测器(FID)),日本岛津;AVANCE III 400MHz核磁共振谱仪,瑞士Bruker公司。G254硅胶板和柱层析硅胶(100~200目),青岛海洋;标准品花椒油素(97%)和氘代三氯甲烷(99.8%),上海 Sigma-Aldrich;萘(99.5%)和其他试剂(均为分析纯),国药集团化学试剂有限公司。
1.2 实验方法
1.2.1 花椒油素的测定
GC配备FID检测器,色谱柱为CP-WAX毛细管柱(30 m × 0.32 mm × 0.5 μm,PEG-20M);升温程序:80℃保持5 min,以10℃/min升温,至220℃保持5 min;进样口温度250℃;分流比1∶5;检测器温度250℃;氮气(99.99%)体积流量3 mL/min,氢气体积流量47 mL/min,空气体积流量400 mL/min;进样量1 μL。溶解标准品花椒油素和内标萘于乙酸乙酯分别配制对照品母液,浓度0.20 mg/mL。标准品花椒油素、内标萘和样品均溶解于乙酸乙酯进行GC分析。经方法学验证,GC测定花椒油素的线性范围0.5 ~1 800 μg/mL,工作曲线 Y=0.893 4X-0.009 1,r为0.999 1(Y:花椒油素相对于内标的峰面积比,X:花椒油素相对于内标的浓度比),回收率为98.63%,精密度RSD为0.22%,满足测定对精密度和准确度的要求。
1.2.2 同时蒸馏萃取(SDE)
精密称取适量艾纳香叶,加入1 L蒸馏水于2 L烧瓶中加热至沸腾,接改进型Likens-Nickerson同时蒸馏萃取装置,装置另一侧连接500 mL烧瓶,添加适量无水乙醚,50℃水浴加热,从艾纳香叶提取花椒油素。完成提取后,通过减压蒸发收回无水乙醚并收集粗提物。平行进行10次积累粗提物。利用GC测定粗提物中花椒油素含量,以此确定最佳料水比、溶剂体积和提取时间。不同水平间差异通过方差分析(ANOVA)评价,P<0.05。计算得率时按照扣去水分的艾纳香叶干物质计算。得率和回收率按下式计算:
得率/%=得到物质质量 /艾纳香叶质量(干基)
回收率/%=此阶段收得花椒油素质量 /基料中花椒油素质量
1.2.3 硅胶柱层析
精密称取粗提物,溶解于洗脱液中上样,利用洗脱液从硅胶柱中洗脱分离目标化合物。洗脱液按不同体积比配置[乙酸乙酯∶石油醚(60~90℃)]。使用柱层析用硅胶(50 g)装柱(长400 mm,直径23 mm),精密称量粗提物,溶于5 mL洗脱液上载样品,以洗脱液作为流动相,以20 mL为一个单元收集流分。每单元用薄层层析点样跟踪分析,根据组分收集流份。通过减压回收溶剂,收集洗脱出化合物并称重,通过GC测定花椒油素含量,计算回收率。对层析柱的洗脱液配比(乙酸乙酯∶石油醚)、径高比、样品与硅胶质量比(上样量)和洗脱液流速进行优化。
1.2.4 重结晶
将加热至微沸的石油醚(60~90℃)滴加至盛放花椒油素粗品的容器中,至固体完全溶解,再多加20%的溶剂。迅速过滤,于室温下静置冷却2 h,再置于4℃环境中存放2 h,最后置于–20℃环境中静置12 h。经过抽滤使母液和晶体分离,收集晶体;通过旋蒸除去母液中溶剂收集残留物。再以残留物作为基料经过上述重结晶步骤再次收集晶体,最大限度收集花椒油素。通过3次重结晶纯化花椒油素粗品,分别测定晶体和母液中残留物的含量。
1.2.5 核磁共振分析
首先将制备的花椒油素晶体溶解于氘代三氯甲烷(纯度99.8%),浓度10 mmol/L。以四甲基硅烷为内标物,利用核磁共振仪测定其氢谱(1H-NMR)和碳谱(13C-NMR)。
2 结果与讨论
2.1 花椒油素的提取
在制备前需建立花椒油素的测定方法,目前常用反相高效液相法[12~13],设备运行成本较高,前期经验证明气相色谱(GC)具备测定花椒油素的能力。经过方法学验证,GC法的工作曲线、相关系数、准确度(回收率)、精密度(标准偏差)等指标均满足《中国药典》分析测定的要求。首先对同时蒸馏萃取参数进行优化,结果见图1。根据方差分析(P<0.05),料水比在小于1∶8(g∶mL)时,花椒油素得率并未显著提高(图1-a);无水乙醚用量60 mL时,花椒油素得率远高于用量为40 mL时,而增加用量对提高得率并无帮助(图1-b)。无水乙醚用量偏小,使其蒸发量小,造成萃取不完全,而得率偏低;用量偏大,不仅无助于得率增加,还增加消耗和成本。由图1-c可知,提取2.5 h后花椒油素得率未显著(P>0.05)增加。所以,SDE最佳参数为料水比1∶8,溶剂(无水乙醚)体积60 mL,提取时间2.5 h。粗提物呈白色(略带黄色),经 GC测定发现粗提物中花椒油素含量达20.26%(表1)。所用原料为提取左旋龙脑后剩余艾纳香残叶,为增加原料利用度,可提取其所含的花椒油素。花椒油素的提取多使用乙醇、乙酸乙酯等有机溶剂[4~5,12,14],在尝试有机溶剂提取后发现粗提物是黑色膏状物,大量色素与杂质的存在使后续分离操作难度增加。在前期研究中发现艾纳香叶挥发油含较高比例的花椒油素[16~17],花椒油树脂和精油中也含有较多花椒油素[4]。因此,认为通过蒸馏可提取花椒油素,而且蒸馏得到的挥发物组分类别较少,利于分离。结果证实,同时蒸馏萃取法可从艾纳香叶中获得花椒油素,粗提物中花椒油素含量达20%(表1)。
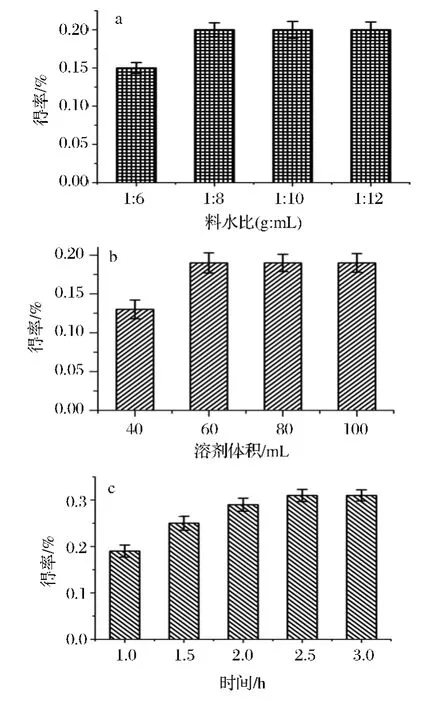
图1 同时蒸馏萃取法中料水比、溶剂体积与提取时间对花椒油素得率的影响Fig.1 Influence of ratio of material to water,solvent volume,and extraction time on yield of xanthoxylin in SDE
2.2 花椒油素的分离
花椒油素随挥发物从艾纳香叶中蒸馏出来,前期研究发现艾纳香挥发物多为萜类化合物[16~17],此类物质可使用硅胶柱色谱分离,优化得柱参数见图2。图2-a显示,选择体积比1∶19的乙酸乙酯∶石油醚作为洗脱液可顺利分离出花椒油素,此配比极性偏弱,虽然分离速度偏慢,但分辨率较高。硅胶柱径高比为1∶10和1∶12时都未能实现分离,当径高比为1∶14时成功分离(图2-b);图2-c显示样品与硅胶质量比(上样量)为1∶40和1∶60都可实现分离,而再增加上样量至1∶30时不能实现分离,所以选择粗提物:硅胶质量比为1∶40;图2-d显示3个洗脱液流速(1.5、2.5、3.5 mL/min)的洗脱峰基本重叠,都可成功完成分离,因此选择最大值3.5 mL/min为流速,以获得最高洗脱效率。硅胶柱是极性柱,自身含有羟基更易吸附极性较强的物质[18],花椒油素在洗脱中段被洗出,说明其极性中等。GC测定显示柱分离得到的花椒油素粗品纯度为72.09%(表1),回收率达到99.04%,说明柱分离过程几乎不损失花椒油素。朱廷春等[14]使用300~400目硅胶分离出花椒油素,并应用于分析,但处理量偏小。以上参数说明该色谱系统适合应用于大量制备,更有希望放大为工业级水平。
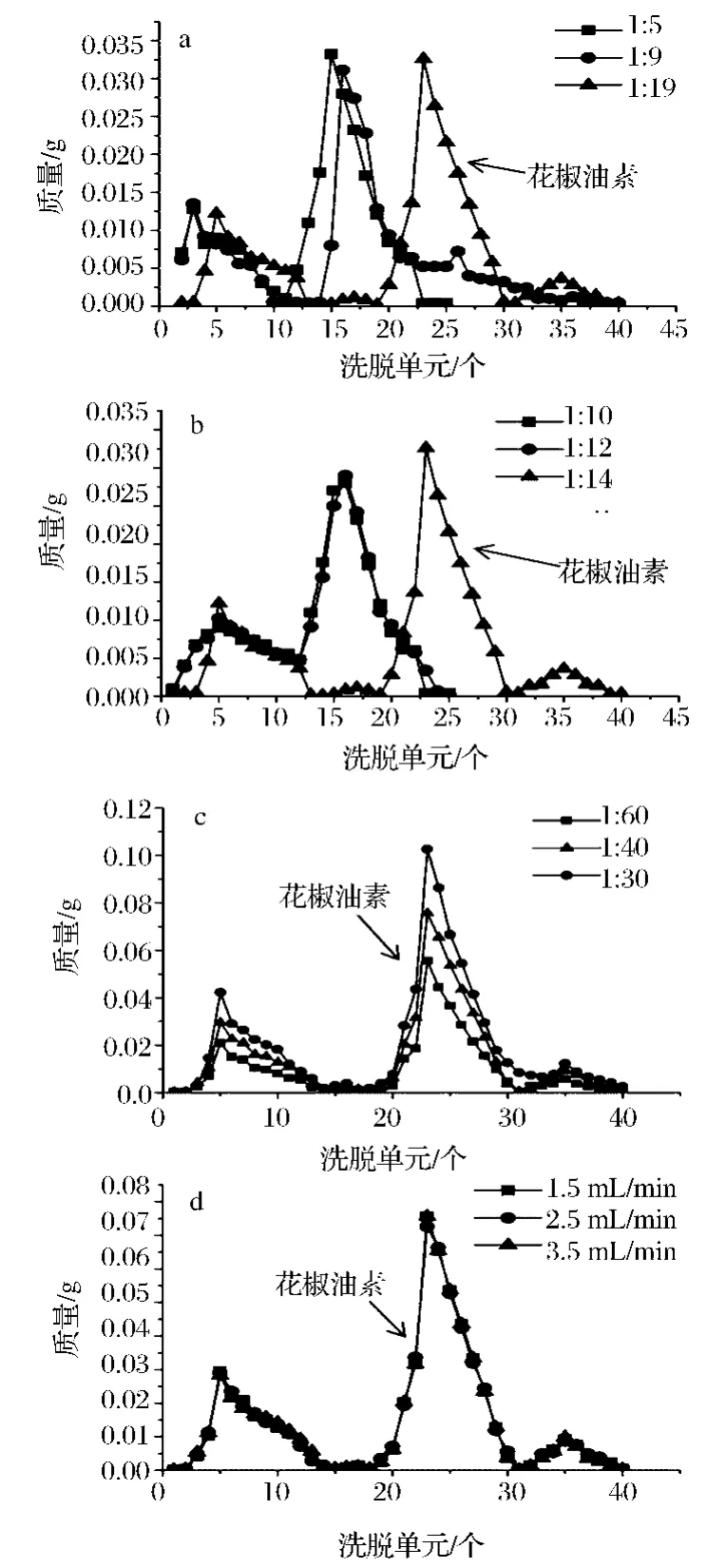
图2 洗脱液配比(a)、径高比(b)、质量比(c)、流速(d)对硅胶柱分离的影响Fig.2 Effects of solvent(a),ratio of diameter to height(b),loading quantity(c),and flow rate(d)in silica gel column
2.3 花椒油素的纯化
柱分离得到的花椒油素仅为粗品,需进一步纯化,重结晶结果见表2。1次重结晶得到的花椒油素晶体纯度达98.56%,可回收粗品中59.14%的花椒油素,母液残留物包含39.51%,总和达98.65%,说明重结晶适用于纯化花椒油素。对母液中剩余的花椒油素再进行重结晶,以求最大限度收集花椒油素,经过2次、3次重结晶得到的晶体纯度分别为98.47%和98.08%。在已有报道中,谭道鹏等[3]使用石油醚等溶剂通过重结晶制得高纯花椒油素(纯度 >98%),收率为 62.6% ~83.8%;杨健等[11]使用水通过重结晶法从合成粗品中制取花椒油素,收率为60%~70%。本文中3次重结晶所得花椒油素晶体平均纯度达 98.37%(表 1);累计回收率达到91.92%,优于前辈研究。同时,说明重结晶不仅实现纯化,还可较好的回收花椒油素。最终从艾纳香叶中得到的花椒油素得率为0.28%。若再进行多次重结晶,可进一步提高回收率。
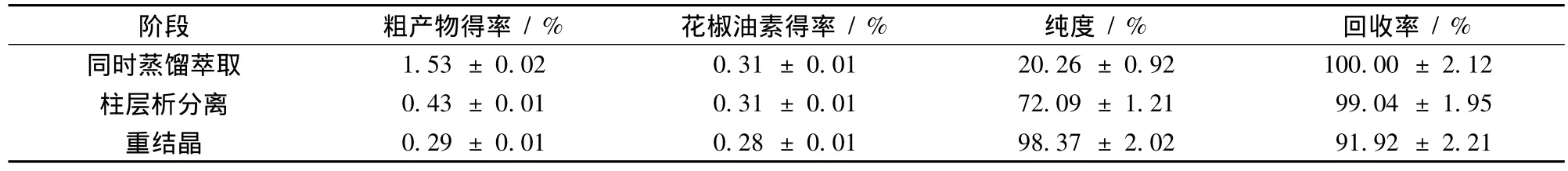
表1 不同步骤花椒油素的产量Table 1 Yields of xanthoxylin in different steps
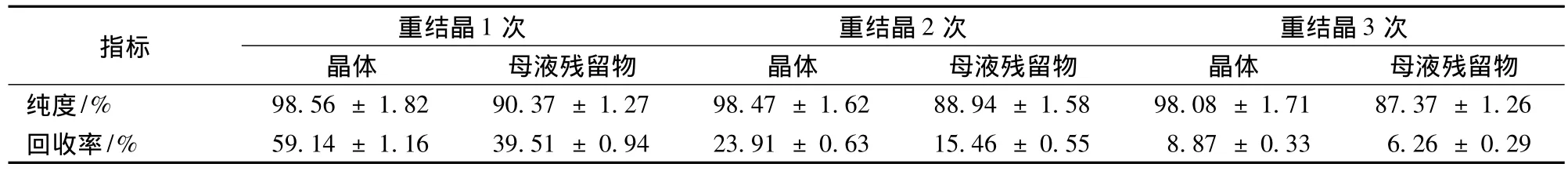
表2 晶体与母液中花椒油素含量和回收率Table 2 Purities and recoveries of xanthoxylin in crystal and residue
2.4 核磁共振分析
纯化后晶体的化学结构通过核磁共振分析,结果显示1HNMR(CDCl3,δ):2.62(3H,s,—CH3),3.84(3H,s,—OCH3),4.01(3H,s,—OCH3),5.90(1H,d,J=2.6 Hz,H—3),6.02(1H,d,J=2.7 Hz,H—5),14.07(1H,s,—OH)。13CNMR(CDCl3,δ):32.5(—CH3),55.5(2C,—OCH3),90.6(C-5),93.7(C-3),106.3(C-1),162.6(C-2),166.2(C-6),167.5(C-4),203.3(C==O)。与文献[19]比较,证实此晶体确为花椒油素(图3)。
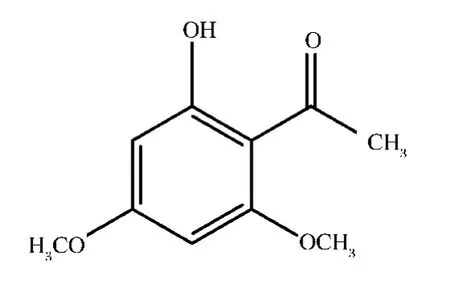
图3 花椒油素化学结构图Fig.3 Structure of xanthoxylin
3 结论
以艾纳香残叶为原料,通过同时蒸馏萃取法、硅胶柱层析和重结晶纯化后制备高纯花椒油素。在料水比1∶8(g∶mL)时,同时蒸馏萃取2.5 h后可充分提取残叶中花椒油素,粗提物中含量为20.26%。经过硅胶柱层析,径高比为1∶14,上样量为1∶40(粗提物∶硅胶)时,分离出纯度为72.09%的粗品,回收率达99.04%。最后通过3次重结晶制得高纯花椒油素(98.37%),实现回收91.92%的花椒油素,终得率为0.28%。
[1] 官玲亮,庞玉新,王丹,等.中国民族特色药材艾纳香研究进展[J].植物遗传资源学报,2012,13(4):695-698.
[2] 中华人民共和国药典[S].一部.2010.
[3] 谭道鹏,严启新,康晖,等.一种以天然艾粉为原料制备花椒油素的方法[P].中国,102701939A.2012-10-03.
[4] 赵秀玲.花椒的化学成分、药理作用及其资源开发的研究进展[J].中国调味品,2012,37(3):1-4.
[5] 朱元龙,徐择邻,刘宝善.中药乌桕根皮之初步化学研究[J].药学学报,1958,6(1):51-52.
[6] 金云海,程远远.花椒油素对血小板聚集的抑制作用[J].中药新药与临床药理,2000,11(6):352-355.
[7] 金云海,蒋毅萍,林继红.花椒油素对A23187和钙调节血小板及细胞内游离钙作用的研究[J].第一军医大学学报,2000,20(6):516-519.
[8] WEN Mao-gui,ZHANG Xin-bo,TIAN Jian-niao,et al.Binding interaction of xanthoxylin with bovine serum albumin[J].J Solution Chem,2009,38(4):391-401.
[9] Boeck P,Leal P C,Yunes R A,et al.Antifungal activity and studies on mode of action of novel xanthoxyline-derived chalcones[J].Arch Pharm Chem Life Sci,2005,338(2-3):87-95.
[10] De Campos-Buzzi F,De Campos J P,Tonini P P,et al.Antinociceptive effects of synthetic chalcones obtained from xanthoxyline [J].Arch Pharm Chem Life Sci,2006,339(7):361-365.
[11] 杨健,吴婷,杨涛,等.一种制备花椒油素的方法[P].中国,102070430A.2011-05-25.
[12] 文永新,黄永林,朱廷春,等.反相高效液相色谱法测定艾纳香中不同部位花椒油素的含量[J].时珍国医国药,2007,18(9):2137-2138.
[13] 朱咏华,平伟君.RP-HPLC法定量分析花椒油素[J].精细化工中间体,2001,31(2):56-57.
[14] 朱廷春,文永新,王恒山,等.艾纳香的化学成分研究(I)[J].广西植物,2008,28(1):139-141.
[15] WANG Y H,TIAN H Y,WANG A M,et al.A green and solvent-free process for preparation of high-purity(–)-borneol from leaves of Blumea balsamifera(L)DC[J].Trop J Pharm Res,2014,13(1):41-46.
[16] 王远辉,王洪新,田洪芸,等.HS-SPME与GC-MS联用分析不同季节艾纳香叶香气成分[J].食品科学,2012,33(14):166-170.
[17] 王远辉,田洪芸,何思佳,等.不同方法提取艾纳香叶挥发性成分的气相色谱-质谱分析[J].食品工业科技,2012,33(12):97-105.
[18] Bawazeer S,Sutcliffe O B,Euerby M R,et al.A comparison of the chromatographic properties of silica gel and silicon hydride modified silica gels[J].J Chromatogr A,2012,1 263:61-67.
[19] Valenciennes E,Smadja J,Conan J Y.Screening for biological activity and chemical composition of Euodia borbonica var.borbonica(Rutaceae),a medicinal plant in Reunion Island[J].J Ethnopharm,1999,64(3):283-288.
