反相硅胶纯化阿克苏“次等枣”环磷酸腺苷*
2015-12-25岳丽热那汗买买提敬思群
岳丽,热那汗·买买提,敬思群
(新疆大学生命科学与技术学院,新疆乌鲁木齐,830046)
环磷酸腺苷 (cyclic adenosine monophosphate,cAMP)是一种重要的生物活性物质,广泛存在于植物细胞中[1],具有重要的生理调节作用[2-3],可用于调节免疫[4-5]、治疗心血管疾病,具有营养心肌、舒张血管的作用。cAMP还是细胞内参与调节物质代谢和生物学功能的重要物质,是激素作用的“第二信使”,在细胞内发挥激素调节生理机能和物质代谢作用,对糖、脂肪、蛋白质代谢的调控以及对基因表达、细胞分化与增殖的调节、免疫机能的影响、动物生产性能的调控等起着重要的作用[6-8]。
红枣营养丰富,含有多种营养成分,其中多糖、cAMP和三萜酸是最具特色和优势的三类功能性成分。据报道,成熟枣的果肉中cAMP含量可达100~500nmol/g[9],为所有已测动植物中最高的,是一般动植物的数千至数万倍[10-11]。我国每年红枣产量约6 000多万 t,其中“次等枣”(裂枣、落枣、小枣、色差枣等)约占产量的30% ~40%,甚至达70%以上,如不能进行及时有效的加工,将造成枣资源的巨大浪费,鉴于环磷酸腺苷(cAMP)特殊的生理活性作用,且在红枣中含量较高,本研究主要以“次等枣”为原料生产红枣环磷酸腺苷并将其纯化。目前,主要利用大孔树脂纯化技术纯化cAMP。大孔树脂具有比表面积大、吸附容量大、吸附速度快、解吸条件温和等优点,但是再生较麻烦、重复利用周期较短、物理化学稳定较差。所以本研究为避免上述问题及方便工业化生产,利用了反相硅胶。反相硅胶预处理较简单,用甲醇浸泡即可;装柱方便;再生较简单,可重复利用周期比大孔树脂长数百倍;物理化学稳定性较好;分离效率较高。虽然现在已有利用反相硅胶分离纯化其他活性成分的报道[12-13],但未见关于反相硅胶纯化红栆cAMP的研究,所以本研究采用C18反相硅胶纯化技术纯化“次等枣”cAMP并对纯化条件进行初步探讨。
1 材料与方法
1.1 材料、仪器与试剂
1.1.1 仪器
电子分析天平,郑州长城科工贸有限公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;Agilent 1100型高效液相色谱仪,由Agilent G1314A型紫外检色器、Agilent 1100型高效液相色谱仪等部分组成;FD-1-50冷冻干燥机,北京博医康实验仪器有限公司;电子精密pH指示计,上海精密科学仪器有限公司;HH-S型恒温水浴锅,巩义市英峪予华有限公司。
1.1.2 试剂
试验原料,超声辅助提取法得到红枣cAMP提取液。cAMP标准品(色谱纯、纯度为99%),美国Sigma公司;反相硅胶(ODS C18反相硅胶,50目),加拿大Silicycle公司;甲醇(色谱纯);KH2PO4(上海市化学试剂三厂、色谱纯);甲醇(分析纯);试验用水,超纯水和二重蒸馏水;KI,上海化学试剂有限公司;CHCl3,上海化学试剂有限公司。
1.2 实验方法
1.2.1 环磷酸腺苷纯化工艺流程
次等栆→清洗→切片→真空干燥→粉碎→过60目筛→次等栆粉→称取样品→加入溶剂→搅拌均匀→超声辅助提取→离心→上清液→沉淀(多糖)→浓缩→过反相硅胶柱吸附→水洗→用甲醇洗脱→浓缩→过0.45 μm微孔滤膜→含量测定
操作要点:精密称取一定量的阿克苏次等栆粉,按照最佳提取工艺条件下超声辅助提取。于离心机3 500 r/min条件下离心15 min,取上清液,向上清液中加入3倍体积的无水乙醇,把红枣多糖沉淀下来,剩下的上清液浓缩到一定体积后按照上样液浓度、上样液pH、上样液流速过反相硅胶柱子吸附,然后先用水洗再以一定浓度、洗脱速度的甲醇洗脱,旋蒸浓缩,过0.45 μm微孔滤膜[14]。用高效液相色谱法进行含量测定。
1.2.2 环磷酸腺苷含量测定
采用高效液相色谱法,按照热那汗等[15]的方法,得到的回归方程为:y=31.046x+56.209,R2=0.999 3,根据此标准曲线计算环磷酸腺苷含量。
1.2.3 反相硅胶预处理
用甲醇浸泡C18反相硅胶,对其进行预处理。然后匀浆湿法装柱,用甲醇冲洗反相硅胶,一般情况下常规清洗、再生可以使用100%的甲醇和丙酮。
1.2.4 反相硅胶静态吸附试验
精密量取预处理好的30.000 g(湿重)反相硅胶置于三角瓶中,同时做3个平行样,加入浓缩好的提取液50 mL,密封,于振荡器(25℃,100次/min)中振荡,使其充分吸附12h,取上清液,用0.45 μm微孔滤膜过滤。用高效液相色谱法进行含量测定并计算其吸附率。
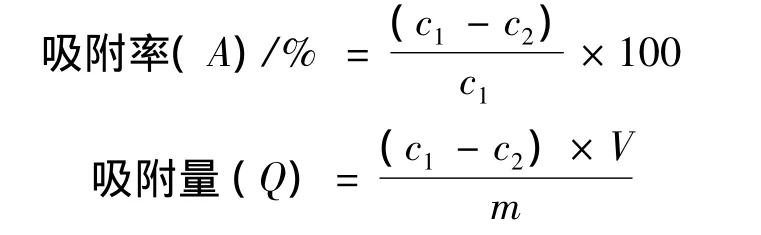
式中:c1,吸附前提取液中环磷酸腺苷的质量浓度,μg/mL;c2,吸附后溶液中环磷酸腺苷的质量浓度,μg/mL;Q,反相硅胶吸附量,μg环磷酸腺苷/g反相硅胶;V,样液体积,mL;m,反相硅胶质量,g。
1.2.5 反相硅胶静态解吸试验
分别将上述充分吸附了cAMP的反相硅胶过滤,用水冲洗后滤干。再将其置于三角瓶中,分别加入体积分数为50%甲醇溶液200 mL,密封,置于恒温振荡器中进行解吸,24 h后过滤,取滤液,浓缩至25 mL,过0.45 μm微孔滤膜。用高效液相色谱法进行含量测定并计算其解吸率。
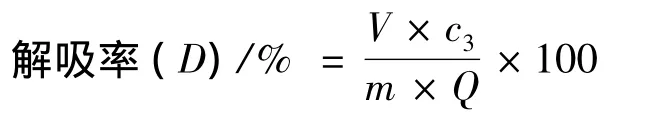
式中:c3,解吸后溶液中环磷酸腺苷的质量浓度,μg/mL;V,解吸液体积,mL;m,反相硅胶质量,g;Q,反相硅胶吸附量,μg环磷酸腺苷/g反相硅胶。
1.2.6 反相硅胶静态吸附及解吸试验
通过静态吸附与解吸性能实验,进行动态上样液浓度的选择、上样液流速的选择、上样液pH值的选择、洗脱液浓度的选择、洗脱液流速的选择等动态吸附与解吸性能的考察。
1.2.7 纯度的检测
对最佳提取工艺条件下提取的次等栆提取液和用反相硅胶上柱吸附解吸后的洗脱液进行浓缩,然后冷冻干燥,分别得到纯化前后cAMP。采用高效液相色谱法进行含量测定,以标准品的纯度为100%,通过对比峰面积确定纯化前后纯度的变化。
1.2.8 统计学分析
采用SPSS 17.0软件和正交助手软件对所得数据进行方差分析。
2 结果与分析
2.1 反相硅胶静态吸附试验
静态吸附实验结果表明反相硅胶的吸附率为85.59%。尤研[16]研究了 SP-825、D-101、SP-207、HZ-802型大孔树脂对cAMP的吸附率。结果表明,吸附率最高的是SP-825,吸附率为42.80%;而崔志强[17]的文献报道,HPD-400型大孔树脂对cAMP的吸附率为84.1%。由此可以看出,反相硅胶的吸附率大于上述型号的大孔树脂。
2.2 反相硅胶静态解吸实验
静态解吸实验结果表明反相硅胶的解析率为86.53%。而尤研[16]的研究表明,大孔树脂解析率较高的是 HZ-802、D101,它们的解吸率分别为73.46%、70.74%。反相硅胶的吸附率和解析率大于上述型号的大孔树脂。同样,王立霞[18]研究了LS-200型树脂对和田玉枣cAMP的吸附率和解析率,吸附率达80.1%,但是解吸率为54.02%,综上比较,选择反相硅胶作为填料,并在静态吸附解吸实验的基础上进行动态吸附解吸实验。
2.3 反相硅胶动态吸附试验
2.3.1 泄漏曲线
准确称取反相硅胶50.000g,装于层析柱中(下同),选择 pH 7、浓度 70μg/mL的阿克苏次等枣cAMP提取液,控制上样液流速2mL/min,期间每管收集10mL,测定流出液中cAMP的浓度,确定漏点,并计算出每克反相硅胶的最大上样液体积。
如图1可知,从收集的第17份流分开始,cAMP含量明显升高。因此,确定第16份为漏点。所以50 g反相硅胶吸附饱和的最大上样体积确定为160 mL。每克反相硅胶所吸附饱和的最大上样体积为3.2 mL。
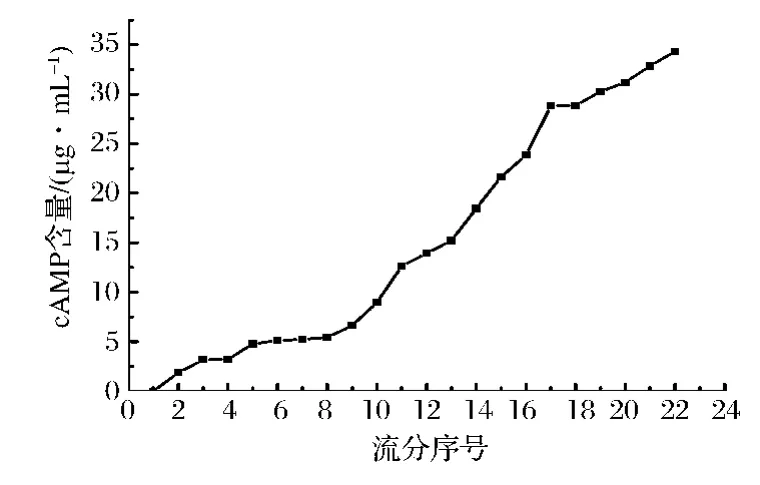
图1 反相硅胶对阿克苏次等栆cAMP的吸附泄露曲线Fig.1 adsorption curve of reverse phase silica gel leaked Aksu inferior jujube cAMP
2.3.2 上样液浓度的选择
取pH 7的阿克苏次等栆cAMP提取液160 mL,选择上样液浓度40、50、60、70、80 μg/mL 5 个水平,以1 mL/min的流速上柱吸附,收集流出液,过0.45 μm微孔滤膜。进行含量测定并根据公式计算其吸附率。
对于一定量的溶质而言,上样液浓度的增加就会使溶质与反相硅胶接触的表面积增加,因此反相硅胶对溶质的吸附作用增强,同时吸附效果也更好。但上样液浓度过高,将使吸附选择性降低、cAMP泄漏时间提早。因此必须选择适宜的吸附剂浓度。由图2可见,上样液的浓度从50 μg/mL增加到70 μg/mL时,反相硅胶的吸附量也随之增大,最大吸附率达到61.43%。当上样液浓度高于70 μg/mL后,吸附率反而下降。因此上样液的浓度为70 μg/mL时,吸附效果最好。
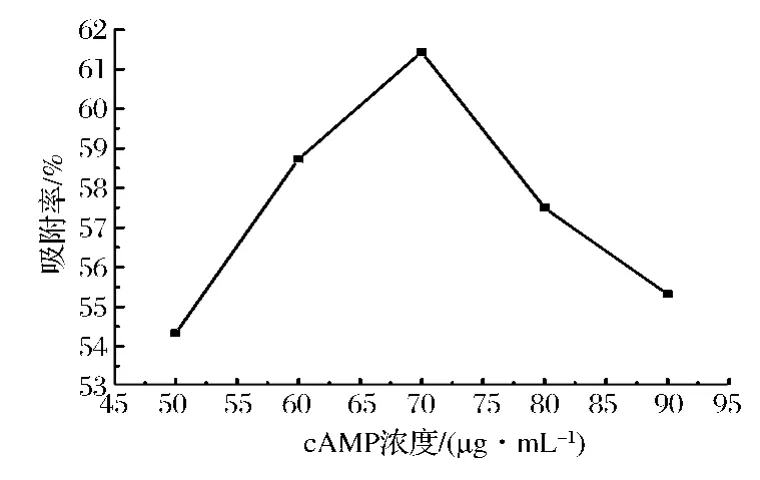
图2 上样液浓度对反相硅胶吸附率的影响Fig.2 effect of the sample concentration on adsorption rate
2.3.3 上样液流速的选择
取pH 6、浓度70 μg/mL的阿克苏次等枣cAMP提取液 160 mL,分别选择 0.5、1、1.5、2、2.5、3 mL/min 5个流速上柱吸附,其他操作同2.3.2。
上样流速是影响上样液向反相硅胶内部扩散速度的直接因素,从而影响反相硅胶的吸附效果。从图3中可以看出,当上样液流速达到1.5 mL/min时,吸附率达到最大值,而随着流速的加快,吸附率明显减小。如果上样过慢,吸附时间会增加,将延长生产周期。而上样液流速过快,反相硅胶的吸附量下降,能耗明显增加。综合考虑这2方面的影响,初步选择1.5 mL/min为上样液流速。
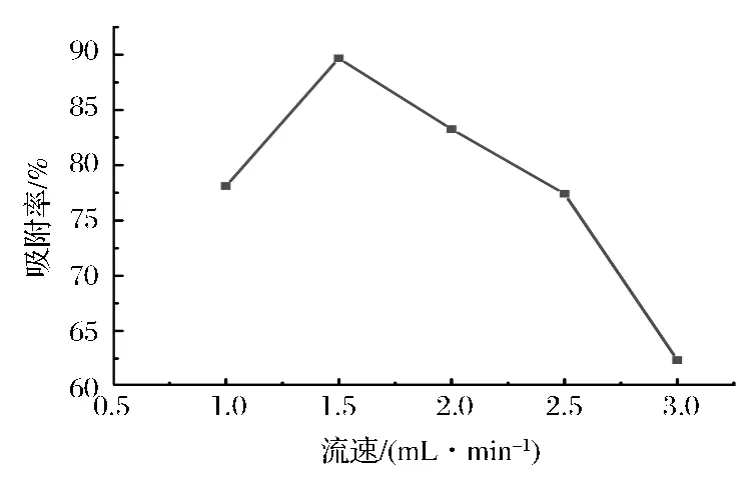
图3 上样液流速对反相硅胶吸附率的影响Fig.3 effect of the sample flow rate on adsorption rate
2.3.4 上样液pH值的选择
取浓度为70 μg/mL的阿克苏次等栆cAMP提取液 160 mL,调节 pH 值分别为4、5、6、7、8,以1.5 mL/min的流速上柱吸附,其他操作同2.3.2。
上样液pH值对化合物的吸附、分离过程有很大的影响。吸附过程中,被吸附的物质一般以分子的形式被吸附。因此为了达到较好的效果,必须使吸附物质保持分子状态。cAMP是弱酸性物质[18],磷酸基团的pKa值约为1.0,因此在酸性或弱酸性条件下容易被吸附。由图4可知,随着上样液pH的提高,cAMP吸附率也随之提高。当上样液pH值达到6时,吸附率达到最大值。以后随着上样液pH值的提高,吸附率反而呈现下降趋势,在pH值小于6时,吸附情况并不理想。这是因为反相硅胶表面吸附过多的酸性离子,影响到cAMP的吸附。因此,适宜的上样液pH值为5.5~6.5。
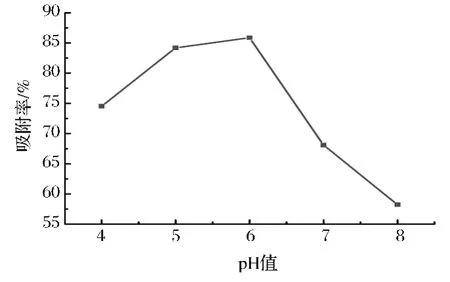
图4 上样液pH值对反相硅胶吸附率的影响Fig.4 Effect of sample liquid pH on reverse phase silica gel adsorption rate
2.3.5 正交优化试验
在单因素实验的基础上,以吸附率%为考察指标,采用L9(33)正交表设计正交试验。结果见表1。
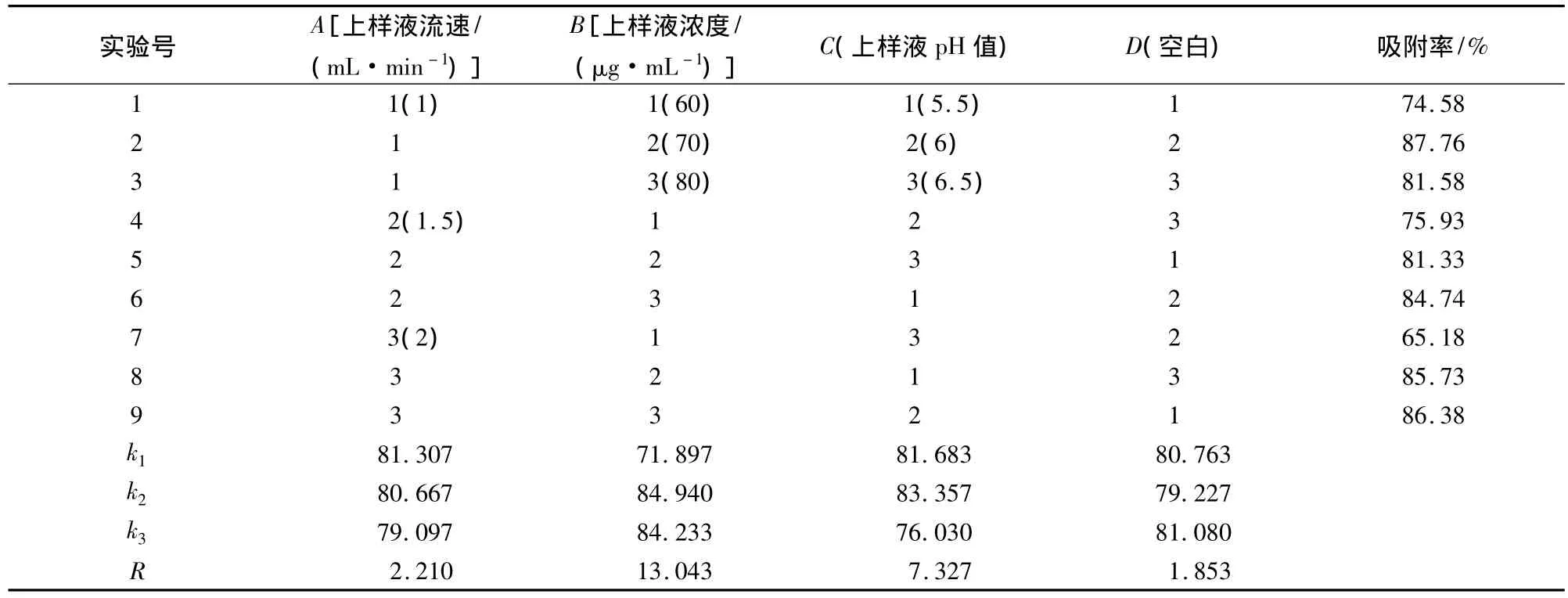
表1 环磷酸腺苷动态吸附正交优化试验结果表Table 1 Experimental results of orthogonal test for cAMP dynamic adsorption

表2 环磷酸腺苷动态吸附正交优化试验结果方差分析Table 2 Variance analysis forcAMP dynamic adsorption experiment
由方差分析结果(表2)可见,因素B(上样液浓度)显著(P<0.05),因素A(上样液流速)、因素C(上样液pH值)不显著,因素作用的主次顺序是B(上样液浓度)>C(上样液pH值)>A(上样液流速),与极差分析得出的结果一致。对表1正交实验结果进行分析得出最优水平组合为A1B2C2,上样液流速为1mL/min、上样液浓度为70μg/mL、上样液pH为6。在此条件下做验证试验3次,结果平均吸附率为87.70%。
2.4 反相硅胶动态解吸试验
2.4.1 洗脱曲线
准确称取100.000 g的反相硅胶,装于层析柱中,取pH值为6、浓度为70 μg/mL的阿克苏次等栆cAMP提取液320 mL,以1 mL/min的流速上柱吸附,先水洗,然后选择体积分数为50%的甲醇,以2 mL/min的流速洗脱,期间每管收集15 mL,过0.45 μm微孔滤膜后进行含量测定绘制洗脱曲线,并计算出每克反相硅胶充分吸附后洗脱所需要的最佳洗脱剂用量。
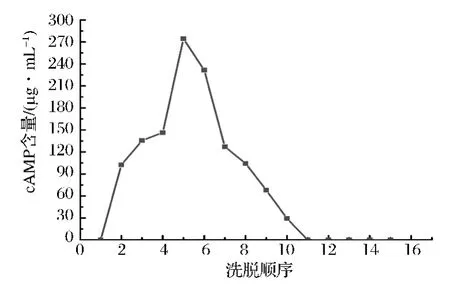
图5 反相硅胶对阿克苏次等栆cAMP的50%甲醇洗脱曲线Fig.5 50%methanol elution curve of reverse phase silica gel leaked Aksu inferior jujube cAMP
如图5可知,从收集的第12份流份开始,收集液中未检出cAMP含量。因此吸附饱和的100 g反相硅胶充分洗脱所需要的最低洗脱剂用量确定为165 mL。吸附饱和的每克反相硅胶所需要的最低洗脱剂用量为1.65 mL。
2.4.2 洗脱液浓度的选择
取质量浓度为70 μg/mL,pH 6的阿克苏次等栆提取液320 mL,以1 mL/min的流速上柱吸附,先用水洗然后分别用165 mL的体积分数30%、40%、50%、60%、70%、80%的甲醇溶液以2 mL/min的流速进行洗脱,洗脱液浓缩后定容至50 mL,过0.45 μm微孔滤膜。进行含量测定并根据公式计算其解吸率。
由图6可知,当甲醇体积分数在30% ~60%内时,随着甲醇浓度的增加,cAMP解吸率也增加。当甲醇体积分数达到60%时,解吸率的变化趋势基本保持平衡。为了考虑成本问题,把60%的甲醇作为最佳洗脱浓度。
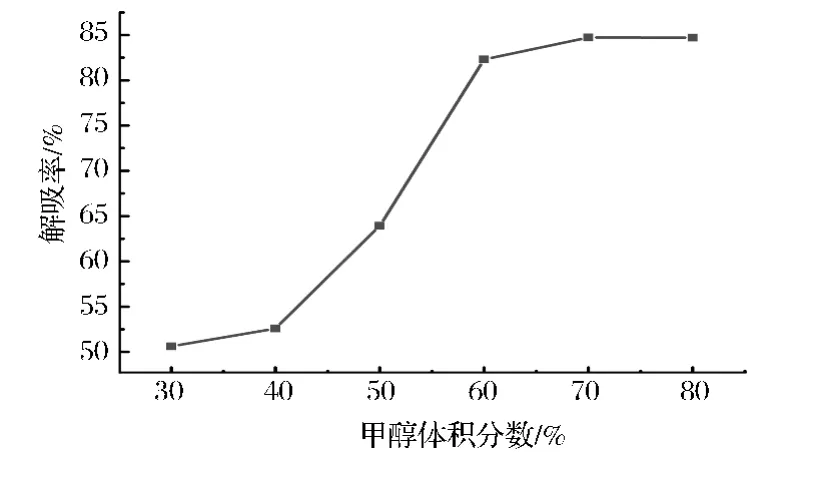
图6 甲醇体积分数对反相硅胶解吸率的影响Fig.6 Influence of methanol concentration on the resolution rate of the reverse phase silica gel
2.4.3 洗脱液流速的选择
取浓度70 μg/mL、pH 6的阿克苏次等栆提取液320 mL,以1 mL/min的流速上柱吸附,先水洗,然后用 60%的甲醇 165 mL,分别以 1、2、3、4、5 mL/min 5个流速洗脱,其他操作同2.4.2。
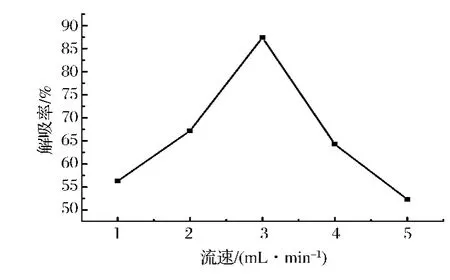
图7 洗脱剂流速对反相硅胶解吸率的影响Fig.7 Influence of eluent flow rate on the resolution rate of the reverse phase silica gel
由图7可知,当洗脱液流速在1~3 mL/min内时,随着洗脱流速的增大,cAMP解吸率也增加。当洗脱剂流速达到3 mL/min时,解吸率达到最大值87.39%,以后随着洗脱流速的增大,解吸率反而呈现下降趋势。这表明洗脱速度太快,洗脱剂和环磷酸腺苷还未充分接触就流过了反相硅胶柱,不能充分的解吸。所以洗脱液流速定3 mL/min为宜。
2.5 纯度的检测
由图8可以看出,纯化后杂质峰较纯化前明显减少,但是纯化前峰、纯化后峰与标准品峰的保留时间存在微小差异,其原因可能是红枣提取液中的三萜酸类及其他成分影响了保留时间,引起纯化前峰、纯化后峰与标准品峰的保留时间有些偏差。经计算其纯化前的纯度为0.098%,纯化后的纯度为44.69%。可以看出,纯化前后纯度的变化极其显著,说明采用反相硅胶可以达到对阿克苏次等栆cAMP提取液初步纯化的目的。为达到医疗等相关领域的更高要求,需通过其他纯化途径进一步提高制品纯度,这还有待于更深的研究。
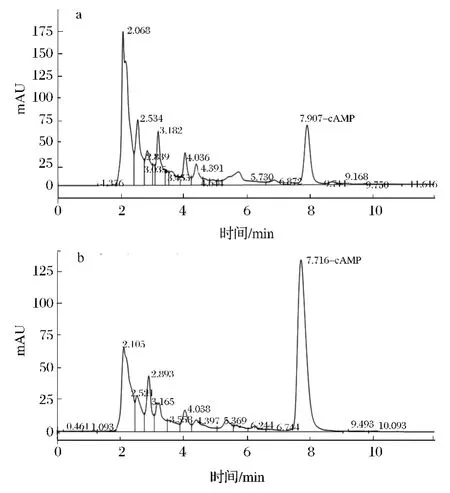
图8 纯化前的cAMP粗品(a)、纯化后的cAMP粗品(b)的液相色谱图Fig.8 Before purification of of cAMP crude(a),purified of cAMP crude(b)
3 结论
通过反相硅胶静态试验和动态试验筛选出纯化阿克苏次等枣cAMP的最佳条件:上样液流速为1 mL/min、上样液浓度为70 μg/mL、上样液pH值为6、洗脱液为体积分数60%的甲醇、洗脱液流速为3 mL/min。在此条件下的吸附率和解析率最高,同时还确定了最大上样体积和最佳洗脱剂的用量。
根据以往文献报道,尤逢惠[19]选用XAD 7HP大孔吸附树脂纯化栆cAMP,得到cAMP粗品,纯度为3.55%;王立霞[18]等用LS 200型树脂对和田玉枣中cAMP分离纯化,得到 cAMP粗品纯度为3.47%,崔志强[20]用HPD.400型树脂纯化冬枣 cAMP,纯化后cAMP纯度从0.109%增加到32.453%。本研究采用反相硅胶纯化得到的cAMP粗体物的纯度达到了44.69%,与以上结果对比,有明显提高。
[1] Nikolaus A.The current status of cyclic AMP in high plants[J].Annual Review of Plant Physiology,1977,2(8):123-132.
[2] Schwede F,Maronde E,Genieser H,et al.Cyclic nucleotide analogs as biochemical tools and prospective drugs[J].Pharmacol& Therapeutics,2000,87(2):199-226.
[3] Marin D,Dunphy G B,Mandato C A.Cyclic AMP affects the haemocyte responses of larval Galleria mellonella to selected antigens[J].Journal of Insect Pysiology,2005,51(5):575-586.
[4] Yuen L P,Wong A S T,Auersperg N.Gonadotropins regulate N-cadherin-mediated human ovarian surface epithelial cell survival at both post-translational and transcriptional levels through a cyclic AMP/protein kinase a pathway[J].Journal of Biological Chemistry,2005,280(15):15 438-15 448.
[5] Fabiana S,Giorgio F,Cecilia F,et al.Bordetella pertussis Inhibition of Interleukin-12(IL-12)p70 in human monocyte-derived dendritic cells blocks IL-12 p35 through adenylate cyclase toxin-dependent cyclic AMP induction[J].Infection and Immunity,2006,74(5):2 31-2 38.
[6] 王镜岩.生物化学[M](第三版).北京:高等教育出版社,2008:512-518.
[7] 高士争,张曦,程美玲.环腺苷酸的生物学作用与动物营养代谢调控[J].中国畜牧兽医,2003,30(6):21-23.
[8] 牟德华,朱艳丽,张艳芳,等.大枣环腺苷酸及其生物学功能[J].食品科技,2007,32(5):273-275.
[9] Cyong J C.Cyclic Adenosine Monophosphate in the frute of ziziphus Jujuba[J].Phytochemistry,1980,19:2 747-2 748.
[10] 蒋劢博,王强,李建贵等.响应面法优化红枣中环磷酸腺苷(cAMP)超声提取工艺[J].中国食品学报,2014(1):114-120.
[11] 蒲云峰,万英,侯旭杰.HPLC法测定不同品种红枣中cAMP含量[J].食品研究与开发,2011,32(7):109-112.
[12] 田毅峰,李先国,沙森洁,等.反相硅胶键合相的制备和性能评价[J].2007,29(1):12-14.
[13] 陈玉,田学军,李芸芳,等.金刚纂萜类成分研究[J].药学学报,2009,44(10):1118-1122.
[14] 王春霞,路福平,刘逸寒,等.纳膜过滤在提取红枣环磷酸腺苷(cAMP)中的应用[J].食品与发酵工业,2011,37(2):186-190.
[15] 热那汗·买买提,敬思群.阿克苏“次等枣”环磷酸腺苷提取工艺优化[J].食品科技,2013,38(05):232-235.
[16] 尤妍.哈密大枣环磷酸腺苷提取纯化工艺研究[D].乌鲁木齐:新疆农业大学,2011.
[17] 崔志强,环磷酸腺苷微波辅助萃取工艺研究[J].食品科技,2008(5):147-149.
[18] 王立霞,陈锦屏,张娜.和田玉枣中环磷酸腺苷(cAMP)的分离纯化工艺研究[J].食品科学,2008,29(12):250-254.
[19] 尤逢惠,潘见,杨毅.大孔吸附树脂分离大枣中cAMP的研究[J].安徽大学学报:自然科学(增刊),2006,30:102-104.
[20] 崔志强.冬枣环磷酸腺苷提取纯化工艺研究[D].沈阳:沈阳农业大学,2007.
