复配保鲜剂对冻藏鱿鱼品质变化的影响*
2015-12-25刘妙杨宪时李学英迟海黄洪亮
刘妙,杨宪时,李学英,迟海,黄洪亮
1(中国水产科学研究院东海水产研究所,上海,200090)2(上海海洋大学食品学院,上海,201306)
鱿鱼(squids),也称枪乌贼、柔鱼,是软体动物门头足纲枪形目枪乌贼科的总称。我国每年鱿鱼捕获量达到36~43万t,占据世界鱿鱼捕获量的36%左右,是我国重要的远洋捕捞经济动物[1]。鱿鱼具有高蛋白、低脂肪、低热量的优点,同时还富含钙、牛磺酸、磷、VB1等多种人体所需的营养成分,其营养价值毫不逊色于牛肉和金枪鱼[2]。
对于鱿鱼来说,冷冻保藏是最主要的保藏方法,能在长期贮藏中极大地保持鱿鱼的品质。冷冻环境下不仅可以降低鱿鱼蛋白内部自身的各类生化反应速率,还可以降低微生物的繁殖速率[3]。但是冷冻保藏容易使鱼肉蛋白发生冷冻变性,使鱼肉的持水性、胶凝性、口感和营养价值都产生不良的变化。在水产品中加入保鲜剂可以有效防止蛋白质变性,延长鱿鱼的保质期。普通的保鲜剂性能单一,保鲜效果具有一定的局限性。复合保鲜剂是当前保鲜剂研究的主要方向之一,但是复合保鲜剂对冻藏鱿鱼的保鲜效果的研究还很少。路钰希等[3]选取了D-山梨醇、乳酸钠、三聚磷酸盐、混合磷酸盐和海藻糖5种保鲜剂,探讨了单一保鲜剂对冻藏条件-20℃下鱿鱼品质变化的影响。本研究在该保鲜剂单因素试验的基础上,选取保鲜效果较好的海藻糖、乳酸钠、混合磷酸盐进行各种比例复配,以持水率(WHC)、盐溶性蛋白质含量(SSP)、活性巯基含量为指标,并结合色差试验和质构,分析鱿鱼在-20℃冻藏条件下的品质变化。旨在筛选出较优配比的复合保鲜剂来提高鱿鱼质量,延长鱿鱼的货架期,为鱿鱼保鲜剂的开发提供基本的数据支持。
1 材料和方法
1.1 材料与仪器
鱿鱼为2013年9月在经纬度为155°42'E,42°55'N的公海区域捕捞的北太平洋鱿鱼,船上冻结后贮藏-20℃运至实验室,-80℃贮藏备用。
海藻糖、乳酸钠、混合磷酸盐[m(三聚磷 酸钠)∶m(焦磷 酸钠)∶m(六偏磷 酸钠)=2∶2∶1]、考马斯亮蓝 G-250、5,5’二硫代双(2-硝基苯甲酸)、三羟甲基氨基甲烷、牛血清蛋白、无水乙醇、H3PO4、KCl、KH2PO4、NaOH、HCl等,试剂均为分析纯或化学纯,购于国药集团化学试剂有限公司。
JYL-350绞肉机,上海九阳股份有限公司;IUL均质机,西班牙;5810R高速冷冻离心机,Eppendorf德国;CR-400色差仪,CHROMA METER日本;TMS-Pro质构仪,Food Technology Corporation美国;721可见分光光度计,上海菁华科技仪器有限公司;HH-8恒温水浴锅;MPR-414F冰箱,Sanyo日本;YP200N电子天平,上海菁海仪器有限公司。
1.2 样品处理与贮藏实验
鱿鱼从-80℃冰箱中取出,流水解冻。去除头部、内脏和皮,取胴体切块备用。将各组样品放入对应浓度的复配保鲜剂中浸渍10 min,复配保鲜剂溶液与鱿鱼比例(mL∶g)为 2∶1[4],对照组在蒸馏水中浸渍10 min。取出鱿鱼沥干,根据保鲜剂浓度依次放入保鲜袋中,贮藏于(-20±0.1)℃冰箱中。每隔10 d随机抽样进行持水率、盐溶性蛋白质含量、活性巯基含量、色差和最大剪切力测定,共贮藏60 d。测定时将冻藏鱿鱼流水解冻。
保鲜剂的添加量均符合GB 2760-2011食品添加剂使用卫生标准,复配保鲜剂溶液添加水平如表1所示。

表1 鱿鱼复配保鲜剂L9(34)正交试验因素水平表Table 1 Design of squid complex fresh-keeping orthogonal experiment L9(34)
1.3 实验方法
1.3.1 正交试验
选用海藻糖、乳酸钠和混合磷酸盐,以持水力、盐溶性蛋白质含量、活性巯基含量为测试指标,按公式(1)和公式(2)进行评分。并采用三因素三水平L9(34)进行正交试验(表2),同时进行方差分析,根据分析结果确定复配保鲜剂的最佳配比。

式中:指标值为某次测量的实际值;指标最小值为该指标所有测量结果中的最小值;指标最大值为该指标所有测量结果中的最大值。

1.3.2 持水率的测定
[5]略作修改,采用加压重量法,对鱿鱼的持水率进行测定。取1 cm厚质量约为10 g的肉块,上下各垫10层滤纸,用TMS-Pro质构仪,35 kg压力压5 min,压完后称其质量,计算持水率[公式(3)]:

式中:m为加压前样品的质量,g;m1为加压后样品的质量,g。
1.3.3 盐溶性蛋白含量的测定
参考文献[6]作适当修改,用绞肉机把鱿鱼绞碎,取4 g装入均质袋中,加入10倍量的冰冷的0.6 mol/L 的KCl溶液,pH 7.2,均质2 次,每次30 s,在4℃下提取2 h,然后离心(8 000 r/min,20 min,4 ℃)。收集上清液,加入3倍量的冷水再次离心(8 000 r/min,20 min,4℃),所得上清液即为盐溶性蛋白溶液。采用考马斯亮蓝法测定蛋白质含量,用牛血清蛋白测定标准曲线(标准曲线为y=0.005 7x+0.014 4,R2=0.998 3),计算结果以mg/g表示,每组试验做3个平行。
1.3.4 肌动球蛋白的提取
肌动球蛋白根据MacDonald等的方法制备。取绞碎后的鱿鱼肉4 g,装入均质袋中,加入40 mL冰冷的(4℃)0.6 mol/L的 KCl溶液,pH 7.0。均质4 min,每均质20 s,放在冰中间歇20 s,防止均质过热。然后离心(8 000 r/min,30 min,0 ℃),收集上清液加入3倍量的冰冷的去离子水稀释肌动球蛋白。再离心(8 000 r/min,20 min,0 ℃),所得沉淀加入等量的冰冷的1.2 mol/L的KCl溶液,pH 7.0,在0℃下搅拌 30 min,不溶部分再次离心(8 000 r/min,20 min,0℃)[7]。所得肌动球蛋白溶液用0.6 mol/L KCl溶液调节到4 mg/mL,冷藏备用。
1.3.5 活性巯基含量的测定
参照 Benjakul和 Ellman等[7]方法,采用 DTNB法测定活性巯基含量。取1mL的4 mg/mL肌动球蛋白溶液,加入9 mL 0.2 mol/L Tris-HCl缓冲液,pH 6.8。取4 mL混合物,加入0.4 mL 0.1%5,5’二硫代双(2-硝基苯甲酸)(DTNB)溶液,在40℃下反应25 min,溶液在412 nm下测定吸光值。空白用0.6 mol/L KCl溶液代替。每组试验做3个平行。活性巯基含量按公式(4)计算:

式中:c0为巯基的摩尔浓度,mol/g;A为吸光值;D为稀释倍数;ε为吸光系数,L/mol·cm;c为蛋白质量浓度,mg/mL。
1.3.6 色差的测定
取完整肉块,用色差仪测定样品的 L*、a*、b*值。其中,L*表示亮度;+a*表示红,-a*表示绿;+b*表示黄,-b*表示蓝。每组样品测定10次。
1.3.7 剪切力的测定
取1 cm宽1 cm厚的鱿鱼条,采用TMS-Pro型质构仪,通过Texture Lab Pro软件测定鱿鱼的剪切力。最大力量感应量程:1 000 N,回程距离:20 mm,测试速度:60 mm/min,每组样品测定10次。
1.4 数据分析和处理方法
实验数据采用Microsoft Excel 2007进行统计分析。用SPSS 17.0进行方差分析。P<0.05为差异显著,P<0.01为差异极显著。
2 实验结果与讨论
2.1 复配保鲜剂最佳配比的确定
鱿鱼复配保鲜剂正交试验结果及结果分析如表2、表3所示。由表2可知,所选的3种保鲜剂对鱿鱼保鲜效果主次作用为:A>B>C,即海藻糖>乳酸钠>混合磷酸盐。方差分析结果如表3所示,海藻糖和乳酸钠的添加量对正交试验结果有极显著的影响(P<0.01),混合磷酸盐的添加量对正交试验结果有显著影响(P<0.05)。

表2 鱿鱼复配保鲜剂正交试验L9(34)第60天试验结果Table 2 Results of squid complex fresh-keeping agents orthogonal experiment L9(34)at the 60thday

表3 鱿鱼复配保鲜剂正交试验L9(34)第60天结果的方差分析Table 3 Variance analysis of squid complex fresh-keeping agents orthogonal experiment L9(34)at the 60thday
以综合评分作为总指标进行直观分析得出7号试验(A3B3C2)效果最好,即海藻糖5%,乳酸钠6%,混合磷酸盐0.4%。在本实验中综合分越大越好,各因素应取最大K值所对应的水平,即A3B3C3,海藻糖5%,乳酸钠6%,混合磷酸盐0.5%。该方案不包括在9组试验中,所以对直观分析最优组(A3B3C2)和方差分析最优组(A3B3C3)进一步做验证试验,对鱿鱼添加保鲜剂后分别冻藏60 d,试验结果如表4所示。从表4可以看出,方差分析最优组(A3B3C3)优于直观分析最优组(A3B3C2),因此复配保鲜剂最佳组合为A3B3C3,即海藻糖5%,乳酸钠6%,混合磷酸盐0.5%。A3B3C3与A3B3C2相比,持水力有显著差异(P<0.05),盐溶性蛋白含量和活性巯基含量差异不显著(P>0.05)。这可能是因为混合磷酸盐的保水性能较好,混合磷酸盐浓度的提高使得鱿鱼失水率下降,持水力增强。

表4 验证实验结果Table 4 Results of verification tests
2.2 复配保鲜剂对冻藏鱿鱼持水率的影响
持水率反映了肉制品的持水能力,持水率对肉制品的颜色、多汁性、柔嫩程度等食用品质有直接影响[8-9]。鱿鱼的持水率越高,说明持水能力越好,反之持水率越低,持水能力越差。Conalves等人[10]认为冷冻过程中冰晶的形成,使肌肉组织细胞结构的破坏,导致肉品持水性能下降。图1是鱿鱼持水率随冻藏时间的变化。从图1可以看出,随着冻藏时间的延长,复配组和空白组的持水率都越来越低,表明鱿鱼的持水能力越来越差。复配组和空白组持水率相比差异极显著(P<0.01),鱿鱼的 WHC初始值为(93.79±0.90)%,冻藏60 d后,复配组持水率为(87.76±0.72)%,空白组持水率仅为(77.04±0.87)%,WHC分别下降了6.03%和16.75%。三聚磷酸钠与焦磷酸盐可以与肌肉蛋白相互作用,促使肌动球蛋白解离成肌动蛋白和肌球蛋白。Nakamura等人[11]认为,肌动球蛋白解离成肌动蛋白和肌球蛋白会导致WHC的提高。说明复配组保鲜剂可以使冻藏鱿鱼保持好的持水能力。

图1 鱿鱼冻藏中持水率的变化Fig.1 Change of water-holding rate from frozen squid
2.3 复配保鲜剂对冻藏鱿鱼盐溶性蛋白含量的影响
蛋白质是鱿鱼肌肉的主要成分,占到了胴体含量的16%~18%。按蛋白质对溶剂的溶解性不同,可分为水溶性蛋白质、盐溶性蛋白质、碱溶性蛋白质、水不溶性蛋白质。图2表示了复配保鲜剂对冻藏鱿鱼盐溶性蛋白含量的影响。
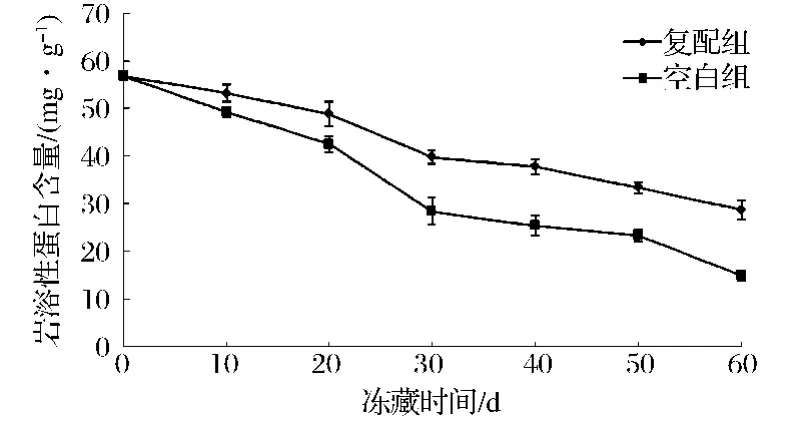
图2 鱿鱼冻藏中盐溶性蛋白含量的变化Fig.2 Change of salt soluble protein content from frozen squid
从图2可以看出,随着冻藏时间的增加,复配组和空白组的盐溶性蛋白含量均呈下降趋势。复配组与空白组盐溶性蛋白含量差异极显著(P<0.01)。鱿鱼的盐溶性蛋白质含量初始值为(56.88±1.02)mg/g,冻藏60 d后,复配组SSP含量为(28.86±1.25)mg/g,空白组SSP含量为(14.96±1.16)mg/g。在整个冻藏过程中,复配组和空白组SSP含量分别下降了49.26%和73.70%。说明复配组保鲜剂能够减缓盐溶性蛋白含量下降速率,有效防止蛋白质冷冻变性。
盐溶性蛋白也称肌原纤维蛋白,包括肌动蛋白、肌球蛋白、原肌球蛋白、肌钙蛋白、辅肌动蛋白等。一般认为,冻藏过程中形成的二硫键、氢键和疏水键等导致了蛋白质的盐溶性下降。曾名勇等[12-13]认为,在冻藏过程中肌原纤维蛋白含量的下降是由于蛋白质的部分结合水形成冰晶,导致肌动球蛋白分子之间相互形成非共价键,进而形成超大分子的不溶解的凝集体所致。另外,盐溶性蛋白变性后,会产生一种在高离子强度下不能溶出但在碱液中可以溶出的蛋白质,即碱溶性蛋白质,也会导致盐溶性含量在冻藏过程中下降。Sompongese等[14]认为,巯基氧化形成的二硫键会导致肌球蛋白重链的聚合,降低其盐溶性。
2.4 复配保鲜剂对冻藏鱿鱼活性巯基的影响
巯基含量反映了蛋白质变性聚合的程度。图3表示了复配保鲜剂对冻藏鱿鱼活性巯基含量的影响。

图3 鱿鱼冻藏中活性巯基含量的变化Fig.3 Change of active sulfhydryl group content from frozen squid
Sompongse等[14]认为,巯基含量在冻藏过程中下降的原因可能是冰晶的形成使得肌原纤维蛋白空间结构发生改变,使埋藏在分子内部的巯基暴露出来,进而被氧化成二硫键,导致巯基含量的减少。从图3可以看出,随着冻藏时间的增加,复配组和空白组的活性巯基含量都呈下降的趋势。与空白组相比,复配组活性巯基含量有显著差异(P<0.05)。初始点的鱿鱼活性巯基含量为(7.12±0.03)×10-5mol/g,冻藏至60 d时,复配组活性巯基含量下降至(5.16±0.04)×10-5mol/g,空白组活性巯基含量为(3.15±0.05)×10-5mol/g。在整个冻藏过程中,复配组的活性巯基含量下降了1.96×10-5mol/g,空白组下降了3.97×10-5mol/g,空白组的活性巯基含量减少值是复配组活性巯基含量减少值的2倍。上述结果表明,复配组保鲜剂能够很大程度的抑制巯基的氧化,提高抗氧化性和冻藏稳定性,保持冻藏鱿鱼的品质。
2.5 复配保鲜剂对冻藏鱿鱼色泽的影响
表5是冻藏鱿鱼复配组和空白组的L*,a*,b*值。复配组和空白组L*值相关系数为0.903,相关性大,a*值,b*值相关系数很小。解冻后的鱿鱼颜色略发白,颜色较为一致,故选定L*值来进行其色泽的评价。从表5可以看出,随着冻藏时间的增加,复配组和空白组的L*值都缓慢下降,复配组和空白组L*值差异极显著(P<0.01)。Park等和 Yang等[15-16]认为L*值容易受到含水量的影响,含水量越大,L*值越大。Conalves等人[10]认为含水量高的肉品表面游离水分增加,对光的反射效果增强,从而造成L*值的升高。复配组持水力高,水分含量高,所以L*值大。复配组L*值较大,肉更加有光泽,说明复配保鲜剂有助于保持冻藏鱿鱼肉品的光泽度。

表5 复配保鲜剂对冻藏鱿鱼色泽的影响Table 5 Effect of complexantistaling agents on color of frozen squid
2.6 复配保鲜剂对冻藏鱿鱼质构的影响
本研究采用TPA方法对鱿鱼肌肉组织的硬度(最大剪切力)特性进行分析。图4表示了复配保鲜剂对鱿鱼最大剪切力的影响。

图4 鱿鱼冻藏中最大剪切力的变化Fig.4 Change of maximum shear stress from frozen squid
如图4所示,复配组和空白组的最大剪切力都随冻藏时间的延长而降低,复配组的下降速度低于空白组,复配组和空白组差异显著(P<0.05)。影响剪切力的因素有很多,pH、脂质氧化、酶水解、预处理方式、甲醛的形成、碳酸盐、冷冻保护剂等都会对剪切力产生影响[17]。复配保鲜剂对于减缓鱿鱼质构变化有一定的作用,但其对鱿鱼咀嚼性和弹性方面的影响仍需进一步研究。
3 结论
(1)本文选取保鲜效果较好的海藻糖、乳酸钠和混合磷酸盐进行复配,通过3因素3水平的L9(34)的正交试验,以持水率、盐溶性蛋白质含量、活性巯基含量为指标,用综合评分法分析了鱿鱼在-20℃冻藏条件下的品质变化。根据正交试验结果和方差分析,各因素对冻藏鱿鱼保鲜效果影响的主次顺序为海藻糖>乳酸钠>混合磷酸盐。海藻糖和乳酸钠的添加量对正交试验结果有极显著的影响(P<0.01),混合磷酸盐添加量对试验有显著影响(P<0.05)。实验得出的复配保鲜剂的最佳配比浓度是海藻糖5%,乳酸钠6%,混合磷酸盐0.5%。
(2)在-20℃冻藏60 d后,复配组和空白组的WHC、SSP、活性巯基含量分别为87.76%、77.04%;28.86、14.96 mg/g;5.16 × 10-5、3.15 × 10-5mol/g。复配组和空白组WHC和SSP含量呈极显著差异(P<0.01),活性巯基含量差异显著(P<0.05)。通过验证,发现复配保鲜剂对于提高冻藏鱿鱼的持水率,减缓盐溶性蛋白含量和活性巯基含量的下降速率有显著的作用。同时复配保鲜剂有助于保持冻藏鱿鱼肉品的光泽度,减缓鱿鱼质构变化。说明该复配保鲜剂对-20℃贮藏条件下的鱿鱼保鲜效果显著。
参考文献
[1] 杨宪时,王丽丽,李学英,等.秘鲁鱿鱼和日本海鱿鱼营养成分分析与评价[J].现代食品科技,2013,29(9):2247-2251.
[2] Ichii T,Mahapatra K,Sakai M,et al.Changes in abundance of the neon flying squid Ommastrephes bartramii in relation to climate change in the central North Pacific Ocean[J].Marine Ecology Progress Series,2011,441:151-164.
[3] 路钰希,沈萍,李学英,等.保鲜剂对冻藏鱿鱼品质变化的影响[J].食品工业科技,2014,35(19):274-279.
[4] 杨峰,李学英,杨宪时,等.常用水产保鲜剂对南极磷虾品质的影响研究[J].现代食品科技,2012,28(10):1285-1289.
[5] Maqsood S,Benjakul S,Balange A K.Effect of tannic acid and kiam wood extract on lipid oxidation and textural properties of fish emulsion sausages during refrigerated storage[J].Food Chemistry,2012,130(2):408-416.
[6] Pan B,Yeh W.Biochemical and morphological changes in grass shrimp(Penaeusmonodon)muscle following freezing by air blast and liquid nitrogen methods[J].Journal of food biochemistry,1993,17(3):147-160.
[7] Benjakul S,Seymour T A,Morrissey M T,et al.Physicochemical changes in Pacific whiting muscle proteins during iced storage[J].Journal of Food science,1997,62(4):729-733.
[8] 孙灵霞,赵改名,柳艳霞,等.动物因素对肌肉保水性影响的研究进展[J].安徽农业科学,2007,35(3):731-732.
[9] 周光宏,李春保,徐幸莲.肉类食用品质评价方法研究进展[J].中国科技论文在线,2007,2(2):75-82.
[10] Conalves E M,Cruz R M S,Abreua M,et al.Biochemical and colour changes of watercress during freezing and frozen storage[J].Journal of Food Engineering,2009,93(1):32-39.
[11] Nakamura Y,Migita K,Okitani A,et al.IMP improves water-holding capacity,physical and sensory properties of heat-induced gels from porcine meat[J].Animal Science Journal,2014,85(5):595-601.
[12] 曾名勇,黄海,李八方.不同冻藏温度对鲈鱼肌肉蛋白质生化特性的影响[J].青岛海洋大学学报:自然科学版,2003,33(4):525-530.
[13] 曾名勇,黄海.鲫鱼(Carassiusauratus)肌原纤维蛋白生化特性在冻藏过程中的变化[J].青岛海洋大学学报:自然科学版,2003,33(2):192-198.
[14] Sompongse W,Itoh Y,Obatake A.Effect of cryoprotectants and a reducing reagent on the stability of actomyosin during ice storage[J].Fisheries Science,1996,62(1):73-79.
[15] Park J W.Surimi gel colors as affected by moisture content and physical conditions[J].Journal of Food Science,1995,60(1):15-18.
[16] Yang H,Park J W.Effects of starch properties and thermalprocessing conditions on surimi– starch gels[J].LWTFood Science and Technology,1998,31(4):344-353.
[17] Sánchez-Valencia J,Sánchez-Alonso I,Martinez I,et al.Estimation of frozen storage time or temperature by kinetic modeling of the Kramer shear resistance and water holding capacity(WHC)of hake(Merluccius merluccius,L.)muscle[J].Journal of Food Engineering,2014,120:37-43.
