响应面优化大孔吸附树脂分离纯化茼蒿总黄酮*
2015-12-25陈建中葛水莲昝立峰王更先邢浩春付静
陈建中,葛水莲,昝立峰,王更先,邢浩春,付静
1(邯郸学院 生命科学与工程学院,河北邯郸,056005)2(冀南太行山区野生资源植物研发中心,河北邯郸,056005)
研究表明,黄酮类物质具有抗癌、抗病毒,调节免疫力、治疗心脑血管疾病、骨质疏松和糖尿病并发症等多种生理活性药用作用[1-2]。茼蒿(Chrysanthemum coronarium L.)又名蓬蒿,是菊科茼蒿属1年或2年生草本植物。其茎叶可作为蔬菜食用,亦可入药。《中药大辞典》记载,茼蒿有“和脾胃、消痰饮、安心神”之功效,性味甘、辛、平,无毒,清利头目,利小便[3]。
大孔吸附树脂具有比表面积较大、吸附纯化效率高、物理吸附污染低、温度稳定性高等特点[4-5]。因而近几年在中草药有效成分提取和天然产物的分离纯化中被广泛应用[6-7]。有关茼蒿总黄酮(TFC)纯化工艺的研究并不多见,试验以TFC的吸附量和回收率为指标,通过单因素试验和响应面优化试验考察5种大孔吸附树脂对TFC的静态、动态吸附和解吸附性能,以筛选大孔树脂纯化TFC的最佳工艺。
1 材料方法
1.1 材料试剂仪器
材料:茼蒿于开花前采集地上部分,采时株高多20~40 cm,为冀南太行山区野生种类,采集地上部分。材料去掉杂质、洗净尘土、沥干水分,再于60℃鼓风干燥箱中烘至恒重,粉碎过40目筛后备用。
试剂:无水乙醇、芦丁、NaNO2、Al(NO3)3、NaOH等均为分析纯。
试验仪器及设备:小型自动粉碎机(郑州市烽火机械设备有限公司),L5紫外可见分光光度计(日本岛津仪器公司),N-1100V-WP旋转蒸发仪(西安安泰仪器公司)。
1.2 标曲绘制与TFC浓度测定
标曲绘制:参考江敏[8]、田徽[9]等人的方法,根据试验数据得出,吸光度(Y)和浓度(X)的回归方程:Y=9.12X-0.023,R2=0.998 6,线性回归关系良好。黄酮含量测定:吸取样品液1 mL,用体积分数(下同)70%乙醇补至5 mL,加入质量分数 5%NaNO20.3 mL,摇匀置6 min;再加入质量分数10%Al(NO3)30.3 mL,摇匀置6 min;加质量分数4%NaOH 4 mL,用蒸馏水定容至10 mL,摇匀15 min后测定吸光度,重复3次求均值[10]。
1.3 大孔吸附树脂静态分离纯化试验
1.3.1 大孔吸附树脂的预处理
取树脂适量,95%乙醇完全浸泡24 h,去除大孔树脂碎片及杂物。采用湿法装柱,用95%乙醇反复洗涤,直至水与流出液不产生白色浑浊,再用蒸馏水洗至无醇味;接着先后用体积分数5%的HCl与质量分数2%的NaOH反复淋洗,并静止置2~4 h后,用蒸馏水洗至pH值中性,浸泡于蒸馏水中备用。
1.3.2 大孔吸附树脂静态吸附-解吸性能试验
在25℃下精确称取经预处理的5种大孔树脂5.00 g,分别置于250 mL磨口三角锥形瓶中,精密加入浓度2.56 mg/mL的 TFC100 mL,每隔15 min振摇20 s持续2 h,使其充分吸附至吸附平衡,精密移取剩余样液适量测定其吸光度值,计算吸附前后黄酮质量浓度的变化;将吸附至饱和状态的树脂另置于250 mL锥形瓶中,精密加入95%乙醇50 mL,每隔10 min振摇20 s,振摇2 h,精密吸取上层液测定吸光度值,计算各树脂的吸附量,解吸附率和回收率。
吸附量/(mg·g-1)=(c0-c1)V/M
吸附率/%= [(c0-c1)/c0]×100
解吸率/%=[c2/(c0-c1)]×100
回收率/%=(c2/c0)×100
式中:c0为吸附液中黄酮质量浓度,mg/L;c1为吸附后溶液黄酮质量浓度,mg/L;c2为解吸液中黄酮质量浓度,mg/L;M为干树脂的吸附量,mg/L;V为吸附液体积,mg/L[11]。
1.4 大孔树脂动态吸附-解吸性能优化试验
1.4.1 大孔树脂上样液的泄露曲线测试
准确称取经预处理的大孔树脂5.00 g进行动态吸附,取上样溶液黄酮浓度为2.56 mg/mL,以1 mL/min的流速上树脂柱。分段收集流出液,每份10 mL,收集30份,以编号为横坐标,以黄酮含量为纵指标,绘制泄漏曲线,流出液中黄酮浓度达到上柱液浓度的10%时,称为泄漏点,当流出液中黄酮浓度达到上柱液浓度的100%时,称为饱和点[12]。
1.4.2 上样质量浓度对树脂吸附的影响
取7份2.56 mg/mL的TFC提取液,加水稀释至0.25、0.50、0.75、1.00、1.25、1.50 和 2.00 mg/mL,分别加入D-101树脂柱,以1.0 mL/min的流速通过,95%乙醇洗脱,测定流出液中黄酮浓度。
1.4.3 上样液pH对树脂吸附的影响
取6份1.00 mg/mL的TFC 50 mL,分别用酸或碱将 pH 值调至 4、5、6、7、8、9,分别加入 6 根 D-101树脂柱,以1.0 mL/min的流速过柱吸附,95%乙醇溶液进行反复洗脱,测定流出液的黄酮含量。
1.4.4 大孔树脂洗脱曲线的测定
称取经预处理的D-101大孔树脂5.00 g,取已知质量浓度的黄酮溶液以1 mL/min的流速通过进行动态吸附,待树脂达到完全吸附平衡后,用95%的乙醇以以2 mL/min的流速进行洗脱,分段收集洗脱液,每份收集10 mL,分段测定洗脱液中黄酮含量,绘制洗脱曲线[13]。
1.4.5 大孔树脂洗脱剂浓度对解吸附的影响
取5份质量浓度0.50 mg/mL TFC提取液各50 mL,分别加入5根D-101树脂柱,以1.0 mL/min的流速吸附,用55%,65%,75%,85%,95%的乙醇洗脱,测定流出液其中黄酮含量[14]。
1.4.6 洗脱流速对大孔树脂解吸附的影响
取质量浓度为0.5 mg/mL黄酮粗提液50 mL,加入D-101树脂柱,以1.0 mL/min的流速通过后,各用95%乙醇以 1.0,2.0,3.0,4.0,5.0 mL/min 进行洗脱,测定流出液的黄酮含量。
2 结果与分析
2.1 大孔树脂静态和动态解吸附性能测试
2.1.1 大孔吸附树脂的筛选
试验测定5种性质不同的树脂进行静态吸附和解吸附试验,茼蒿黄酮的吸附量,解吸率和回收率数据结果见表1。
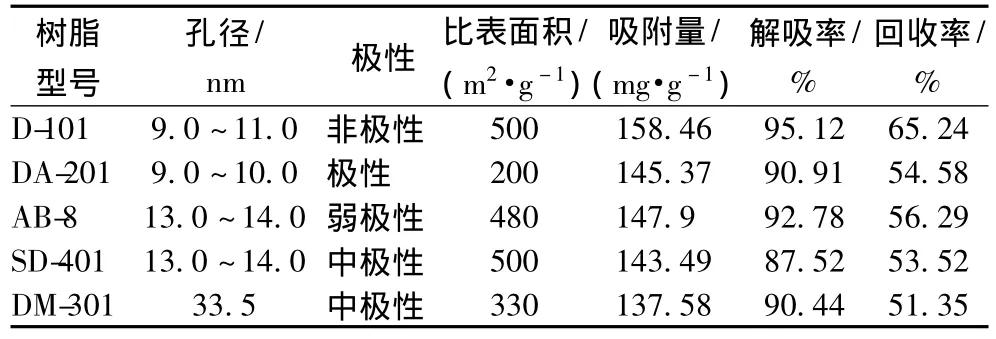
表1 大孔吸附树脂静态吸附性能Table 1 Static adsorption properties of macroporous resins
从表1可以看出,TFC吸附量较大的是D-101和AB-8,其次是 DA-201,SD-401 和 DM-301,解吸附率最强的是D-101和AB-8,结合回收率数据,D-101树脂吸附解吸附特性优于其他树脂。
2.1.2 D-101大孔树脂泄露曲线测试
图1表明,随着进样液体积的增加,流出液中黄酮的浓度逐渐增加。当上柱体积为60 mL时,流出液中黄酮浓度达到0.256 mg/mL,初始上样液黄酮浓度的10%,为大孔吸附树脂D-101的泄露点,所以上柱体积控制在60 mL为宜。当上样液体积逐渐增加,大孔吸附树脂D-101的吸附量逐渐趋于饱和,当样液达到210 mL时,此时流出液黄酮浓度2.56 mg/mL已和上样液相近,该体积为大孔吸附树脂D-101的吸附量的饱和点。

图1 D-101树脂吸附茼蒿黄酮的泄露曲线Fig.1 Leakage curve of TFC on D-101
2.1.3 上样浓度对D-101大孔树脂吸附性能的影响
图2所示,在低质量浓度区间内,随着进样浓度的增加,树脂吸附量和回收率都在增大,在进样浓度为1.00 mg/mL时,树脂达到最大吸附量,之后吸附量基本上保持不变,但当质量浓度大于1.0 mg/mL后,树脂回收率反而下降,这是因为进样质量浓度大于树脂的吸附饱和度造成。而且进样质量浓度过高,将导致树脂再生次数的增加,缩短树脂使用周期,所以进样液初始质量浓度1.00 mg/mL为宜。

图2 上样质量浓度对D-101大孔树脂吸附性能的影响Fig.2 Effect of concentration on adsorptionof D-101
2.1.4 上样pH对D-101大孔树脂吸附性能的影响
由图3可知,TFC吸附量和回收率都随pH变化明显,当pH值大于6时回收率大于吸附量,当pH=6时回收率和吸附量都达到最大值,且随着pH值继续升高两者都呈下降趋势,当pH≥7时,粗提液会出现沉淀。因此上样液酸碱度选择pH=6比较适宜。
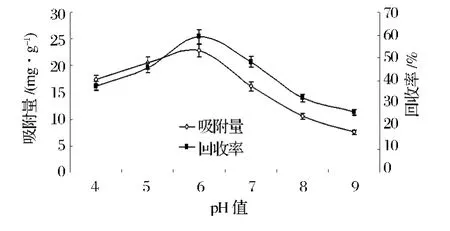
图3 上样pH对D-101大孔树脂吸附性能的影响Fig.3 Effect of pH on adsorption of D-101
2.1.5 D-101大孔树脂洗脱曲线的测定
如图4所示随着洗脱剂用量的增加洗脱液中TFC浓度在不断增加,当洗脱剂为40 mL时,洗脱液TFC浓度达到极大值,随着洗脱剂用量的增加,TFC浓度在逐渐降低,洗脱剂为80 mL时,黄酮含量降低至最低值,洗脱液中TFC不足0.01 mg/mL,说明大孔树脂吸附的TFC基本被洗脱完毕。综合考虑洗脱峰单一,对称,尖锐,没有明显的拖尾现象,表明95%乙醇80 mL可将TFC完全洗脱下来。

图4 D-101大孔树脂的洗脱曲线Fig.4 Elution curve of D-101 macroporous resin
2.1.6 洗脱剂浓度对D-101解吸附性能的影响
由图5可得,当乙醇体积分数≤75%时,随着体积分数的增加,解吸率和回收率二者逐渐增大,当乙醇体积分数>75%时,二者皆呈下降趋势。拥有多酚结构和糖苷键的黄酮类化合物在水溶液中极性较弱,易被乙醇从树脂中洗脱。当乙醇体积分数太高时,将大部分杂质也一起洗脱。因此确定洗脱剂遗传的体积分数75%为宜。

图5 洗脱浓度对D-101大孔树脂解吸附率的影响Fig.5 Effect ofeluent concentration on desorption rate of D-101
2.1.7 洗脱流速对D-101解吸附性能的影响

图6 洗脱流速对D-101大孔树脂解吸附性能的影响Fig.6 Effect ofelution flow speed on desorption rate of D-101
如图6所示,随着洗脱剂流速的增加,大孔树脂的解吸率和回收率都在不同程度的下降,特别当>3 mL/min时,回收率较解吸率下降快速且明显。当洗脱速率1.0 mL/min时洗脱效果好,而在洗脱速率>3.0 mL/min解吸率下降曲线平缓,而回收率下降明显从63.25%下降到44.95%。综合考虑生产周期和回收率确定洗脱速度2.0 mL/min为宜。
2.2 响应面试验优化分析
2.2.1 响应面试验设计
依据中心组合(Box-Benhnken)试验设计原理,做四因素三水平共29个试验点(5个中心点)的响应面分析试验。表2中29个试验点可分为两类:一类是自变量A、B、C、D取值在各水平所构成的三维析因点,共计24个;一类是区域的中心点,零点试验重复5次,用以估计试验误差。A(上样浓度,mg/mL),B(上样 pH),C(洗脱浓度,%),D(洗脱流速,mL/min)为自变量,TFC回收率为响应值Y(指标值)[15]。

表2 响应面试验方案及试验结果Table 2 Design and results of response surface experiment
2.2.2 响应面曲面方差分析
由表3分析可知,(P=0.047<P=0.05)二次回归方程模型显著,失拟项不显著(P=0.428>P=0.05)。通过该模型的方差分析可知:上样pH(B)对TFC回收率影响差异显著(P=0.047),而上样浓度(A)、洗脱浓度(C)和洗脱速度(D)3个因素对TFC回收率影响差异不显著。四因素对TFC回收率影响效应的大小依次pH(B)>上样浓度(A)>洗脱浓度(C)>洗脱速度(D)。经回归模型拟合,四因子对响应值Y的影响可用以下多元二次方程:
Y=63.31-0.72A-0.83B-0.14C-0.072D-0.71AB-0.053AC-0.7AD-0.41BC+0.54BD-0.21CD-2.500E-0.78A2-0.53B2-2.22C2-0.71D2

表3 响应面曲面方差分析Table 3 Variance analysis of response surface experiment
2.2.3 两因素交互影响回收率的响应曲面分析
如图7所示,回收率的响应面开口向下,回收率Y和4个制约因素呈现明显的二次抛物线关系。随着每个因素的增加,响应值回收率Y也在增大。根据吸附动力学理论,随着pH(B)、上样浓度(A)、洗脱浓度(C)、洗脱速度(D)的增加,响应值回收率Y出现极大值,后随着 A、B、C、D再增加,萃取率 Y呈现不同斜率的下降,该回归模型具有稳定点,稳定点是最大值。借助Design-Expert Software 8.0中多元二次回归模型对TFC萃取率进行估算,对二次抛物线函数模型进行极值分析,预测四因素的最佳组合为:上样浓度0.86 mg/mL,pH=6,洗脱浓度74.27%和洗脱流速2.23 mL/min此时模型预测极大值Y=87.3667%(P=0.994)。在Z坐标下进行3组重复试验,TFC回收率平均高达到85.82%,表明该回归模型能准确预测TFC大孔树脂吸附性能。
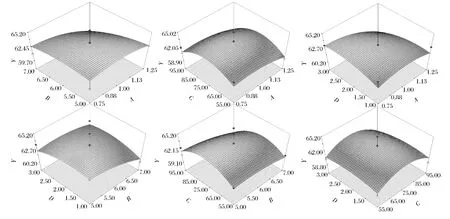
图7 两因素交互影响回收率的响应曲面图分析Fig.7 Response surface analysis of the recovery rate affected by two-factor
3 结论
以茼蒿为原料,对比大孔树脂分离纯化总黄酮的性能,采用单因素和响应面试验相结合的形式,筛选并优化大孔树脂的纯化工艺条件。经试验考察5种不同特性的大孔树脂中,D-101大孔树脂对TFC的吸附纯化显示出最佳的性能。D-101大孔树脂分离纯化TFC的泄漏点:上样体积60 mL,饱和点:210 mL。洗脱曲线表明80 mL的95%乙醇溶液可以将黄酮完全洗脱下来。响应面试验方差分析显示:上样pH对TFC回收率影响差异达到显著水平,而上样浓度、洗脱浓度和洗脱速度3个因素对TFC回收率影响差异不显著。通过回归方程模拟预测最优纯化条件组合:上样浓度0.86 mg/mL,pH=6,洗脱浓度74.27%和洗脱流速2.23 mL/min,TFC回收率从最初的最高值65.19%提升至87.366%。
[1] 万春鹏,刘琼,张新龙,等.药食两用植物茼蒿化学成分及生物活性研究进展[J].现代食品科技,2014,30(10):282-288.
[2] HUANG W,XUE A,NIU H,et al.Optimised ultrasonicassisted extraction of flavonoids from Folium eucommiae and evaluation of antioxidant activity in multi-test systems in vitro[J].Food Chemistry,2009,114(3):1 147-1 154.
[3] 王宗伟.野茼蒿的自由基清除活性和保肝作用[J].国外医药:植物药分册,2006,20(6):260-261.
[4] QI X L,PENG X,HUANG Y Y,et al.Green and efficient extraction of bioactive flavonoids from Equisetum palustre L.by deep eutectic solvents-based negative pressure cavitation method combined with macroporous resin enrichment[J].Industrial Crops and Products,2015,70:142-148.
[5] 王婷婷,王少康,黄桂玲,等.菊花主要活性成分含量及其抗氧化活性测定[J].食品科学,2013,34(15):95-99.
[6] WU S,WANG Y,GONG G,et al.Adsorption and desorption properties of macroporous resins for flavonoids from the extract of Chinese wolfberry(Lycium barbarum L.)[J].Food and Bioproducts Processing,2015,93:148-155.
[7] LI X,SONG H,YAO S,et al.Quantitative analysis and recovery optimisation of flavonoids and anthocyanins in sugar-making process of sugarcane industry[J].Food Chemistry,2011,125(1):150-157.
[8] 江敏,胡小军,林彩霞,等.树脂法分离纯化荔枝核黄酮[J].食品与发酵工业,2013,39(3):206-209.
[9] 田徽,阮期平,赖恩阳,等.大孔树脂纯化马兰总黄酮树脂吸附特性及工艺的研究[J].食品与发酵工业,2012,38(1):224-229.
[10] 王丽芳,卢德勋,丁国和.菊科植物茼蒿有效成分提取工艺条件筛选[J].畜牧与饲料科学,2011,32(9):141-142.
[11] 吴娜,张瑞巧,孙智达.艾蒿中黄酮类化合物的提取工艺研究[J].食品工业科技,2008,29(1):230-232.
[12] 杨仁明,何彦峰,索有瑞,等.大孔树脂富集纯化胡芦巴种子总黄酮[J].食品与发酵工业,2012,38(2):224-228.
[13] Hosni K,Hassen I,Sebei H,et al.Secondary metabolites from Chrysanthemum coronarium(Garland)flowerheads:Chemical composition and biological activities[J].Industrial Crops and Products,2013,44(1):263-271.
[14] 宋倩,赵声兰,刘芳,等.大孔吸附树脂分离纯化核桃壳总黄酮[J].食品与发酵工业,2012,38(12):180-184.
[15] 刘玉芬,夏海涛.响应面法优化碱蒿黄酮提取工艺及其体外抗氧化作用[J].食品科学,2012,33(12):63-68.
