黄芩中黄芩苷提取精制工艺研究
2015-12-25郑艳红常艳芬周玉枝秦雪梅杜冠华山西大学中医药现代研究中心太原00006山西大学化学化工学院中国医学科学院北京协和医学院药物研究所药物靶点研究与新药筛选北京市重点实验室通讯作者mailzhouyuzhisxueducn
郑艳红,常艳芬,周玉枝,秦雪梅,杜冠华(山西大学中医药现代研究中心,太原 00006;山西大学化学化工学院;中国医学科学院北京协和医学院药物研究所“药物靶点研究与新药筛选”北京市重点实验室;通讯作者,E-mail:zhouyuzhi@sxu.edu.cn)
黄芩为唇形科植物(Scutellaria baicalensis Georgi)的干燥根,其性寒味苦,具有清热燥湿,泻火解毒、止血、安胎的功效[1],主要产于我国东北、河北、山西、河南、陕西、内蒙古等地。其成分黄芩苷具有抑菌抗炎、清热解毒、螯合金属离子、镇静、降压、保护神经、抗变态反应和清除超声阴离子等药理作用[2],是黄芩的主要活性成分之一,也是黄芩和黄芩制剂的主要质量控制指标成分。目前,市售的黄芩苷产品有 30%,50%,70%,75%,80%,85%,95%以及98%等不同规格,可用于兽药、化妆品、养生膳食原料和药品等不同领域。在药用领域根据黄芩苷的含量又可把药物制成不同剂型,黄芩苷含量大于70%可制成片剂,大于90%可制成胶囊,大于92%可制成冲剂,大于94%可制成口服液,大于96%可制成针剂[3,4]。因此根据不同剂型的要求,对不同规格的黄芩苷产品的制备工艺进行研究很有现实意义。
目前,国内对黄芩苷制备工艺的研究有较多报道,其提取方法主要有温浸法、煎煮法、微波法、超滤法等[5-8],常用的精制方法有沉淀分离、高速逆流分离、大孔树脂分离等[9-10],传统方法在提取有效成分方面存在着损失大、周期长、工序多、提取率不高、环境污染严重等缺点,因此,有必要探究一种工艺简单、生产周期短、环境友好的制备方法。本实验采用一步酸沉法,以产物中黄芩苷纯度和产率为考察指标,对影响黄芩苷制备的影响因素(提取方法、提取溶剂、提取温度、料液比、提取次数、酸沉pH、酸沉保温时间、静置时间及洗酸次数)进行了全面探讨,得出一步酸沉制备黄芩苷的优化工艺条件,并首次对酸沉后的处理如洗酸次数等作了考察,且对优选工艺的稳定性进行了考察,可为工业化大规模提取生产黄芩苷提供理论基础。
1 材料与方法
1.1 实验材料
1.1.1 实验药品及试剂 黄芩药材(购自山西陵川县六泉中药材合作社,经山西大学中医药现代研究中心主任秦雪梅教授鉴定为唇形科植物黄芩Scutellaria baicalensis Georgi的干燥根);黄芩苷(批号为H0139-20140211,质量分数≥98%),购自中国药品生物制品检定所;色谱甲醇(Fisher chemistry),无水乙醇,磷酸等其他试剂均为分析纯,水为去离子水。
1.1.2 仪器与设备 高效液相色谱仪Waters e2695;Thermo BDS Hypersil C18(5 μm,4.6 mm ×250 mm)高效液相色谱柱;BP211D赛多利斯电子天平;RE52-99旋转蒸发仪(上海亚荣生化仪器厂);超声波清洗器HS2060A;中药万能粉碎机(天津市泰斯特仪器有限公司);电热恒温水浴锅(上海洪纪仪器设备有限公司);SHB-ⅢS循环水式多用真空泵(郑州长城科工贸有限公司);烘箱(北京市永光明医疗仪器实验仪器厂);TDZ5型低速离心机(长沙平凡有限公司)。
1.2 实验方法
1.2.1 提取方法 取黄芩药材,粉碎,过40目筛,取10 g黄芩粉末,适量溶剂提取1-3次,滤过,合并滤液,定容至250 ml容量瓶,冷藏备用。
1.2.2 酸沉方法 取黄芩提取液,用盐酸调节pH值至1.0-2.0,保温,静置,滤过,沉淀依次用适量水及不同浓度的乙醇洗至pH值至中性,挥发尽乙醇,60℃干燥后,即为黄芩苷产品。
1.2.3 分析方法 黄芩苷在紫外区280 nm处有稳定的特征吸收峰,本文采用高效液相色谱法分析产品中黄芩苷的含量。①色谱条件。色谱柱:Thermo BDS Hypersil C18柱(5 μm,4.6 mm ×250 mm);流动相:甲醇-水 -磷酸 (47∶53∶0.2);检测波长280 nm柱温为室温;流速 1 ml/min;进样量 10 μl。②标准曲线的绘制。准确称取黄芩苷对照品9.9 mg,置于25 ml容量瓶中,加入甲醇超声溶解,定容。摇匀后准确吸取1,2,3,5,6 ml分置于10 ml容量瓶中,加入甲醇稀释至刻度,摇匀。在上述色谱条件下测量,以黄芩苷浓度对峰面积作标准曲线(见图1),并用最小二乘法线性拟合,求得线性回归方程为:y=36 514x-215 079(R2=0.999 8),表明黄芩苷在39.6-237.6 mg/ml浓度范围内具有良好的线性关系。③黄芩苷含量的测定。准确称取黄芩苷粗粉约10 mg于25 ml容量瓶中,加入甲醇超声溶解,定容。在上述色谱条件下分析,由回归方程求得产物中黄芩苷含量。黄芩苷含量=产物中黄芩苷质量/产物质量×100%,提取物出膏率=提取物质量/原料黄芩质量×100%,黄芩苷收率=产物中黄芩苷质量/原料黄芩质量×100%。
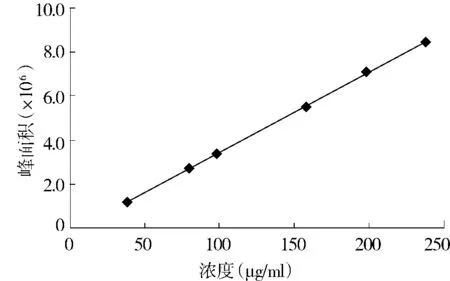
图1 黄芩苷的标准曲线Figure 1 The standard curve of baicalin
1.2.4 单因素试验 以提取液中黄芩苷含量及出膏率为指标,在提取方法实验中分别考察不同提取方法、提取溶剂、提取温度、料液比和提取次数对黄芩苷提取效果的影响;取上述黄芩提取液进行酸沉试验,以产物中黄芩苷含量及收率为指标,在酸沉方法实验中分别考察酸沉pH值、保温时间、静置时间和洗酸次数对黄芩苷纯化工艺的影响,所得产物在60℃下烘干,称重。按1.2.3所述方法测定产物中黄芩苷含量及收率。
2 结果
2.1 提取方法工艺研究
2.1.1 不同提取方法的提取效果 回流提取法、超声提取法、微波提取法的出膏率差异不大,均保持在50%左右,其中回流提取法最高,且其黄芩苷含量也最高,超声提取法的黄芩苷含量及出膏率均最低,微波提取法的提取效果略次于回流提取法(见图2)。综合考虑黄芩苷含量、出膏率及工业化应用,选择回流提取法作为后续研究方法。
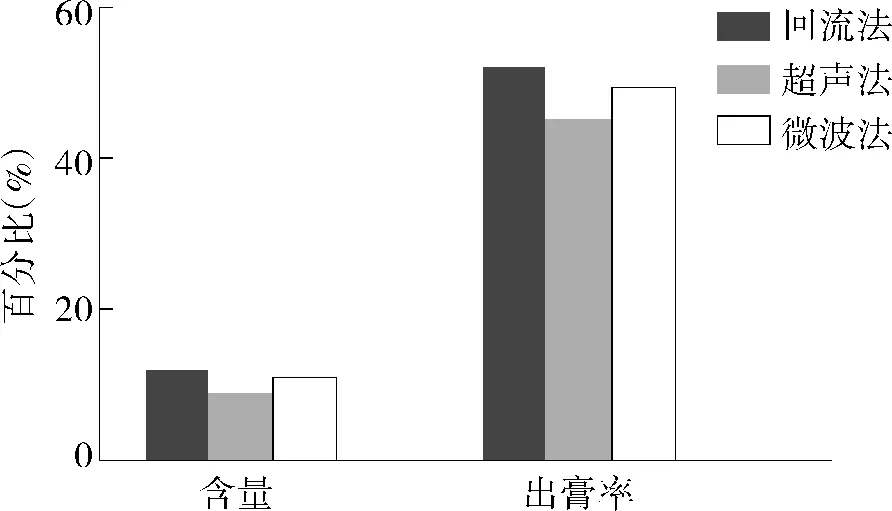
图2 提取方法对黄芩苷提取的影响Figure 2 Effect of extraction methods on extraction of baicalin
2.1.2 不同提取溶剂的提取效果 采用回流提取法,取10 g黄芩粉末,分别用10倍量水及60%乙醇提取2次,每次1.5 h,抽滤,合并两次滤液,定容至250 ml容量瓶,测黄芩苷含量及出膏率,结果见图3。由图3可以看出,当提取溶剂为乙醇时,黄芩苷含量与出膏率均略高于水作提取溶剂时的两项指标,但考虑到工业成本问题,选取水为提取溶剂。
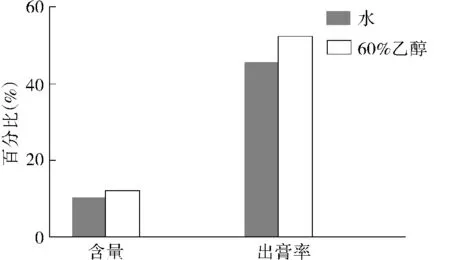
图3 提取溶剂对黄芩苷提取的影响Figure 3 Effect of extraction solvent on extraction of baicalin
2.1.3 不同提取温度的提取效果 改变提取温度,其他条件如2.1.2中方法,结果显示,随着提取温度的升高,黄芩中有效成分溶出率逐渐增加,黄芩苷含量也随之增加,但当温度超过80℃时,药材中其他杂质也随之溶出,黄芩苷含量下降(见表1),因此选取80℃为最佳提取温度。
2.1.4 不同料液比的提取效果 固定黄芩质量,改变两次提取所用溶剂量,其他条件如2.1.2中方法,结果显示,当料液比为10倍时,黄芩苷含量及出膏率均最高,继续增加料液比时,出膏率不再增加,黄芩苷含量由于杂质的溶解稍有所下降(见表2),故物料比为10倍较好,即两次提取用10倍量水。

表1 提取温度对黄芩苷提取的影响Table 1 Effect of extraction temperatureon on extraction of baicalin
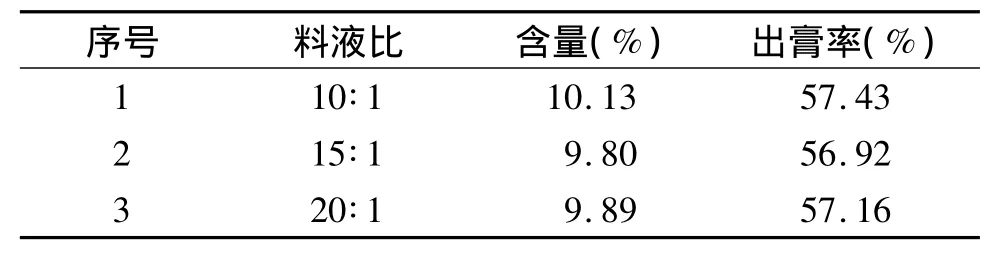
表2 料液比对黄芩苷提取的影响Table 2 Effect of solid-liquid ratio on extraction of baicalin
2.1.5 不同提取次数的提取效果 改变提取次数,其他条件如2.1.2中方法,考查提取次数对提取效果的影响。结果显示,随着提取次数的增加,黄芩苷含量及出膏率均不断增加,但提取3次相比于2次增加效果不再明显(见表3),综合考虑出膏率和含量以及经济成本各方面因素,以选择提取2次为宜。

表3 不同提取次数对黄芩苷提取的影响Table 3 Effect of extraction times on extraction of baicalin
综上,确定最佳提取工艺为10倍量水回流提取2次,每次1.5 h,提取温度为80℃。
2.2 酸沉方法工艺研究
2.2.1 不同酸沉pH值对酸沉效果的影响 取黄芩提取液,分别用盐酸调节 pH 值至 1.0,1.5,2.0,80℃保温,保温60 min,然后常温静置12 h,离心分离沉淀,沉淀依次用水及50%,95%乙醇洗至pH值为中性,挥尽乙醇,60℃烘箱干燥,即得。由表4可知,当酸沉pH为1.0时,产品中黄芩苷含量最高,pH为1.5时,黄芩苷收率较高,但仅略高于pH为1.0时的收率,最终选择在 pH值为1.0时进行酸沉。
2.2.2 酸沉保温时间对酸沉效果的影响 改变保温时间,其他实验条件同 2.2.1,实验结果见表5。随着保温时间的延长,产品中黄芩苷含量及收率均增加,保温时间为60 min时,黄芩苷含量及收率均达到最高值,故本实验取酸沉保温时间为60 min。
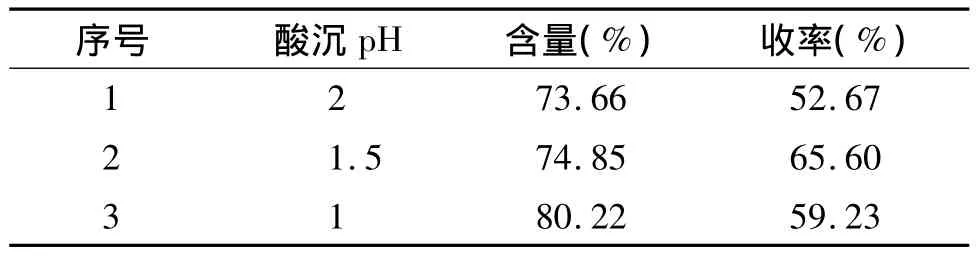
表4 不同pH值酸沉结果Table 4 Effect of different acid-precipitation pH on the contents of baicalin and yield rate

表5 不同保温时间下酸沉结果Table 5 Effect of different incubation temperature on the contents of baicalin and yield rate
2.2.3 不同静置时间对酸沉效果的影响 改变保温酸沉后静置时间,其他实验条件同2.2.1,实验结果见表6。随着静置时间增加,黄芩苷纯度和收率均增加,当静置时间超过12 h时,纯度开始下降。静置时间继续增加虽能增加一点收率,但产品的纯度有所下降。故本实验取酸沉静置时间为12 h。
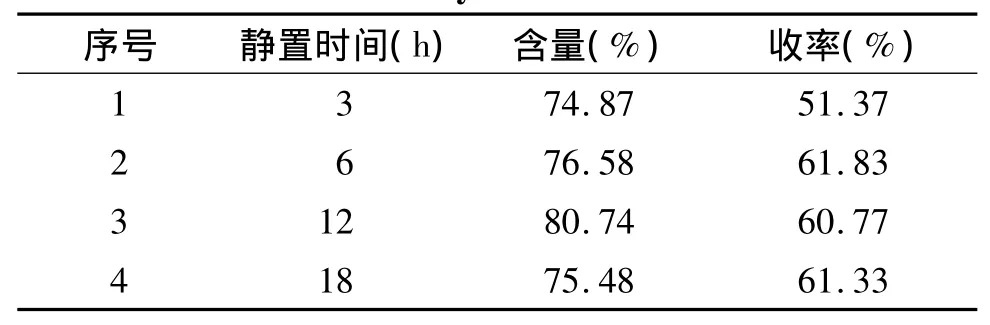
表6 不同静置时间下酸沉结果Table 6 Effect of different holding time on the contents of baicalin and yield rate
2.2.4 不同洗酸次数对酸沉效果的影响 改变酸沉后洗涤次数,其他实验条件同2.2.1,实验结果见表7。随着洗涤次数的增加,产品中黄芩苷含量增加,收率稍有下降,洗涤5次和2次与洗涤1次酸沉效果并无明显提高,综合考虑相比酸沉效果及工业成本问题,选择酸沉后洗涤1次作为后处理方式。
综上,最终确定酸沉条件为水提液加6 mol/L盐酸调节pH至1.0,80℃保温60 min,然后常温静置12 h,离心,沉淀依次用水及50%,95%乙醇各洗涤1次,洗至pH值至中性,挥尽乙醇,60℃烘干,即得。
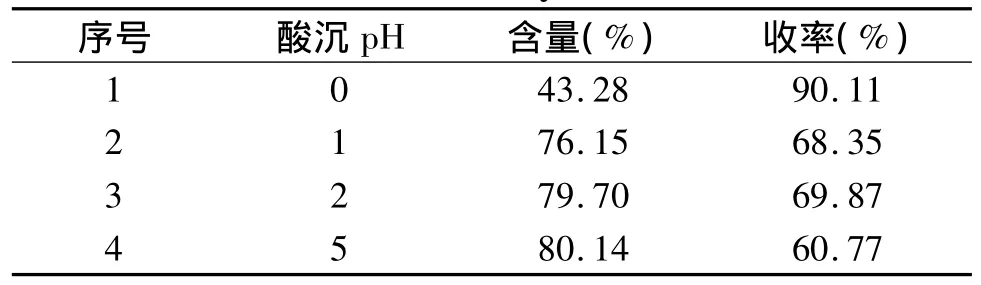
表7 不同洗酸次数下酸沉结果Table 7 Effect of different wash acid times on the contents of baicalin and yield rate
2.3 优化工艺验证试验
由上述试验得到最优工艺条件。为确定优化工艺的稳定性,即称取黄芩药材粉末10 g,用100 ml水在80℃下回流提取2次,滤过,合并两次提取液,加6 mol/L盐酸调节 pH至1.0,80℃下保温60 min,常温静置12 h,离心,沉淀依次用水及50%,95%乙醇各洗涤1次,洗至pH值为中性,挥尽乙醇,60℃烘干,平行进行三次实验。结果显示,优选的水提酸沉法制备黄芩苷的工艺稳定,重现性好,适用于工业生产(见表8)。
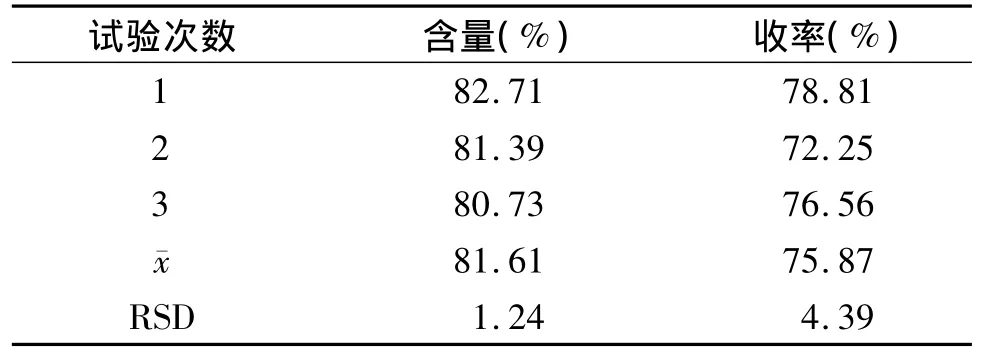
表8 优化工艺验证实验 (%)Table 8 Results of verification test for the optimal process(%)
3 讨论
通过单因素试验,得到了提取精制黄芩苷的优化工艺:10倍量水80℃回流提取2次,滤过,合并两次提取液,加6 mol/L盐酸调节pH至1.0,80℃下保温60 min,常温静置12 h,离心,沉淀依次用水及50%,95%乙醇各洗涤1次,洗至pH值为中性,挥尽乙醇,60℃烘干,即得。与其他方法相比,本方法具有得率高,快速,操作成本低,并且对环境无危害等优点。该工艺稳定,重现性好,适用于工业生产。
黄芩苷分子结构中C2上羧基常成盐形式存在,加酸后黄芩苷分子就游离出来,但这种反应必须在较高温度较长时间条件下方可使反应完全,因而控制黄芩提取液在加酸后的温度条件和反应时间十分重要,黄芩苷在高温下又极不稳定,故酸沉保温温度不宜过高。酸沉后的沉淀物分别用水和不同浓度乙醇洗至中性,水洗的目的是洗出酸处理过程中产生的无机盐及一些水溶性杂质,继用乙醇洗至pH为中性,醇洗可以洗去一部分醇溶性的杂质。
该优化工艺所得黄芩苷纯度可达80%左右,有广泛市场应用,更高纯度的黄芩苷产品有待结合其他纯化手段进一步纯化,我们将在下一步继续探索。
[1] 国家药典委员会.中国药典:Ⅰ部[M].北京:化学工业出版社,2010:282-283.
[2]张红医,赵淑军,成谦,等.中药黄芩提取方法的优化[J].河北大学学报(自然科学版),2006,26(4):390-395.
[3]韩鲁佳,阎巧娟,汪正强.黄芩苷提取分离方法及工艺研究[J].农业工程学报,2000,16(6):118-122.
[4]蒋巍,刘艳杰,张吉波.黄芩苷含量测定方法研究进展[J].天津化工,2006,20(6):10-11.
[5]李晓芳,傅军,金描真,等.黄芩水提取工艺中黄芩苷降解动力学研究[J].现代食品与药品杂志,2006,26(4):27-29.
[6]李成文,闫东海,陈建玉.黄芩苷提取工艺研究[J].中成药,2003,25(8):666-669.
[7]唐海燕,牛雪平,卢慧斌,等.黄芩中黄芩苷的提取工艺研究[J].内蒙古大学学报(自然科学版),2004,35(3):355-358.
[8]雷泞菲.黄芩中黄芩苷提取工艺研究[J].时珍国医国药,2007,18(11):2664-2666.
[9]龚盛昭,袁水明.黄芩甙的提取工艺改进研究[J].广东化工,2002,29(6):5-7.
[10]Lu HT,Jiang Y,Chen F.Application of high-speed counter-current chromatography to the preparative separation and purification of baicalin from the Chinese medicinal plant Scutellaria baicalensis[J].J Chromatogr A,2003,1017:117-123.
